SIRT1介导的七氟醚后处理对失血性休克复苏小鼠学习与记忆损伤的保护作用
黄晓童,黄春霞,胡宪文
(麻醉与围术期医学安徽普通高校重点实验室,安徽医科大学第二附属医院麻醉与围术期医学科,安徽 合肥 230601)
失血性休克是创伤导致患者死亡的重要原因之一,目前通常采用快速灌注液体的方法以迅速恢复循环血容量治疗失血性休克。当采取积极措施恢复机体血供时,脑组织因其较为脆弱会受到二次损伤,称之为脑缺血/再灌注损伤(cerebral ischemia-reperfusion injury,CIRI)。有研究发现丙泊酚通过抑制凋亡诱导因子(apoptosis-inducing factor,AIF)介导的大鼠全脑的缺血/再灌注损伤(ischemia reperfusion injury,IRI)诱导的细胞凋亡,从而减轻CIRI[1]。沉默信息调节因子(silent information regulation 1,SIRT1)参与多种生物代谢活动,如炎症反应、细胞衰老与凋亡、氧化应激及肿瘤形成等[2-3]。有研究指出,Maresin-1治疗通过激活SIRT1信号来减少炎症反应和线粒体损伤,从而减轻CIRI[4]。我们前期研究结果发现,七氟醚后处理可能通过上调SIRT1和过氧化物酶体增殖物受体γ共激活因子-1α(peroxisome proliferator-activated receptor γ coactivator-1α,PGC-1α)降低氧化应激反应水平,从而对CIRI起到积极的保护作用[5]。然而基于SIRT1通路的七氟醚后处理脑保护作用的具体机制目前尚未有研究。本实验拟用特异性的SIRT1抑制剂研究SIRT1在七氟醚后处理小鼠失血性休克与复苏中的作用,以进一步探讨七氟醚后处理发挥脑保护作用的分子机制。
1 材料与方法
1.1 动物从安徽医科大学动物实验中心购买C57BL/6J小鼠(8-10周龄,♂)进行实验,动物使用许可证号是SYXK(皖)2017-006。
1.2 试剂七氟醚(艾伯维公司,83291),EX527(美国Sigma公司,E7034-5MG),TTC染料(美国Sigma公司,T8877),BCA蛋白浓度测定试剂盒和RIPA(碧云天生物技术有限公司,P0012,P0013K),SIRT1抗体(Cell Signaling Technology,9475S),Bax抗体(Cell Signaling Technology,2772S),Bcl-2抗体(Cell Signaling Technology,3498S),Cleaved-caspase-3抗体(Cell Signaling Technology,9664S),ECL显影液(美国Thermo Fisher Scientific公司,32109),β-actin抗体(中杉金桥生物技术有限公司,TA-09), TUNEL试剂盒(罗氏公司,12156792910)。
1.3 仪器七氟醚蒸发罐(Grager公司),凝胶成像系统(上海天能科技有限公司),多功能酶标仪(Thermo Fisher Scientific公司),动物行为视频分析系统(深圳市瑞沃德生命科技有限公司),RSP01-C单通道双向推拉注射泵(嘉兴贝塔仪器有限公司),麻醉气体检测仪(深圳迈瑞生物医疗电子股份有限公司)。
1.4 动物分组、模型建立及给药根据随机数据表法将小鼠分为5组(每组15只):假手术组(Sham组)、失血性休克与复苏组(Shock组)、七氟醚组(Sevo组)、SIRT1特异性抑制剂EX527+七氟醚组(EX527+Sevo组)、SIRT1特异性抑制剂EX527组(EX527组)。Sham组仅进行右侧颈总动脉、颈静脉置管,不进行抽血。Shock组分离出右颈总动脉和颈静脉后,分别向近心端置入PE10管。经颈静脉输注肝素300 U·kg-1,观察10 min后,利用输液泵将小鼠总血容量50%的血液在30 min内经右颈总动脉匀速抽出,抽出的血液存储于无菌2 mL注射器中。1 h后,将血30 min内回输,建立失血性休克与复苏模型。Sevo组先建立失血性休克模型,在回输血液即刻吸入2.4%七氟醚。小鼠体温在实验过程中维持在37 ℃左右。EX527+Sevo组在动静脉置管前30 min经腹腔注射SIRT1特异性抑制剂EX527 10 mg·kg-1,其余操作同Sevo组。EX527组在动静脉置管前30min经腹腔注射SIRT1特异性抑制剂EX527 10 mg·kg-1。
1.5 小鼠空间与学习记忆能力测定、逃避潜伏期实验以及空间探索实验各组小鼠于术后d 4-10进行水迷宫实验。将小鼠面向池壁放入水中,放入位置随机取Ⅰ、Ⅱ、Ⅲ、Ⅳ四个象限之一,在60 s内找到平台的时间为逃避潜伏期(escape latency period)。动物行为视频分析系统追踪小鼠的运动轨迹,记录小鼠寻找平台的时间(潜伏期)。每只小鼠每天进行4次训练,两次实验间隔15-20 min,当日成绩为4次成绩的平均值,连续6 d,实验于每天14 ∶00-18 ∶00之间进行。另外,观察小鼠60 s内在目标象限游泳的路程。
1.6 TTC染色水迷宫实验结束后(术后d 10)取脑组织切片行TTC 染色,具体操作严格按照试剂盒说明书进行。简而言之,将脑切片在2%的2,3,5-三苯基四唑氯化物(TTC)中染色,并在37 ℃下孵育30 min。然后,将脑切片在4%多聚甲醛中固定24 h。使用光学显微镜(Olympus Corporation)捕获图像。白色区域为梗死区域,红色区域为正常区域。计算公式为:梗死体积比例/%=[(梗死面积×2 mm)/(2×全脑面积×2 mm)]×100%。
1.7 TUNEL染色水迷宫实验结束后(术后d 10)取脑组织做冰冻切片,进行TUNEL染色,具体操作严格按照试剂盒说明书进行。将冰冻切片放入PBS液中清洗,渗透反应液冰上反应5 min,放入PBS液中清洗,滴加混合反应液后置于37 ℃保温箱中反应120 min,放入PBS液中清洗,DAB显色,脱水,封片,各组动物每张切片取海马CA1区视野,在显微镜下观察TUNEL染色阳性细胞。
1.8 Western blot法水迷宫实验结束后(术后d 10),取海马组织匀浆,于4 ℃下13 200 r·min-1离心30 min,取上清,用BCA试剂盒测定蛋白含量,取50 μg样品上样,SDS-PAGE凝胶电泳,转膜、封闭、加入一抗,4 ℃孵育过夜。次日加入二抗,室温孵育2 h。凝胶成像系统拍照,通过ImageJ软件测定蛋白条带灰度值。
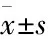
2 结果
2.1 各组小鼠潜伏期比较如Fig 1所示,从d 5开始,Sevo组和Sham组小鼠的潜伏期明显短于Shock组(P<0.05)。EX527和Sevo联合处理可延长小鼠的潜伏期,此外,我们发现Sham组和EX527处理组小鼠的潜伏期差异无显著性。

Fig 1 Comparison of latency period in five
2.2 各组小鼠目标象限路程比较如Fig 2所示,Sevo组和Sham组小鼠的目标象限路程明显长于Shock组(P<0.05),EX527+Sevo组小鼠的目标象限路程较Sevo组相比明显缩短(P<0.05),Sham组与EX527组小鼠目标象限时间百分比差异无统计学意义。
2.3 各组小鼠脑梗死体积比较TTC染色实验结果显示:Shock组与EX527+Sevo组小鼠的脑梗死体积明显增加,而Sevo处理后脑梗死体积明显降低。同时,我们还发现,与单纯的Sevo组相比,EX527+Sevo组小鼠脑梗死体积增加(P<0.05),见Fig 3。

Fig 2 Comparison of path of crossing originplatform quadrant in each

Fig 3 Effects of sevoflurane postconditioningon infarct size of brain in
2.4 各组小鼠TUNEL染色结果比较TUNEL染色结果显示:Shock组与EX527+Sevo组小鼠的TUNEL染色阳性细胞增多,而Sevo处理后TUNEL染色阳性细胞减少。同时,与单纯的Sevo组相比,EX527+Sevo组小鼠TUNEL染色阳性细胞增多,见Fig 4。

Fig 4 TUNEL staining results of mice in each group(×300)

Fig 5 Effects of sevoflurane postconditioning on expressionof SIRT1 and Bax, Bcl-2,
2.5 SIRT1和凋亡相关蛋白的表达情况我们采用Western blot对各组小鼠脑组织中相关蛋白进行了检测,结果显示:与Sham组比较,Shock组SIRT1、抗凋亡蛋白Bcl-2蛋白表达降低,而促凋亡蛋白Bax、Cleaved-caspase3蛋白表达升高(P<0.05)。此外,Sevo组与Shock组相比,小鼠脑组织中SIRT1蛋白表达水平和Bcl-2的表达水平升高(P<0.05),而Bax、Cleaved-caspase-3表达下降(P<0.05)。
3 讨论
CIRI是指缺血脑组织在一定的时间内恢复血供时,不仅没有恢复正常脑功能,反而加重脑损伤。急性重度失血性休克和再灌注会导致神经元严重的损害。CIRI涉及多种机制,如内质网应激反应、兴奋性氨基酸/氧自由基、线粒体损伤、钙超载、炎症反应、细胞凋亡等[6-7]。有文章提出橄榄苦苷(Oleuropein, OL)通过上调凋亡重要标志物Bcl-2的表达和下调Bax的表达来发挥抗凋亡作用,是一种潜在的脑卒中治疗方法[8],这为我们的实验设计也提供了思路。Zhang等[9]的研究指出,七氟烷处理可以明显的改善IRI动物模型后小鼠的记忆和学习功能,这与我们的七氟烷后处理失血性休克复苏小鼠在Morris水迷宫实验中的结果一致,其主要表现为小鼠逃避潜伏期明显缩短,且活动路程减少。同时,我们发现七氟醚后处理可以明显减少CIRI引起的脑梗死体积,说明七氟醚具有一定的神经保护作用。
SIRT1蛋白在多数生物活动中具有不可或缺的作用。SIRT1介导的信号通路与改善学习记忆、认知功能密切相关。近年来研究表明, SIRT1是细胞内信号转导网络的核心靶点,其在调控细胞衰老、细胞凋亡等方面均发挥着重要作用[10]。在局灶性脑缺血中,敲除大鼠SIRT1后,脑梗死面积增大[11]。研究中发现SIRT1可以调控视网膜细胞中的能量代谢,通过抑制IRI后的线粒体损伤,从而对视网膜细胞起到IRI后的保护作用[12]。神经元细胞是完全依靠线粒体提供的ATP来维持其神经活性和功能,因此线粒体功能紊乱程度与神经元细胞损伤程度密切相关[13]。凋亡刺激会导致线粒体内膜上的非特异通道mPTP开放[14],而mPTP开放则被认为是线粒体功能障碍的最初原因之一[15]。我们发现SIRT1在七氟烷处理之后的小鼠脑组织中的蛋白表达水平明显提高,此前有研究表明,小鼠IRI手术处理之后的脑组织中SIRT1的表达水平明显降低[16],而进一步促进SIRT1的表达则会明显减轻IRI导致的神经损伤,充分证明了SIRT1参与了七氟烷后处理对失血性休克复苏小鼠学习与记忆损伤的保护作用。
有研究指出,IRI带来的炎症损伤可以明显促进小鼠神经元的凋亡[10]。在脑缺氧缺血及再灌注过程中,细胞凋亡是神经元受损的主要形式之一,而Bcl-2和Bax是凋亡家族中调控细胞凋亡的两个主要基因,其中Bcl-2作为典型的抗凋亡蛋白而Bax作为促凋亡蛋白,两者的异常表达与凋亡调控及凋亡严重程度直接相关[17]。在Wang等[7]的研究中发现,SIRT1过表达会抑制PC12细胞在氧糖剥夺复氧(OGD/R)处理之后的Bax表达和caspase-3蛋白的激活。然而在Chai等[11]的研究中发现,SIRT1会促进Bcl-2的表达,从而抑制细胞凋亡。类似的,我们发现IRI之后,SIRT1和Bcl-2的表达水平明显降低,而Bax和caspase-3的蛋白表达水平明显提高,说明IRI会明显促进神经元凋亡,但是进一步使用七氟烷处理则会明显促进SIRT1的表达而抑制神经元的凋亡,这与之前的文献报道一致[10]。SIRT1 介导的信号通路起着非常重要的作用,我们进一步使用SIRT1特异性抑制剂EX527抑制七氟烷处理后小鼠中SIRT1的表达,发现小鼠脑组织中的梗死面积又具有明显的升高,同时,小鼠到达Morris水迷宫平台的潜伏期明显增加,且活动路程明显增加。课题组前期研究发现,七氟醚后处理可能通过激活PI3K-Akt-eNOS信号通路,抑制细胞凋亡,从而减轻CIRI损伤, PI3K/Akt/eNOS是体内细胞信号传导的常见通路,在调控细胞的周期活动、启动细胞凋亡、促进新生血管的生成和调节端粒酶的活性等许多方面均发挥了重要作用。我们发现SIRT1可以通过NF-kB信号通路调控PI3K的磷酸化,从而促进Akt/eNOS信号通路的激活,PI3K/Akt通路参与了七氟醚后处理的神经保护作用并已被证明在减轻细胞损伤的机制中发挥关键作用,eNOS作为下游分子在维持血管正常功能、血流量以及预防神经细胞损伤方面扮演了重要的功能,并且参与了细胞凋亡的调节,具有抗细胞凋亡作用[18]。本研究结果表明,七氟醚后处理可提高失血性休克复苏小鼠的学习与记忆能力,减轻IRI损伤所致的脑梗死,增加海马组织中SIRT1和Bcl-2的表达,减少促凋亡蛋白的表达。与Sevo组相比,EX527+Sevo组小鼠的学习与记忆能力明显下降,脑梗死体积也明显增加,而SIRT1与凋亡相关蛋白表达却无差异,可能是因为实验周期略长,小鼠体内的EX527被完全代谢,对SIRT1的抑制作用消失甚至出现反跳现象。我们后期会进行急性期的实验以对本实验结果进一步验证。本实验结果提示,SIRT1可能介导了七氟醚后处理对失血性休克复苏小鼠的脑保护作用,并通过抑制凋亡发挥作用。

