Nrf2/HO-1/GPX4对高糖诱导足细胞铁死亡的影响及小檗碱的干预机制研究
关锡梅,解勇圣,倪伟建,唐丽琴
(1.安徽中医药大学药学院,安徽 合肥 230012;2.中国科学技术大学生命科学与医学部,安徽 合肥 230001;3.安徽医科大学药学院,安徽 合肥 230032;4.中国科学技术大学附属第一医院(安徽省立医院)药剂科,安徽 合肥 230001)
糖尿病肾病(diabetic nephropathy,DN)是II型糖尿病中最严重的微血管并发症之一,其发病机制复杂,已成为世界范围内终末期肾脏病的首要原因[1]。足细胞作为肾脏组织中重要的固有细胞,位于肾小球基底膜的最外层,与内皮细胞层、肾小球基底膜共同构成了肾小球的3层滤过屏障,以保证肾小球毛细血管壁的选择通透性。研究发现,足细胞特殊的形态和结构对肾小球的完整性起到关键作用,其结构完整以及数量的恒定可以维持肾脏的正常滤过能力[2]。研究足细胞的死亡方式,为其治疗提供新的方向和靶点已经成为该领域的研究热点。
细胞的死亡方式包括凋亡、自噬、铁死亡、坏死及焦亡等。铁死亡是新定义的一种区别于凋亡、自噬的细胞程序性死亡过程,特征在于细胞内脂质氧自由基的异常增高[3]。文献报道前列腺素内过氧化物合酶(prostaglandin endoperoxide synthase 2, PTGS2)在铁死亡发生时被显著上调;ACSL4作为脂肪酸代谢的第一步,在体内催化合成脂酰CoA,将长链多不饱和脂肪酸活化[4],以参加膜磷脂的合成,但是这些膜上的长链不饱和脂肪酸常被氧化,从而诱发铁死亡。GPX4作为氧化应激和细胞死亡信号的传感器,其表达量的降低会导致体内活性氧的明显升高,被认为是触发铁死亡程序的重要靶点。
小檗碱(berberine,BBR)是天然植物黄连根茎中提取的生物碱,具有抗氧化应激[5]、抗炎、降低血糖的作用。课题组前期已经深入研究了高糖刺激下足细胞自噬与凋亡的关系,但是对于足细胞中铁死亡的现象还有待进一步的探讨。小檗碱可以通过调节凋亡自噬相关信号通路,明显改善高糖刺激下足细胞的凋亡[2, 6]以及系膜细胞增殖[7]的情况,但对于足细胞内铁死亡现象的调控作用尚未研究。此次实验采用体外持续性高糖刺激足细胞模拟糖尿病肾病的体内环境,探究凋亡发生之前足细胞是否存在铁死亡现象,进一步探讨小檗碱缓解高糖诱导足细胞损伤的作用机制,在临床上为疾病发生的更早阶段提供新思路和实验依据,进而寻找到新的治疗靶点。
1 材料与方法
1.1 材料
1.1.1细胞培养 肾小球足细胞MPC5,购于北京北纳创联生物技术研究院,货号: 337685; 在33 ℃,10%血清,1%双抗,1×104U·L-1γ-干扰素条件下增殖,经37 ℃无γ-干扰素诱导10-14 d后分化成熟。
1.1.2药物 盐酸小檗碱, 购于北京北纳创联生物技术研究院,货号为: BWB50137,纯度≥98%。
1.1.3试剂 CCK-8细胞活力试剂盒,贝博生物(货号:BB4202);小鼠重组γ干扰素,MCE公司(批号:33158);BeyoClickTMEdU-488细胞增殖试剂盒,碧云天(货号:C0071S);GSH和GSSG检测试剂盒,碧云天(货号:S0053);RPMI 1640培养基,Hyclone公司(货号:SH30809.01);GAPDH,HO-1,均购自Cell Signaling Technology(货号:5174,#82206);Nrf2,GPX4购自美国abcam公司(货号:ab137550,ab125006),desmin购自Proteintech公司(货号:60226-1-lg);podocin,购自Santa cruz(货号:sc-518088);BCA 试剂盒,碧云天(货号: P0010S);胎牛血清,Biological Industries(货号:2022057); 辣根过氧化物酶标记的山羊抗鼠lgG,辣根过氧化物酶标记的山羊抗兔lgG,Proteintech 公司;两步法逆转录试剂盒,Vazyme(货号:R323-01);SYBR qPCR试剂盒,Vazyme(货号:Q711-02);TRIzol试剂盒,Invitrogen。
1.1.4仪器 CO2培养箱(Heal Force公司) ; 流式细胞仪(Beckman Coulter 公司) ; 酶标仪(Molecular Devices公司) ; 凝胶成像系统(Peiqing公司) ; 荧光倒置显微镜(Leica公司);激光共聚焦显微镜(Leica 公司);荧光定量ABI7500(Thermo Fisher Scientific公司)。
1.2 方法
1.2.1足细胞活力检测 96孔板中接种合适细胞密度分化成熟的足细胞,于37 ℃,5% CO2培养箱中培养24 h后进行不同处理。设置空白对照组(blank),正常对照组,高糖模型组(33.3 mmol·L-1)以及不同浓度小檗碱(终浓度为7.5、15、30、60、90、120、150 μmol·L-1)组,37 ℃继续培养24 h。按照CCK-8试剂盒说明进行后续操作,用酶标仪测定每孔450 nm处的吸光度,并计算细胞的活力值。
1.2.2EdU检测足细胞增殖 将合适密度(1×105个)足细胞接种于24孔板中,培养 24 h 后,不同组经高糖刺激不同时间(0 h、6 h、12 h、24 h、36 h)后,按照试剂盒操作固定细胞并染色,将24孔板置于荧光倒置显微镜下,以495 nm激发波长,519 nm 发射波长拍照,EdU绿色荧光代表正处于DNA复制期的细胞,Hoechst荧光代表所有的活细胞。
1.2.3活性氧水平的测定 将合适密度足细胞接种于6孔板,置于37 ℃,5% CO2下培养24 h后,依次加入正常培养基,高糖培养基(33.3 mmol·L-1)以及小檗碱 (60 μmol·L-1)溶液,37 ℃继续孵育24 h后,弃去上清液,每孔加入2 μL DCFH-DA(非标记性的氧化敏感的荧光探针,终浓度为10 μmol·L-1),置于37 ℃继续孵育20 min。最后,用无血清细胞培养液洗涤细胞3次后,荧光显微镜下调整参数至激发波长为488 nm,发射波长为525 nm后进行拍照。
1.2.4谷胱甘肽水平的测定 收集各组细胞,吸弃上清,按照试剂盒说明对细胞样本进行处理:加入3倍细胞沉淀体积的蛋白去除试剂M溶液,充分Vortex后,对样品进行两次液氮和37 ℃的快速冻融后4 ℃放置5 min,4 ℃高速冷冻离心机,10 000g离心10 min。取上清立即用酶标仪测定A412,并对比各组的含量变化情况。
1.2.5激光共聚焦显微镜检测 将分化成熟的足细胞在激光共聚焦小皿中培养,室温4%多聚甲醛对细胞进行固定,经PBS 洗涤3次后,3%的BSA 封闭30 min,并与 desmin一抗(1 ∶500) 4 ℃孵育过夜。次日,室温下与二抗(1 ∶200)孵育2 h,随后进行 DAPI 染色10 min,PBS洗涤后即可在激光共聚焦显微镜下观察。
1.2.6透射电子显微镜 收集不同处理组细胞,使用戊二醛 在4 ℃固定12 h,1%OsO4固定2 h后,梯度乙醇脱水,70%醋酸铀染色6 h,乙醇脱水后环氧树脂包埋3 h,并在60 ℃烘箱中放置48 h,使用超微切片机切片(NOVA, LKB, Sweden)。最后用铅和铀对样品进行染色,并用透射电子显微镜(HT7700)进行观察。
1.2.7Western blot 收集不同处理组的细胞,使用RIAP裂解液提取细胞总蛋白和细胞核蛋白提取试剂盒提取胞核蛋白,经BCA试剂盒蛋白定量后,通过SDS-PAGE凝胶电泳对蛋白样品进行分离后即转移至乙醇活化后的PVDF膜上。用5%脱脂牛奶室温封闭2 h,一抗4 ℃孵育过夜,1×TBST漂洗3次,每次10 min;辣根过氧化酶标记的二抗(1 ∶10 000)室温孵育2 h,1×TBST漂洗3次后,ECL显影。蛋白条带使用ImageJ进行灰度分析, 以GAPDH为内参基因计算各组蛋白的相对表达水平。
1.2.8RNA提取及RT-qPCR 取处理好的细胞,按照TRIzol提取说明书收集细胞总RNA,测定其浓度和纯度后保存于-80 ℃。按Vazyme试剂盒R323-01反应程序:42 ℃ 2 min,37 ℃ 15 min,85 ℃ 5 s,4 ℃ 合成cDNA;产物立即用于实验或-20 ℃保存。取稀释后cDNA按照real-time PCR说明书进行反应,反应程序为:预变性95 ℃ 30 s;95 ℃ 10 s,60 ℃ 30 s,40个循环;溶解曲线为:95 ℃ 15 s,60 ℃ 60 s, 95 ℃ 15 s。GAPDH 上游引物为:5′-AGGTCGGTGTGAACGGATTTG-3′,下游引物为:5′-GGGGTCGTTGATGGCAACA-3′;Nrf2 上游引物为:5′-CTCCTGGACGGGACTATTGA-3′,下游引物为:5′-TGGGTCTCCGTAAATGGAAG-3′;HO-1 上游引物为:5′-CACGCATATACCCGCTACCT-3′,下游引物为:5′-CCAGAGTGTTCATTCGAGCA-3′;GPX4上游引物为:5′-TGTGCATCCCGCGATGATT-3′,下游引物为:5′-CCCTGTACTTATCCAGGCAGA-3′。每组设置 3 个复孔,运用2-ΔΔCT的方法进行数据统计。
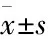
2 结果
2.1 不同高糖刺激时间对足细胞标志蛋白desmin、podocin及铁死亡标志物GPX4、PTGS2、ACSL4的影响Western blot 结果显示,随着高糖刺激时间的增加,在12 h时,desmin发生明显上调(P<0.01);足细胞特异性蛋白podocin与铁死亡标志物GPX4在24 h蛋白表达水平达到最低(P<0.01);见Fig 1A, B。RT-qPCR结果显示随着高糖时间的增加,GPX4的mRNA水平在24 h显著性下调(P<0.05);ACSL4的mRNA水平在24 h发生明显变化(P<0.01),并在36 h有降低的趋势;PTGS2的mRNA水平在12 h发生明显上调且一直升高(P<0.01);见Fig 1C。
2.2 EdU检测高糖刺激不同时间足细胞的增殖情况结果如Fig 2所示,图中绿色细胞为处于增殖状态的细胞,蓝色细胞表示总的细胞。染色结果显示随着高糖刺激时间的增加,足细胞的增殖速率在24 h明显降低。
2.3 BBR对高糖损伤足细胞活性的影响Fig 3的CCK-8结果显示,高糖刺激24 h后,足细胞活力明显下降;与高糖模型组比较,小檗碱(30、60、90 μmol·L-1)差异均有显著性,可以不同程度地增强足细胞的活力。

Fig 1 Relative expression of desmin, podocin, GPX4, ACSL4 and PTGS2 in HG-induced podocytes at different time points n=3)
2.4 BBR对高糖诱导足细胞标志及铁死亡相关信号通路蛋白的影响Podocin是维持足细胞功能完整性的重要蛋白。Nrf2/HO-1/GPX4信号通路与铁死亡密切相关。Western blot结果表明,与正常对照组相比较,高糖组足细胞的podocin、GPX4的蛋白表达明显降低(P<0.01);与高糖模型组比较,BBR(60 μmol·L-1)能明显增加podocin、Nrf2、HO-1、GPX4蛋白的表达(P<0.01)(Fig 4)。RT-qPCR结果显示,高糖组的PTGS2、ACSL4比正常对照组明显升高(P<0.01),GPX4明显下调(P<0.01),Nrf2、HO-1基本不变;与高糖组相比,小檗碱(60 μmol·L-1)可以明显降低PTGS2和ACSL4的mRNA表达(P<0.01),并且升高Nrf2、HO-1、GPX4的mRNA水平(P<0.05),见Fig 5。

Fig 2 Effect of podocyte proliferation by high glucose at different time points (×200, n=3)

Fig 3 Effect of BBR on viability of podocytes by high glucose at 24 h n=18)
如Fig 6激光共聚焦显微镜显示,与正常对照组相比,desmin的荧光强度明显升高,与高糖模型组相比,小檗碱(60 μmol·L-1)组可以降低desmin的荧光强度,缓解足细胞的损伤。
2.5 BBR对高糖刺激下足细胞内氧化应激水平及形态学的影响荧光倒置显微镜观察不同组内ROS含量变化的结果显示,正常对照组中也有ROS的产生,但是含量较少,表明足细胞本身具有一定的ROS生成能力,高糖刺激后,细胞内的ROS明显增加(P<0.01),小檗碱(60 μmol·L-1)组可以减弱高糖刺激下足细胞的ROS生成(P<0.01),见Fig 7A,B。GSH检测结果表明,高糖模型组的GSH水平比正常对照组低(P<0.01);与高糖模型组相比,小檗碱(60 μmol·L-1)组则可以明显上调GSH的水平 (P<0.05),见Fig 7C。透射电子显微镜结果显示,高糖组线粒体明显变小伴膜密度增加,线粒体嵴减少。与高糖组相比,小檗碱(60 μmol·L-1)组能明显改善线粒体的形态变化,见Fig 8。

Fig 4 Effect of BBR on protein expression of Nrf2, HO-1, GPX4 and podocin n=3)

Fig 5 Effect of BBR on mRNA expression of GPX4, PTGS2, ACSL4, Nrf2, HO-1 n=3)

Fig 6 Effect of BBR on positive expression of desmin (n=3)
3 讨论
肾小球滤过屏障的破坏是糖尿病肾病进展的主要途径[8]。肾小球足细胞是高糖作用的靶细胞,足细胞数量的减少会造成肾小球滤过屏障破坏,进而发展成肾小球硬化,肾功能衰竭等症状,因此对足细胞的死亡进行干预治疗对疾病的发生发展有重要意义。铁死亡由Dixon等[3]研究Erastin杀死RAS突变得到肿瘤细胞作用机制时发现,主要是细胞内“铁”依赖脂质氧自由基异常增高、氧化还原稳态失衡而致。胱氨酸-谷氨酸逆向转运体(系统xc-)的紊乱会导致GPX4失活,脂质氧化物不能经过GPX4催化的谷胱甘肽还原酶反应代谢,继而发生类似Fenton反应的方式氧化脂质产生大量的活性氧[9]。本次实验检测到高糖刺激下铁死亡标志蛋白GPX4的明显下调以及ACSL4、PTGS2的明显升高,透射电子显微镜下足细胞线粒体体积缩小,双层膜密度增加,线粒体嵴减少或消失;足细胞内GSH的耗竭,ROS水平明显升高等现象,提示可能存在铁死亡的现象。采用高糖持续性刺激足细胞,探究除凋亡和自噬之外足细胞的死亡方式,发现铁死亡标志物GPX4、PTGS2及ACSL4的表达量随着高糖刺激时间的增加而变化,GPX4在24 h时发生显著性降低,但是在36 h的时候表达恢复正常。原因可能在于自噬与铁死亡是正向关系[3],随着高糖刺激时间的增加,在36 h时,自噬可能被抑制,因此GPX4增加,铁死亡现象减少。

Fig 7 Effect of BBR on levels of oxidative stress in HG-induced podocytes n=3)

Fig 8 Effect of BBR on morphological changes of HG-induced podocytes (×20 000, n=3)
此次实验发现了一种不同于凋亡和自噬以外的新的足细胞死亡方式。在高糖环境下,足细胞在24 h铁死亡较为显著,随后铁死亡逐渐减弱。结合课题组前期[2]已发表研究成果表明高糖刺激足细胞24 h出现一定程度的凋亡,随着时间的推移,刺激36 h足细胞凋亡更为显著。分析以上结果,提示在高糖刺激导致足细胞死亡的过程中,细胞并非传统认识中存在单一的死亡方式,而是多种死亡方式并存,区别在于不同时间段不同细胞死亡方式占据主导地位;另一方面也提示在通过靶向足细胞干预治疗糖尿病肾病时,不同时间段需针对细胞发生的主要病理特征选择有针对性的干预策略,以达到疾病的精准治疗目的。
文献报道,体内活性氧的明显升高与糖尿病肾病密切相关,通过抗氧化药物治疗,从而逆转氧化应激对组织造成的损伤,阻止或延缓疾病的发生、发展[10]。当足细胞受到持续性高糖刺激,会产生应激反应,造成体内活性氧的明显升高,从而对机体造成损伤。此研究中证明随着高糖刺激时间的增加,GPX4活性会发生明显降低[11],从而抑制细胞内脂质过氧化物的清除,使细胞内活性氧堆积。Nrf2是启动内源性抗氧化反应元件的转录因子[12],受到外界活性氧等刺激下会发生核转运发挥抗氧化应激能力。Western blot结果显示,在高糖环境下,BBR可以明显增加Nrf2的核转移,激活下游大量的抗氧化酶基因如HO-1和GPX4等的转录,进而减少足细胞铁死亡现象。
综上所述,BBR抑制足细胞铁死亡的作用机制可能与Nrf2/HO-1/GPX4信号通路有关,其详细机制还需近一步实验加以验证,后续实验将通过对Nrf2进行小分子RNA干扰以及构建过表达质粒,并设置铁死亡抑制剂的方法,对BBR如何调控足细胞铁死亡的机制进行蛋白和基因水平上更深层次的研究。
(致谢:本实验完成于中国科学技术大学附属第一医院药剂科药物基因检测实验室,向全体老师和同学们表示感谢。)

