YAP-c-Myc信号通路抑制涉及冬凌草甲素抗神经胶质瘤作用
王 宸,陈 爽,马晓娇,校 欢,邱红梅
(重庆医科大学药理学教研室,重庆市生物化学与分子药理学重点实验室,重庆 400016)
胶质瘤(glioma)是一种起始于大脑或脊柱神经胶质细胞的常见肿瘤,由于其发病位置的特殊性,具有较高的发病率和死亡率等特点[1]。胶质瘤通常采用的治疗方法为手术切除、放疗和化疗,但尽管采取了这些干预措施,高级别肿瘤患者平均总生存期不到15个月,治疗现状与手术预后仍不乐观[2]。中药药物治疗具有巨大的应用前景,研究证明部分中药单体成分对恶性肿瘤能产生一定的治疗效果[3],因此研究有效中药单体成分是否具有抗胶质瘤作用可为其治疗提供新的药物治疗思路。
冬凌草甲素(oridonin,ORI)是冬凌草的主要活性成分,是一种有生物活性的贝壳杉烷型四环二萜类天然有机化合物,具有抗感染、抗炎等作用,研究报道其还对多种癌症具有抗癌活性[4],被认为是一种有前景的肿瘤治疗药物。研究证明,ORI可通过诱导细胞凋亡和细胞周期阻滞来抑制神经母细胞瘤细胞的生长[5]。目前,关于ORI抗肿瘤的分子机制研究逐渐进入研究者的视野,已有研究证明ORI可以通过调控AMPK/Akt/mTOR、Wnt/β-catenin[6]、Bcl-2[7]等信号通路发挥抗恶性肿瘤作用。Yes相关蛋白(Yes associated protein,YAP)是Hippo通路中最核心的转录共激活因子,有研究发现其在胶质瘤中高表达,下调YAP可以抑制胶质瘤增殖、侵袭和迁移[8],而ORI是否可以作用于YAP-Hippo通路而抑制胶质瘤尚未见报道。因此,本研究采用神经胶质瘤U87细胞研究ORI抗神经胶质瘤作用并探讨其可能机制是否涉及抑制YAP-c-Myc信号通路。
1 材料与方法
1.1 材料
1.1.1细胞株 神经胶质瘤U87细胞购自American Type Culture Collection(ATCC)。
1.1.2药物与试剂 ORI(TargetMol,批号T2790-1,纯度99.5%);二甲基亚砜DMSO(北京鼎国昌盛生物技术有限责任公司,批号99G001100);DMEM培养基(重庆塞米克生物科技有限公司,批号20191907);胎牛血清(重庆塞米克生物科技有限公司,批号20190602);MTT(北京鼎国昌盛生物技术有限责任公司,批号0326010160);Annexin V /PI 凋亡检测试剂盒(上海碧云天生物技术有限公司,批号010220200713);alpha Tubulin兔多克隆抗体(Proteintech,批号00068510);YAP 兔多克隆抗体(Proteintech,批号00076577);p-YAP(Ser127) 兔多克隆抗体(Affinity,批号36z2539);c-Myc 兔多克隆抗体(Proteintech,批号00081188);caspase-3/P17/P19兔多克隆抗体(Proteintech,批号00081801);Bax兔多克隆抗体(Proteintech,批号00082363);Bcl-2兔多克隆抗体(Gene Tex,批号GT100064);PrimeScriptTMRT Reagent Kit(TaKaRa,批号AIF2368A);Bax、Bcl-2、caspase-3、YAP、c-Myc mRNA引物(TaKaRa,批号CIPX281);SYBR qPCR Master Mix(南京诺唯赞生物科技有限公司,批号7E481B9)。
1.1.3仪器 细胞培养箱(Thermo);细胞培养超净台(安泰技术有限公司);倒置荧光显微镜(Nikon);低温离心机(Thermo);湿式转膜仪(Bio-Rad);垂直电泳槽(Bio-Rad);酶标仪(Thermo);凝胶成像系统(Bio-Rad);扩增仪(Bio-Rad S1000TMThermal Cycler);定量PCR仪(Bio-Rad CFX ConnectTMReal Time System)。
1.2 方法
1.2.1细胞培养 神经胶质瘤U87细胞用含10% FBS的DMEM培养基培养(含100 kU·L-1青霉素和0.1 g·L-1链霉素)。孵箱内条件为:恒温37 ℃,CO2浓度为5%。全部实验均采用对数生长期的细胞进行实验。
1.2.2ORI的配制 取ORI干粉溶解于DMSO中,配制成浓度0.1 mol·L-1的药物用0.22 μmol·L-1微孔滤膜过滤除菌后,避光储存于-20 ℃低温保存。
1.2.3MTT检测细胞增殖情况 取对数生长期的U87细胞悬液(6×107·L-1)接种于96孔细胞培养板中,每孔100 μL(6×103个/孔)。置37 ℃、5% CO2细胞培养箱中12 h后,换用含不同浓度ORI的DMEM培养基继续培养,每个药物浓度设置6个复孔。分别继续培养24 h、48 h后,弃培养基,每孔加入20 μL MTT,置孵箱中孵育4 h后,加150 μL DMSO并剧烈震荡10 min,用酶标仪检测490 nm波长处各孔的OD值。药物对U87细胞生长的抑制率/%=[1-(实验给药组-空白组)/(阴性对照组-空白组)]×100%。
1.2.4划痕试验检测细胞侵袭变化 消化对数生长期的U87细胞制成单细胞悬液,均匀接种于6孔板中,观察细胞融合70%-80%时,使用无菌枪头垂直于板面均匀竖直划线,吸取旧培养液用PBS清洗2次。空白组加入无血清DMEM培养基,实验组加入含不同浓度ORI的无血清DMEM培养基,对细胞进行拍照记录此时状态。放入细胞培养箱培养,于给药12 h、24 h、36 h、48 h后拍照记录划痕修复情况,使用ImageJ计算细胞迁移率。细胞迁移率/%=[(刚划痕后划痕面积-培养不同时间点后划痕面积)/刚划痕后划痕面积]×100%。
1.2.5流式细胞术检测凋亡 取对数生长的神经胶质瘤U87细胞,接种于6孔板中,待细胞贴壁后,每孔分别加入2 mL用DMEM完全培养基稀释的ORI(终浓度0、5、10 μmol·L-1)。药物作用48 h后,收集细胞,使用Annexin V/PI双重染色法检测细胞凋亡情况。其中以0 μmol·L-1处理的U87细胞作为对照组。
1.2.6荧光实时定量PCR(qRT-PCR) 取对数生长期的神经胶质瘤U87细胞,接种于6孔板中,待细胞贴壁后,每孔分别加入2 mL用DMEM完全培养基稀释的ORI(终浓度0、5、10 μmol·L-1)。药物作用48 h后,使用TRIzol提取细胞总RNA,用Thermo微量核酸测定仪检测RNA浓度后置于-80 ℃保存。用试剂盒逆转录RNA以合成cDNA,用SYBR qPCR Master Mix进行荧光定量PCR反应。实验结果通过相对定量方法分析,计算2-ΔΔCt值,比较组间基因表达水平是否具有统计学意义。

Tab 1 Sequences of primers (5' to 3')
1.2.7Western blot 取对数生长期的神经胶质瘤U87细胞,接种于10 cm培养皿中,待其长到80%-90%左右,每瓶分别加入用DMEM完全培养基稀释的ORI(终浓度0、5、10 μmol·L-1)7 mL。药物作用48 h后,弃掉培养液,用PBS冲洗两次并消化,加细胞裂解液(RIPA ∶PMSF ∶磷酸蛋白酶抑制剂=100 ∶1 ∶2)于冰上裂解15 min,4 ℃、12 000 r·min-1离心15 min。取上清液用BCA法测定蛋白浓度后,加上样缓存液煮沸变性10 min。蛋白样品进行SDS-PAGE电泳,蛋白转移至PVDF膜上,TBST洗膜3次,5% BSA室温封闭2 h,一抗4 ℃孵育过夜,HRP标记山羊抗兔二抗(1 ∶7 000)室温孵育2 h,TBST洗膜3次每次10 min,加ECL发光试剂显影,采用Image Lab 4.1进行图像分析。以目的蛋白与α-Tubulin或GAPDH条带灰度比值表示目的蛋白的相对表达水平。
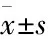
2 结果
2.1 ORI对神经胶质瘤U87细胞增殖作用的影响ORI(结构式如Fig 1A)2.5 μmol·L-1、5 μmol·L-1、10 μmol·L-1和20 μmol·L-1处理U87细胞24 h和48 h 后,对细胞的增殖能力进行检测,结果如Fig 1显示,ORI浓度在10 μmol·L-1作用24 h、48 h对U87增殖均有明显抑制作用(P<0.01)。利用SPSS 20.0计算ORI作用U87细胞24 h后IC50值为12.05 μmol·L-1,ORI作用U87细胞48 h后IC50值为10.17 μmol·L-1,根据上述结果,选用5 μmol·L-1和10 μmol·L-1的ORI处理U87细胞48 h作为实验组,以0 μmol·L-1处理的U87细胞作为对照组。

Fig 1 Effects of ORI on survival rate of U87
2.2 ORI对神经胶质瘤U87细胞迁移作用的影响如Fig 2所示,ORI浓度在5 μmol·L-1、10 μmol·L-1时可明显抑制U87细胞迁移。随着ORI浓度的增高,U87细胞的迁移速度明显下降,且作用时间越长,迁移速度下降越明显(P<0.01)。
2.3 ORI对神经胶质瘤U87细胞凋亡的影响流式细胞仪检测细胞凋亡结果如Fig 3A、B所示,与对照组相比,5 μmol·L-1、10 μmol·L-1的ORI处理组的总凋亡率明显增加(P<0.01)。
2.4 ORI对神经胶质瘤U87细胞caspase-3、Bcl-2/Bax 的mRNA及蛋白表达的影响Western blot、qPCR结果如Fig 4所示,与对照组相比,5 μmol·L-1、10 μmol·L-1的ORI处理组caspase-3 mRNA及蛋白表达均增加(P<0.05),Bcl-2/Bax mRNA及蛋白表达均降低(P<0.05)。

Fig 2 Effects of ORI on migration rate of U87 in different

Fig 3 Effect of ORI on apoptosis of glioma U87
2.5 ORI对神经胶质瘤U87细胞YAP-c-Myc通路的影响如Fig 5所示,与对照组相比,5 μmol·L-1、10 μmol·L-1的ORI处理组YAP、c-Myc mRNA及蛋白表达均降低(P<0.05);磷酸化YAP蛋白表达增加(P<0.05)。
3 讨论
胶质瘤是最常见的原发性颅内肿瘤,WHO将胶质瘤分为I至IV级,其中高级别胶质瘤具有侵袭性更强,发展更为迅速,致死率高的特点,目前尚无确切可靠且不易复发的治疗手段[9]。ORI作为唇形科冬凌草所提取的二萜类活性成分,可以对小细胞肺癌、胃癌等多种肿瘤产生抑制作用。研究显示ORI可以使胶质瘤细胞周期停滞于S期,也可以诱导结肠癌细胞自噬产生凋亡[10],但其是否可以通过YAP-Hippo通路抑制神经胶质瘤增殖并促进其凋亡尚未见报道。本研究采用神经胶质瘤U87细胞研究ORI的抗胶质瘤作用,并对其涉及的相关通路进行探索。
Hippo信号通路在调节细胞增殖和调控组织器官功能中起着至关重要的作用,可参与癌症、心血管疾病等多种疾病的发生、发展[11]。高密度G蛋白偶联受体被磷酸化的MST1/2刺激后可激活Hippo信号通路[12]。在Hippo信号通路中,磷酸化的MST1/2可将LATS1/2磷酸化,被磷酸化的LATS通过在14-3-3蛋白上形成结合位点来促进p-YAP (Ser127)、p-TAZ(Ser89)在胞质聚集,减少细胞核内转录发生[13]。YAP残基S127磷酸化后的p-YAP (Ser127)不能进入细胞核内,因此研究YAP磷酸化的水平可以作为检测Hippo通路活化状态一种途径。大量的临床证据表明,YAP在多种类型的恶性肿瘤中均过表达或高度活化,明显促进其增殖、迁移,减少凋亡,在治疗人类癌症中已经成为一种有吸引力潜在的药物治疗靶点[14]。c-Myc是YAP的转录靶标,YAP在进入细胞核后,YAP/TEAD复合物在细胞核内通过与c-Myc的启动子和第一内含子相关联而直接调节c-Myc的转录[15]。已有研究证实,c-Myc作为一个典型的促癌基因可参与调控细胞周期进程,与细胞生长、分化、代谢和凋亡有关,它的过表达与多种肿瘤的发生和转移有密切关系[16]。但YAP-Hippo通路过度活化是否与神经胶质瘤发生具有相关性,且ORI是否具有可以通过干预该通路发挥抗胶质瘤作用尚未见报道。本研究结果显示将ORI作用于U87细胞后,细胞生存率呈浓度依赖性降低,细胞迁移被抑制;流式细胞术显示细胞凋亡率增加;caspase-3凋亡信号通路中caspase-3 mRNA和蛋白表达水平增加,Bcl-2/Bax mRNA及蛋白表达水平降低,提示ORI对U87细胞产生了促凋亡作用;

Fig 4 Effects of ORI on caspase-3,Bcl-2/Bax mRNA and protein expression of U87

Fig 5 Effects of ORI on YAP and c-Myc mRNA and protein expression of U87
Hippo信号通路中总YAP和下游c-Myc的 mRNA表达水平均降低,YAP、p-YAP(Ser127)、c-Myc蛋白检测显示,YAP总蛋白和c-Myc蛋白表达水平降低,YAP的S127位点磷酸化水平增高,提示ORI可能通过促进YAP蛋白磷酸化使其停留在胞质内与14-3-3结合形成复合物,发生泛素化使其水解,从而抑制其通路的活性,使进入细胞核的YAP减少,因此也减少了下游c-Myc的表达,提示ORI促神经胶质瘤U87细胞凋亡作用可能与抑制YAP-c-Myc信号通路有关。
综上所述,本研究结果提示ORI对U87细胞有明显抑制增殖和促进凋亡作用,其作用可能通过促进Hippo信号通路中的YAP磷酸化,使p-YAP(Ser127)聚集于细胞质,减少YAP进入细胞核内既而减少c-Myc的表达从而抑制YAP-c-Myc信号通路相关。本研究结果为ORI用于肿瘤相关疾病的治疗提供了一定的实验依据,为神经胶质瘤的治疗提供了新的药物治疗思路。

