肿瘤免疫治疗及其药物研发进展
邢续扬,王孝春,何 伟
(中国药科大学药学院药剂系,南京211198)
目前,肿瘤已成为世界上继心血管疾病的第二大死因,患者人数在逐年增加。当前肿瘤治疗方法主要包括手术、放疗、化疗和靶向药物治疗等。常规手术切除难以将肿瘤细胞切除干净,因此容易出现术后复发;放疗和化疗在杀死肿瘤细胞的同时也会杀死正常细胞,对患者造成较大伤害;靶向药物治疗虽然能减轻药物的不良反应,但易产生肿瘤耐药性从而导致肿瘤复发。随着分子生物学和肿瘤生物学的发展,肿瘤免疫疗法已成为肿瘤治疗的新手段;与常规治疗手段不同的是,肿瘤免疫疗法针对的对象主要是免疫细胞,通过抑制免疫负调控因子、增强免疫细胞对肿瘤细胞表面抗原的识别能力等方式来激活机体免疫系统,从而实现对肿瘤细胞的清除,具有效果好、不良反应小和防止复发等优点[1]。
近年来,随着对肿瘤免疫逃逸机制的进一步了解,各种新型免疫疗法相继问世(图1),从第一个肿瘤免疫治疗药物IFN-α上市,到如今免疫检查点抑制剂(PD-1/PD-L1、CLTA-4 等)、CAR-T 细胞疗法、肿瘤疫苗、溶瘤病毒等新的免疫疗法的药物陆续获批,肿瘤免疫疗法显示出良好的治疗效果。2013 年12 月,《科学》杂志将肿瘤免疫疗法评为年度十大科技突破之首,2018 年的诺贝尔生理学或医学奖更是颁给了肿瘤免疫治疗领域,这些成果都极大地促进了肿瘤免疫治疗药物市场规模的增长,预计到2022年,全球免疫治疗市场规模将达到千亿美元。免疫疗法的出现改变了肿瘤治疗标准和治疗理念,成为继传统化疗药物、靶向治疗后肿瘤治疗的第三次革命。本文介绍了肿瘤细胞逃避机体免疫系统的常见机制以及与之相对应的各种免疫疗法,同时重点介绍了各免疫疗法的设计原理、上市药物以及各疗法的优缺点。
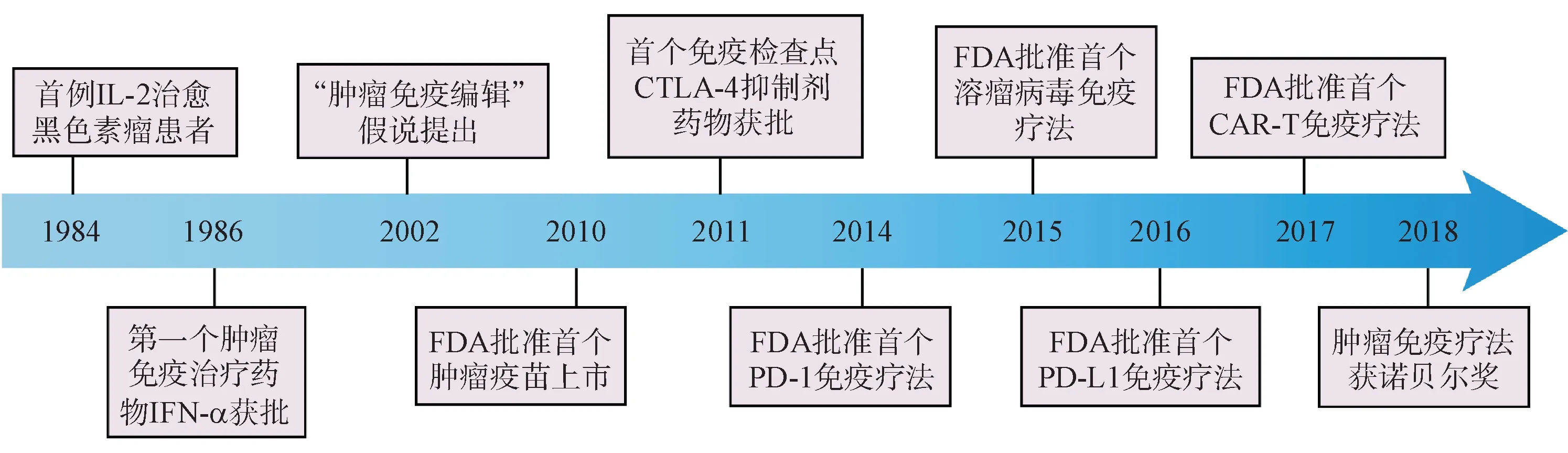
图1 肿瘤免疫疗法发展历程
1 肿瘤免疫逃逸机制
正常情况下,当肿瘤细胞侵袭机体健康组织时,免疫系统可以根据它们表面所表达的肿瘤相关抗原(tumor-associated antigens,TAAs)来识别和消除它们[2](图2-A)。然而,肿瘤细胞能通过多种机制来抑制宿主免疫系统从而来逃避机体免疫系统的攻击,肿瘤免疫逃逸机制主要有4种(图2-B):第一,下调其表面抗原的表达来降低其免疫原性,使其不能有效激活机体的免疫系统;第二,上调其细胞表面免疫检查点(immune checkpoints)的表达(如PD-L1)来抑制T 淋巴细胞的活性,从而逃避机体免疫系统;第三,通过募集免疫抑制性细胞[髓系来源抑制细胞(MDSC)和调节性T 细胞(Treg)]到肿瘤免疫微环境中,并分泌细胞因子,抑制机体对肿瘤细胞的免疫应答;第四,通过释放酸性和毒性代谢产物来抑制肿瘤微环境中免疫细胞的活性,从而发生免疫逃逸[3]。
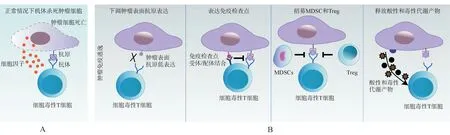
图2 肿瘤免疫逃逸机制[2]
机体免疫系统能够检测并清除体内的肿瘤细胞,肿瘤免疫治疗主要通过重新激活机体抗肿瘤免疫响应来杀死肿瘤细胞。早期的肿瘤免疫疗法主要利用免疫细胞所产生的细胞因子来直接攻击肿瘤细胞,例如IL-2 和IFN;随后,一些新的免疫疗法,如免疫检查点抑制剂、细胞免疫疗法、溶瘤病毒、肿瘤疫苗等,逐渐发展成为了肿瘤免疫疗法的主力军。
2 肿瘤免疫治疗策略
2.1 细胞因子类免疫疗法
细胞因子是由多种免疫细胞(如淋巴细胞、单核细胞和巨噬细胞)分泌产生的天然免疫调节剂,具有调节机体免疫应答的作用。肿瘤组织招募的免疫抑制性细胞(MDSC 和Treg)能够分泌抑制性细胞因子,通过抑制机体免疫系统实现免疫逃逸;而刺激性细胞因子能够激活机体免疫系统,杀伤肿瘤细胞;因此将刺激性细胞因子递送到肿瘤部位能实现对肿瘤的治疗[4]。
刺激性细胞因子是最早用于肿瘤免疫治疗的药物,临床应用最广泛的有INF-α 和IL-2。IFN-α能增强树突状细胞(DC)与自然杀伤细胞(NK)的活性,提高机体抗肿瘤能力。基因工程技术的诞生使这些细胞因子得以大规模生产,1986 年,FDA批准了首个细胞因子药物INF-α上市,用于治疗毛细胞白血病,随后又被用于艾滋病有关的卡波西氏肉瘤、滤泡淋巴瘤、慢性粒细胞性白血病与黑色素瘤的治疗。白细胞介素主要由CD4+辅助T 细胞亚群分泌,参与CD8+细胞毒性T 细胞、巨噬细胞和NK 细胞的活化。1992 年,利用基因工程技术生产的重组人白细胞介素-2(rhIL-2)获准用于治疗肾癌,之后又被用于治疗转移性黑色素瘤。目前IFN-α 和IL-2 已成为肿瘤免疫治疗策略中应用最广泛的生物药物,而其他一些细胞因子目前正处于临床研究阶段[5]。
2.2 抗体类免疫疗法
2.2.1 治疗性单克隆抗体 治疗性单克隆抗体通常属于免疫球蛋白G 类,由两个片段组成:一是用于结合抗原的抗原结合段(Fab 段),二是能够与巨噬细胞、中性粒细胞、NK 细胞等免疫细胞表面的Fc受体相互作用的可结晶段(Fc段)。治疗性抗体主要通过细胞介导的细胞毒性(ADCC)作用以及补体作用发挥治疗作用;首先抗体的Fab段与靶细胞的表面结合,而免疫细胞可以通过其Fc 受体识别抗体的Fc 段。当NK 等免疫细胞与被抗体覆盖的靶细胞相遇时,NK 细胞表面的Fc受体与抗体的Fc段相互作用而被激活,活化的NK细胞进而释放穿孔素与颗粒酶以杀伤肿瘤细胞[6]。FDA 已经批准上市的利妥昔单抗、奥法木单抗与阿仑单抗药物皆采用ADCC机制。
目前,以双特异性抗体(bispecific antibody,bsAb)为代表的第二代单克隆抗体逐渐进入市场,双特异性抗体拥有两个不同的抗原结合位点,可以同时和两个靶抗原或一个抗原两个不同表位结合,从而更好地发挥抗肿瘤作用;与普通单克隆抗体相比,双特异性抗体具有特异性高、稳定性好、用量少、不良反应小的优点,在肿瘤的临床治疗中效果显著[7];2013 年,美国安进公司生产的靶向CD3 的双特异性抗体博纳吐单抗(blinatumomab)获批,这也是第一个FDA 批准用于肿瘤治疗的双特异性抗体,可用于B细胞急性淋巴瘤白血病的治疗。临床结果显示,患者在接受blinatumomab治疗后,可获得72%的完全阳性结果,治疗后平均预期寿命在九个月以上。目前,已有blinatumomab 和艾美赛珠单抗(emicizumab)2 个bsAb 上市,超过85个的相关抗体正在进行临床研究[8]。
2.2.2 免疫抑制细胞MDSCs 和Treg 单克隆抗体 骨髓来源的抑制细胞(MDSCs)、调节性T淋巴细胞(Treg)作为主要免疫抑制细胞,能够显著抑制机体免疫细胞应答的能力,而肿瘤组织通过招募Treg 和MDSCs 至肿瘤微环境,抑制肿瘤组织微环境中的免疫应答,从而实现免疫逃避[9]。因此,消除Treg 和MDSCs 细胞能恢复该部位的免疫应答,治疗肿瘤。研究表明,在荷瘤小鼠模型中,两种合成的治疗肽(Pep-H6 和Pep-G3)能够消除小鼠血液、脾脏和肿瘤内的MDSCs,从而显著抑制肿瘤的生长[10];大量临床结果表明,达利珠单抗(daclizumab)和地尼白介素(denileukin diftitox)两种单抗能通过消耗肿瘤组织中的Treg 细胞来治疗转移性乳腺癌和黑色素瘤[11];另外,伊匹单抗(ipilimumab)和维罗非尼(vemurafenib)能逆转MDSC 对黑色素瘤的免疫抑制作用[12]。
2.2.3 免疫检查点抑制剂单克隆抗体 免疫检查点可以调节机体的免疫系统,其中刺激性免疫检查点分子(stimulatory checkpoint molecules)能够促进T 细胞的活化,激活机体的免疫应答;而抑制性免疫检查点分子(inhibitory checkpoint molecules)作为人体免疫系统的天然“刹车”,则用于抑制机体的免疫应答和防止自身免疫的发生[13]。肿瘤细胞为了逃避机体免疫系统,通过表达与T细胞相互作用的抑制性免疫检查点分子来抑制机体的免疫应答,使其避免被机体免疫系统清除[14-15]。因此,可以针对常见的抑制性免疫检查点,设计相应的抗体药物,通过封闭抑制性免疫检查点从而增强机体免疫系统,最终实现对肿瘤的清除。
目前已发现的免疫检查点已达十多种,其中研究最广泛的免疫检查点为CTLA-4 和PD-1/PDL-1。CTLA-4 是T 细胞表面受体,作为一种免疫抑制分子,能够参与免疫抑制信号的传递[13]。最初,研究发现在CTLA-4 缺失的小鼠模型中,可导致大量淋巴细胞增殖、器官损伤甚至小鼠死亡;进一步研究发现,在肿瘤模型小鼠中,阻断CTLA-4 可以有效地抑制肿瘤的增长[16];经过大量临床试验,在2011 年,FDA 批准了首个针对免疫检查点CTLA-4的抗体药物伊匹单抗(ipilimumab)[17],该抗体药物主要用于黑色素瘤的治疗,能提高患者1~2年的生存期。除CTLA-4 外,PD-1 也是T 细胞表面另一种常见的免疫抑制分子,其配体PD-L1被证明在多种肿瘤细胞表面表达[15,18]。表达PD-L1 的肿瘤细胞通过和T 细胞表面的PD-1 结合从而抑制T 细胞的活化,实现肿瘤免疫逃逸(图3-A)。PD-1/PD-L1 抑制剂能封闭这些免疫检查点,从而增强T 细胞活性,杀伤肿瘤细胞(图3-B)。首个PD-1抑制剂帕姆单抗(pembrolizumab),于2014 年被FDA 批准用于治疗黑色素瘤与肺癌[19];之后在2016 年,第一个PD-L1 抑制剂阿特珠单抗(atezolizumab)被批准用于治疗膀胱癌[20]。截至目前,FDA 批准的免疫检查点抑制剂已达7个(表1)。
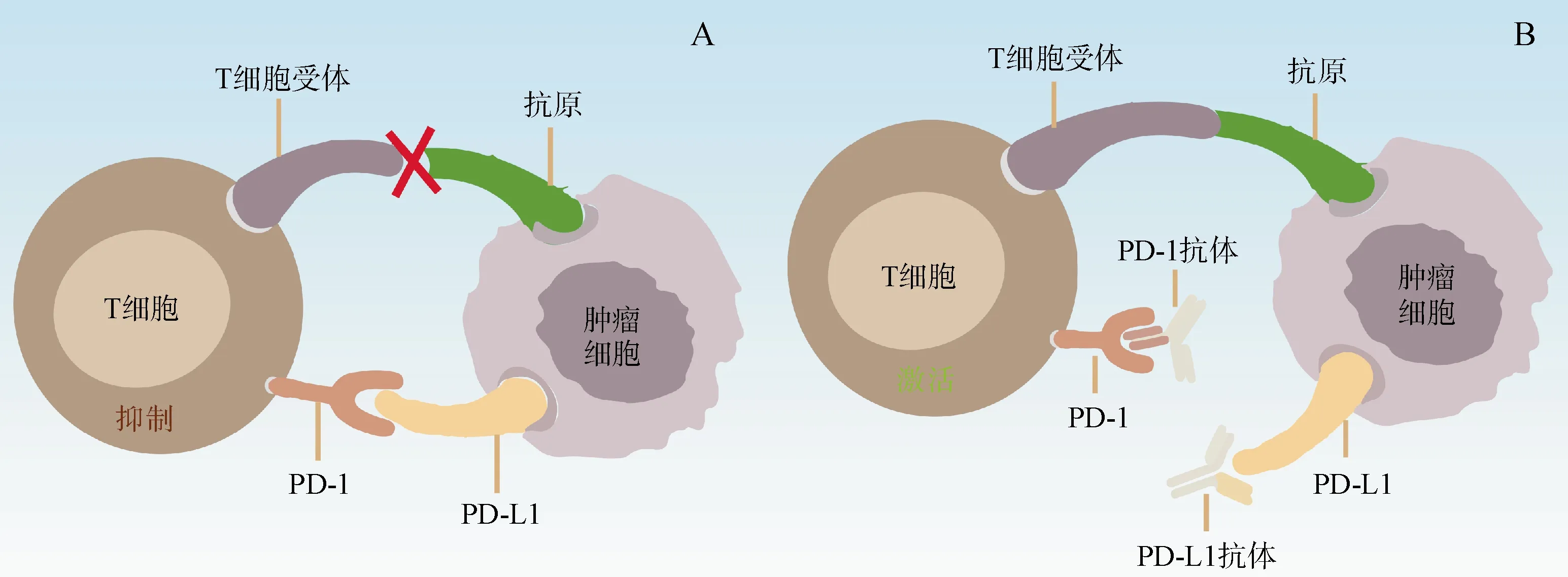
图3 PD-1和PD-L1免疫疗法机制

表1 FDA 批准的免疫检查点抑制剂(截至2018年)
免疫检查点疗法作用对象是免疫细胞,通过增强T细胞的活性来增强机体免疫系统,从而杀死肿瘤细胞,因而不易导致肿瘤的突变和耐药现象的产生。但在临床使用过程中也存在一些不良反应,例如此疗法有时会导致机体过度的免疫反应从而对皮肤、肠道、肺、肝等正常组织产生毒性[14,21]。随着研究的深入,越来越多的免疫检查点将会被发现,而针对这些新发现的免疫检查点的药物研发也将会取得更多的进展。
2.3 细胞免疫疗法
2.3.1 嵌合抗原受体T 细胞(CAR-T)免疫疗法肿瘤细胞免疫逃逸策略之一就是通过降低其表面抗原的表达,使得T 细胞无法通过HLA(人类白细胞抗原)依赖的方式被激活,从而逃避机体免疫系统的攻击,最终发展成恶性肿瘤[2]。CAR-T免疫疗法通过改造自身T 细胞以使其能更有效地识别并杀伤肿瘤细胞。其原理和设计流程如图4所示,首先从患者体内分离并收集T细胞,通过体外基因修饰使其能够表达特异性能识别肿瘤细胞的嵌合抗原受体(CAR),再将融合后的CAR-T 细胞回输患者体内,以攻击携带肿瘤特异性抗原的肿瘤细胞。目前,CAR-T 疗法在血液瘤和淋巴瘤治疗方面取得了突破性进展。2017 年,FDA 批准了用于治疗急性淋巴性白血病的CAR-T 疗法Tisagenlecleucel[22]。随后另一种CAR-T 免疫疗法Axicabtagene ciloleucel 于同年被批准用于治疗弥漫大B 细胞淋巴瘤[23]。截至2020年6月2日,美国临床试验资料库(ClinicalTrials.gov)上登记了527 项关于CAR-T 的临床研究,可以预见未来CAR-T 疗法具有广阔的市场前景。
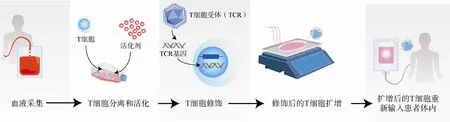
图4 CAR-T原理及设计流程
虽然CAR-T 疗法目前在血液瘤和淋巴瘤的治疗中表现出了显著的疗效优势,但在临床使用过程中也存在一些风险。其中,细胞因子释放综合征(cytokine release syndrome,CRS)和免疫效应细胞相关性神经毒性综合征(immune effector cellassociated neurotoxicity syndrome,ICANS)是CAR-T细胞免疫疗法最常见的不良反应,临床上常表现为发热、低血压、缺氧、毛细血管渗漏、认知能力受损等症状[24-25]。因此,如何准确评估和及时管理CAR-T 治疗过程中相关毒性,最大限度降低CART治疗相关不良事件发生率,是当前CAR-T细胞疗法在肿瘤治疗领域需要解决的问题。
2.3.2 嵌合抗原受体NK 细胞(CAR-NK)免疫疗法 自然杀伤细胞(natural killer,NK)作为机体先天性免疫细胞,在机体抗肿瘤和抗感染中发挥着重要作用[26]。肿瘤细胞主要通过两种方式来逃避NK细胞的杀伤。第一,因NK细胞的活化需要IL-2的介导,一些肿瘤细胞通过产生可溶性分子来抑制IL-2 的活性,进而抑制NK 细胞的活化,从而使肿瘤细胞免受NK 细胞的杀伤[27];第二,肿瘤细胞还可以通过上调NK 细胞抑制性受体的配体,逃避NK细胞的杀伤作用[28]。而CAR-NK细胞能显著提高NK 细胞对肿瘤细胞的杀伤作用,与CAR-T 细胞设计原理类似,CAR-NK 细胞通过在NK 细胞表面嵌合肿瘤特异性抗原受体,进而使NK 细胞靶向识别并摧毁肿瘤细胞。
与CAR-T细胞疗法相比,CAR-NK疗法具有更大的优势。首先,NK 细胞来源更加广泛,可以来源于同种异体细胞而不受自体细胞的限制;另外,NK 细胞不分泌引发CRS 的主要细胞因子,使得其不良反应更小[29]。研究表明CAR-NK 细胞在小鼠荷瘤模型中具有显著的疗效,能够明显地抑制小鼠肿瘤体积的增长,并延长小鼠的存活时间[30-32]。近日,美国首个CAR-NK细胞I/IIa期临床试验结果表明,将脐带血来源的CAR-NK细胞用于复发性或难治性非霍奇金淋巴瘤(NHL)和慢性淋巴细胞白血病(CLL)患者治疗后,大多数患者产生了临床响应,且未观察到明显的毒性反应[33]。虽然CAR-NK细胞在肿瘤治疗方面具有明显的优势,但NK 细胞有限的体内增殖和持久性以及肿瘤微环境的免疫抑制等因素限制了CAR-NK 细胞的临床转化[34],目前CAR-NK细胞疗法还处于临床研究阶段,尚未有药物批准上市。
2.4 肿瘤疫苗免疫疗法
肿瘤疫苗可以激活机体免疫系统进而来杀伤肿瘤细胞,主要包括树突状细胞(dendritic cells,DCs)疫苗、基因疫苗和多肽疫苗3 大类[35]。其中,DC 疫苗作为一种外源性抗原提呈细胞,能获取肿瘤抗原的特征信息并呈递给淋巴细胞,从而激活机体的免疫应答来杀伤肿瘤细胞。Provenge 是首个经FDA 批准的DC 疫苗,主要用于转移性去势耐受型前列腺癌(castrate-resistant prostate cancer,CRPC)治疗[35]。基因疫苗利用基因工程技术,将编码肿瘤特异性抗原的基因导入病毒载体或者质粒中,这些重组基因导入人体后通过表达肿瘤相关性抗原来诱导机体对肿瘤细胞产生免疫应答,能够较为持久地维持机体免疫反应。目前用于肿瘤治疗的基因疫苗均处于临床研究阶段,尚未有产品上市[36]。多肽疫苗是肿瘤疫苗中研究和应用最广泛的一种,该疫苗中的肿瘤相关性抗原肽可被T细胞特异性识别,从而引起宿主免疫系统的主动免疫反应来破坏肿瘤组织,具有安全性高、特异性强等特点,目前已上市的多种肿瘤疫苗(如HPV和M-Vmax)均属于多肽疫苗[37]。
近年来,随着高通量测序技术和生物信息学的发展,越来越多的仅存于在肿瘤细胞中的新生抗原(nerantigen)被发现,由于这些新生抗原不会在正常细胞产生和表达,所以能更有效地激发机体免疫反应[38]。个性化肿瘤疫苗正是通过寻找这些新生抗原来构建肿瘤疫苗,从而杀死带有这些新生抗原的肿瘤细胞[39]。最近的临床试验结果表明,新设计的个性化肿瘤疫苗GAPVAC-101 对神经胶质瘤具有较好的疗效并能显著提高肿瘤患者的生存周期[40-41];另外,肿瘤疫苗与其他疗法(如免疫检查疗法、CAR-T 疗法)联合使用比单一疫苗疗法显示出更好的疗效[42]。总的来说,肿瘤疫苗不良反应轻微、耐受性好,兼具预防和治疗作用,目前全球已批准上市的肿瘤疫苗已达9 种(表2),具有广阔的市场前景。但肿瘤疫苗也存在一些不足,例如,DC疫苗的细胞来源有限并且治疗费用较高;基因疫苗易被体内核酸酶降解,并且存在导致正常细胞基因突变的风险;新生抗原自身存在很大的个体差异性,使新生抗原肽疫苗的设计和应用都具有一定挑战等[43]。

表2 全球批准上市的肿瘤疫苗(截至2019年)
2.5 溶瘤病毒免疫疗法
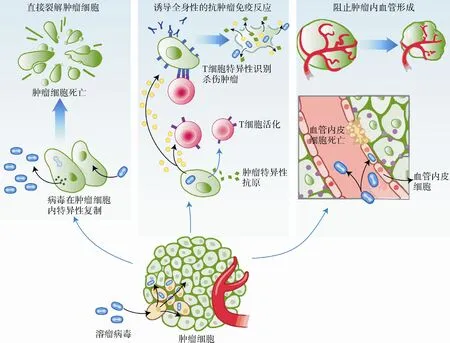
图5 溶瘤病毒杀死肿瘤细胞的主要机制
溶瘤病毒(oncolytic viruses,OV)是一类能特异性感染并杀伤肿瘤细胞的病毒,可以是自然产生的,也可以通过基因工程改造制得[44]。目前用于临床研究的溶瘤病毒多为经过基因改造的溶瘤病毒,如腺病毒、痘病毒、单纯疱疹病毒等,这些病毒可通过多种途径杀死肿瘤细胞[45-46](图5):首先,溶瘤病毒可以在肿瘤细胞中复制、增殖并裂解肿瘤细胞,同时释放出新的感染性病毒颗粒来破坏其他肿瘤细胞,而对周围健康的组织损伤较小;另外,溶瘤病毒还可以通过释放肿瘤抗原来激活机体抗肿瘤免疫应答。最近研究发现,溶瘤病毒也可以通过感染肿瘤相关的血管内皮细胞,阻止肿瘤血管的生成,从而间接杀死肿瘤细胞。目前,已有两种溶瘤病毒获批。2005年,CFDA 批准腺病毒H101(oncorine)上市,用于晚期鼻咽癌的治疗;2015 年,美国制药厂商安进(Amgen)生产的T-vec(imlygic)是首个经FDA 批准的溶瘤病毒,主要用于晚期黑色素瘤的治疗,这标志着溶瘤病毒技术的成熟。目前,可通过多种方式来提高溶瘤病毒在肿瘤治疗中的疗效。例如,可以通过基因工程手段将一个或多个肿瘤相关的抗原(TAA)基因编码到溶瘤病毒的基因组中[47],以增强机体对肿瘤组织的免疫应答;另外,将溶瘤病毒与其他免疫疗法如免疫检查点疗法相结合以增强肿瘤的治疗作用[48],已经成为该领域主要研究方向之一。
溶瘤病毒疗法具有复制效率高、杀伤效果好、不良反应小和成本较低等优势,使得其成为未来最具前景的肿瘤免疫治疗手段之一[49-51]。然而,目前批准上市的oncorine 和imlygic 这两种溶瘤病毒给药方式均为瘤内注射,这限制了其临床使用。因此,应发展其他更便捷的给药途径(如静脉注射给药等);另外,如何更有效地将这些溶瘤病毒递送到肿瘤组织以及如何提高这些病毒在肿瘤组织部位的扩散能力也是今后该疗法应该着力解决的问题。
3 肿瘤免疫治疗药物研发现状
近些年,FDA 已经批准了免疫检查点抑制剂、细胞免疫疗法、肿瘤疫苗、溶瘤病毒等多种肿瘤免疫治疗药物上市,其中,以CTLA-4 和PD-1/PD-L1为代表的免疫检查点抑制剂药物为主,随着CD47、LAG-3、TIM-3、TIGIT、VISTA 等新的免疫检查点的发现,针对这些新发现的免疫检查点来设计药物成为免疫治疗药物研发发展趋势之一[52]。除了获批上市的药物外,处于临床研发阶段的肿瘤免疫治疗项目也在逐年递增,截止2020 年7 月8日,美国临床试验资料库(ClinicalTrials.gov)显示全球有3 280 项临床试验项目,数量上以细胞免疫疗法和肿瘤疫苗研发项目居多,预计未来5年内将迎来新一轮的免疫治疗药物上市高峰期。
目前大多数免疫治疗药物如多肽、单抗、基因、细胞、溶瘤病毒等属于生物大分子药物,虽然这些生物大分子药物在肿瘤治疗领域显示出较好的疗效。但如何保持这些药物活性以及如何将这些药物递送到肿瘤组织中来发挥其药效成为当前需要解决的问题。药剂学的发展为这些大分子药物的递送提供了解决方案,在药物制剂领域中,可以通过开发纳米制剂实现对生物大分子类药物的体内递送。目前,本课题组设计的棒状纳米晶(nano-rods,NRs)载体在生物药物的递送方面显示出明显的优势,研究结果表明,NRs 能够有效地将蛋白药物caspase 3 和基因药物let-7a 递送到肿瘤细胞中并能显著地抑制小鼠体内肿瘤组织的生长[53-54];另外,在耐药肿瘤治疗方面,本课题组利用纳米载体成功地将生物药物microRNA-101递送到肿瘤组织中,通过抑制肿瘤细胞对药物的自噬来提高肿瘤细胞对药物的敏感性,从而更好地杀死肿瘤细胞[55];除NRs 外,用于生物药物递送的其他纳米载体也在研制中。
4 结论与展望
肿瘤免疫疗法通过激活机体的免疫系统来杀伤肿瘤细胞,为多种实体瘤及恶性肿瘤提供了有效的治疗方案。目前,FDA 已批准多种肿瘤免疫疗法上市,各免疫疗法的优缺点如表3 所示。2018 年诺贝尔生理学或医学奖授予美国免疫学家詹姆斯·艾利森和日本免疫学家本庶佑,以表彰他们在肿瘤免疫治疗中的贡献,这极大地鼓舞了肿瘤免疫治疗的研究;此后,肿瘤免疫疗法日新月异,出现了免疫检查点抑制剂疗法、CAR-T 疗法、肿瘤疫苗、溶瘤病毒疗法等免疫疗法百花齐放的盛况,可以预见未来肿瘤免疫治疗具有广阔的市场前景。
随着免疫治疗药物在临床上的广泛应用,这些免疫疗法在增强机体免疫系统的同时,也会出现免疫相关的不良事件(IrAEs),如对皮肤、肝脏、肾脏、内分泌组织甚至中枢神经系统造成损伤,虽然大多数的不良事件经过周到处理后都是轻微可控的,一些病例还是会出现严重不良反应甚至导致死亡[5]。因此,早期和治疗过程中的诊断以及如何降低治疗过程中相关毒性成为免疫疗法今后努力的方向。

表3 各种免疫疗法的优缺点
虽然免疫疗法在肿瘤治疗领域具有显著的效果。然而,许多恶性肿瘤通过多种方式来逃避机体免疫系统的监视,单一的免疫治疗方法既不足以根除肿瘤,也难以提供长期的抗肿瘤免疫应答,而联合多种免疫疗法可以提高疗效,并逐渐成为未来肿瘤治疗的趋势。如将溶瘤病毒和PD-1疗法相结合治疗恶性黑色素瘤[45];肿瘤疫苗和CAR-T疗法相结合在实体瘤的治疗中具有更显著的疗效[56]。最近,各种肿瘤表面新生抗原的发现促进了个性化肿瘤免疫疗法的发展,这将会给患者提供更加精准的治疗;这些新生抗原还为CAR-T 疗法提供了新的肿瘤抗原,解决了CAR-T 疗法中肿瘤抗原发现不足的问题;另外,新的免疫检查点以及新的溶瘤病毒的发现将会促使更多的免疫治疗药物问世;随着新的免疫治疗药物不断进入市场和现有免疫治疗药物新适应证的不断获批,相信肿瘤免疫疗法将会使更多患者受益。

