米糠酸败诱导的蛋白质氧化对米糠清蛋白界面性质的影响
吴晓娟,吴 伟,2,*
(1.稻谷及副产物深加工国家工程实验室,中南林业科技大学食品科学与工程学院,湖南 长沙 410004;2.食品安全监测与预警湖南省重点实验室,湖南 长沙 410111)
米糠是稻谷加工中最重要的一类副产物,包括丰富的脂质、蛋白质、膳食纤维以及谷维素、谷甾醇、生育酚等生理活性物质[1]。目前全球米糠年产量约2 930万 t,而中国作为世界上最大的稻米生产国和消费国,米糠年产量在1 400万 t以上[2-3]。米糠脱脂后的蛋白质含量高达15%~20%,是一种丰富而价廉的植物蛋白资源。米糠蛋白因其氨基酸组成合理、致敏性低以及良好的溶解性、乳化性,作为营养强化剂或天然乳化剂广泛应用于饮料、肉制品、焙烤制品等多种食品[1]。米糠蛋白是一种混合蛋白,根据Osborne分级,可分为清蛋白、球蛋白、谷蛋白和醇溶蛋白[4]。清蛋白是米糠蛋白中含量最高(达24%~43%)的组分,由于分子表面带有足够的静电荷并且鲜有S—S交联或聚集,是维持米糠蛋白界面性质的主要贡献者[5]。近年来,研究发现米糠清蛋白还具有非常好的抗氧化性和降血糖活性,可作为功能因子或活性成分载体应用于特医食品或医药领域[6]。
然而,全球每年90%的米糠都被直接用作畜禽饲料,综合利用水平较低,严重限制了米糠蛋白等资源的深度开发和利用[7]。造成米糠资源综合利用水平较低的重要原因是新鲜米糠极易酸败变质。新鲜米糠中含有18%~22%的脂质,其中80%以上为不饱和脂肪酸甘油酯,同时还含有活性较强的脂肪水解酶、脂肪氧合酶、过氧化物酶等多种酶[7]。在米糠稳定化之前的贮藏和加工过程中,脂肪水解酶可快速水解脂质形成亚油酸等游离的多不饱和脂肪酸,使米糠酸值在短短几个小时之内快速增加;游离出来的亚油酸以及含亚油酸的脂肪酸酯在脂肪氧合酶作用下可形成脂质氢过氧化物;脂质氢过氧化物通过自动氧化或酶促催化形成自由基和挥发性羰基化合物[8]。理论上,这些脂质氧化产物可诱导蛋白质氧化,并且有研究已证实米糠酸败诱导的氧化修饰使米糠蛋白的结构特征和体外消化性发生了极其复杂的变化[9-10]。米糠酸败过程中蛋白质的结构变化除了会影响其营养价值,必然还会影响其界面性质的发挥,但目前国内外鲜有关于米糠酸败影响米糠蛋白及其主要组分界面性质的深入研究。因此,本研究通过分析米糠贮藏过程中米糠清蛋白氧化程度和结构特征的变化,并将这些变化与米糠清蛋白的界面性质进行相关性分析,从蛋白质氧化角度剖析米糠酸败对米糠清蛋白界面性质的影响,为开发和应用米糠蛋白资源提供理论参考。
1 材料与方法
1.1 材料与试剂
新鲜米糠 湖南粮食集团长沙分公司;标准分子质量蛋白 上海生化研究所;正己烷、盐酸、氢氧化钠(均为分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
FMHE-36双螺杆挤压中试生产线 湖南富马科公司;LYNX 6000高速冷冻离心机 美国赛默飞世尔公司;FD5-4冷冻干燥机 美国金西盟公司;F4600荧光光度计 日本日立公司;Nano ZS纳米粒度分析仪英国马尔文公司;LC-20高效液相色谱仪、IR-100傅里叶红外光谱仪 日本岛津公司。
1.3 方法
1.3.1 米糠清蛋白的制备
参照Wu Xiaojuan等[9]的方法,将新鲜米糠粉碎过450 μm筛,在温度25 ℃、相对湿度85%下存放0~10 d得到不同酸败程度的米糠。然后用双螺杆挤压中试生产线对米糠进行稳定化处理。稳定化条件:米糠含水量16%,进料速率15 kg/h,第2区至第6区温度分别为70、120、120、70 ℃和60 ℃。稳定化后再次将米糠粉粹过450 μm筛,并立即用正己烷按料液比1∶4(g/mL)对米糠粉末进行脱脂处理,回收米糠毛油(酸值4~40 mg/g)和脱脂米糠。参考Adebiyi等[4]的方法,将脱脂米糠与去离子水按料液比1∶8(g/mL)混合,40 ℃搅拌萃取2 h,然后将悬浮液在4 ℃、8 000 r/min离心20 min,分离沉淀和上清液。将上清液用2 mol/L HCl溶液调pH值至4.0,静置20 min后在4 ℃、8 000 r/min离心20 min得到蛋白沉淀,水洗沉淀3 次,然后将蛋白沉淀分散于去离子水中,再用2 mol/L NaOH溶液调pH值至中性,冷冻干燥得到米糠清蛋白。
1.3.2 羰基含量的测定
参照Wu Xiaojuan等[9]的方法,采用2,4-二硝基苯肼反应测定米糠清蛋白的羰基含量,以22 000 L/(mol·cm)的摩尔消光系数计算羰基含量。同时以牛血清白蛋白为标准,采用考马斯亮蓝法确定溶液中清蛋白的含量。
1.3.3 游离巯基和二硫键含量的测定
参考Huang Youru等[11]的方法,采用5,5’-二硫代二硝基苯甲酸比色法测定米糠清蛋白的总巯基和游离巯基含量,总巯基与游离巯基含量之差的1/2即为二硫键含量。同样采用考马斯亮蓝法确定溶液中清蛋白的含量。
1.3.4 高效液相排阻色谱分析
将米糠清蛋白样品配制成10 mg/mL的溶液,采用高效液相色谱仪进行分析,色谱柱型号TSKgel SW G4000 SWXL(300 mm×7.8 mm,8 μm),以含有0.05 mol/L NaCl的磷酸盐缓冲液(0.05 mol/L,pH 7.2)作为流动相,流速1 mL/min,柱温25 ℃,检测波长280 nm。
1.3.5 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分析
参照Wu Xiaojuan等[9]的方法对米糠清蛋白进行还原性的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分析,样品缓冲液中含有0.05 g/mLβ-巯基乙醇。采用质量浓度分别为12.5 g/100 mL分离胶和4 g/100 mL浓缩胶,每个泳道上样10 μL,电流恒定25 mA。
1.3.6 傅里叶变换红外光谱分析
参考Sun Weizheng等[12]的方法对米糠清蛋白进行傅里叶变换红外光谱扫描分析。将2 mg蛋白样品与200 mg KBr研磨成粉末,混合均匀,用压片机压片,在波数400~4 000 cm-1、分辨率4 cm-1条件下累计扫描64 次。
1.3.7 荧光光谱分析
参照Wu Xiaojuan等[9]的方法,先对米糠清蛋白进行内源荧光光谱分析,样品质量浓度0.1 mg/mL,采用荧光光谱仪在激发波长295 nm扫描300~500 nm之间的发射光谱(扫描速率10 nm/s)。然后,测定米糠清蛋白的表面疏水性,配制5 个质量浓度梯度(0.005~0.50 mg/mL)的蛋白溶液,取4 mL不同质量浓度蛋白溶液,分别加入50 μL 8 mmol/L 1-苯氨基萘-8-磺酸溶液,在激发波长390 nm、发射波长470 nm测定荧光强度,以蛋白质量浓度为横坐标、荧光强度为纵坐标作图,米糠清蛋白的表面疏水指数即曲线初始阶段的斜率。
1.3.8 Zeta电位和溶解度测定
参考Arte等[13]的方法,将米糠蛋白(1∶100,g/mL)溶解于0.01 mol/L pH 7.0磷酸盐缓冲液中,在室温下磁力搅拌2 h,然后10 000 r/min离心20 min收集上清液,采用纳米粒度分析仪测定上清液的Zeta电位。通过微量凯氏定氮法测定米糠清蛋白样品的总氮含量以及上清液的可溶性氮含量,计算溶解度。
1.3.9 乳化性和乳化稳定性测定
参考Molina等[14]的方法,取15 mL米糠清蛋白溶液(1 mg/mL)和5 mL大豆油混合,10 000 r/min均质2 min形成乳状液,取20 μL乳状液与5 mL 0.1%十二烷基硫酸钠混合均匀,以0.1%十二烷基硫酸钠为空白对照,在波长500 nm处测定吸光度(A0),乳状液静置30 min,采用相同方法测定吸光度(A30)。按式(1)、(2)计算乳化性和乳化稳定性:

式中:C为清蛋白溶液的蛋白质质量浓度/(mg/mL);N为稀释倍数;φ为油相所占的体积分数/%。
1.3.10 起泡能力和起泡稳定性测定
参考Kamara等[15]的方法,将200 mg米糠清蛋白加入20 mL磷酸盐缓冲液(0.05 mol/L,pH 7.0),10 000 r/min均质30 s,重复3 次,测量均质后的液面体积V0,静置30 min后再次测量液面体积V1。按式(3)、(4)计算起泡能力和起泡稳定性:
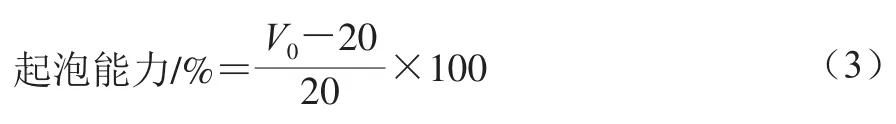

1.4 数据处理与统计分析
采用Origin 7.5和SPSS 18.0软件进行数据处理,结果用表示。采用方差分析法进行显著性分析,采用Pearson双变量进行数据之间的相关性分析。
2 结果与分析
2.1 米糠酸败对米糠清蛋白氧化程度的影响
羰基、游离巯基和二硫键含量是衡量各种来源蛋白氧化程度的通用指标。如表1所示,随着米糠贮藏时间延长,米糠清蛋白羰基含量逐渐增加,游离巯基含量逐渐减少,二硫键含量则先增加后减少。Wu Xiaojuan等[9]关于米糠酸败影响米糠蛋白结构变化的研究发现,米糠蛋白在酸败过程中呈现类似的氧化变性趋势。该研究还对米糠贮藏过程中的脂质水解酸败和氧化酸败程度进行详细分析,当新鲜米糠在温度25 ℃、相对湿度85%下贮藏0~10 d,酸值由4.31 mg/g上升到38.72 mg/g,过氧化值由1.42 mmol/kg上升到7.79 mmol/kg,丙二醛含量由6.22 μg/g上升到28.99 μg/g[9]。将米糠清蛋白氧化程度与米糠酸败程度进行相关性分析(表2),米糠清蛋白羰基含量与米糠酸值和过氧化值呈显著(P<0.05)正相关,与丙二醛含量呈极显著(P<0.01)正相关;游离巯基含量与米糠酸值和过氧化值呈显著(P<0.05)负相关,与丙二醛含量呈极显著(P<0.01)负相关。大量关于蛋白质氧化改性的研究已证实,脂质氢过氧化物、自由基、活性醛等多种脂质氧化产物都可与蛋白质发生氧化还原反应[16-18]。其中,丙二醛是脂质过氧化反应中最易生成的挥发性羰基化合物,可与蛋白质分子的伯胺基发生加成反应,也可与赖氨酸、组氨酸残基等亲核侧链基团生成席夫碱,使蛋白质羰基含量增加[18]。丙二醛还可与半胱氨酸巯基形成稳定的加合物,致使游离巯基含量下降[18]。相比于羰基和游离巯基含量,米糠清蛋白二硫键含量与米糠过氧化值和丙二醛含量的相关性不显著,这可能是由于巯基氧化是一个极其复杂的过程。游离巯基通常先与自由基反应生成亚磺酰自由基,再与分子氧结合形成硫醇自由基,然后继续氧化形成二硫键,而二硫键又可以进一步氧化生成亚磺酸、磺酸等,这就导致清蛋白的二硫键含量随着米糠酸败程度的增加呈现先增后减的趋势[19]。总的来说,米糠酸败过程中清蛋白的氧化修饰主要是由脂质氧化产物诱导发生的,并且次级氧化产物活性醛类在这一过程中发挥了重要作用。

表 1 米糠酸败对米糠清蛋白氧化程度的影响Table 1 Effects of rice bran rancidity on the oxidation extent of rice bran albumin
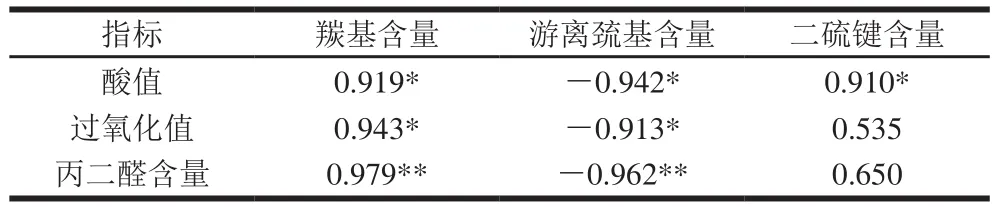
表 2 米糠清蛋白氧化程度与米糠酸败程度的相关性分析Table 2 Correlation analysis between oxidation extent of rice bran albumin and rancidity extent of rice bran
2.2 米糠酸败对米糠清蛋白氧化聚集和交联行为的影响
脂质氧化产物诱导蛋白质氧化过程中通常会促使蛋白质共价交联,形成可溶性聚集体[16-18]。如图1A所示,新鲜米糠在波长280 nm处有2 个强吸收峰和1 个弱吸收峰,对应的保留时间分别为12.05、11.33 min和5.6 min,前者主要是米糠蛋白及其亚基等小分子物质产生的特征吸收峰,后者是少量天然的米糠蛋白聚集体产生的特征吸收峰[9]。由图1B可知,随着米糠贮藏时间延长,米糠清蛋白聚集体对应的峰面积百分比逐渐增加(由1.04%增加到3.91%),表明米糠氧化酸败产物诱导清蛋白发生了氧化聚集。保留时间12.05 min的峰面积百分比先减小后增加,11.33 min的峰面积百分比先增加后减少,均在贮藏时间第5天达到极值,表明米糠酸败过程中清蛋白发生氧化聚集的同时还伴随少量氧化分解。这归因于米糠酸败产生的脂质氧化产物极其复杂,不同氧化产物诱导蛋白质氧化聚集的作用差异较大。目前相关研究表明脂质氢过氧化物、丙烯醛和丙二醛诱导蛋白质氧化聚集的能力较强,而过氧自由基诱导蛋白质氧化聚集的能力较弱,并且高浓度的丙二醛和过氧自由基还可能导致蛋白质主肽链断裂,形成较小的多肽片断[18-19]。
十二烷基硫酸钠-聚丙烯凝胶电泳是分析蛋白质亚基结构的主要方法,也是表征蛋白质氧化交联的重要手段。如图1C所示,新鲜米糠制备的清蛋白亚基主要分布在15~20、24、40~50 ku和60 ku,另外在22 ku和37 ku还有极浅的条带,这应该是少量残余谷蛋白的碱性亚基和酸性亚基[20]。随着米糠酸败程度的增加,分离胶顶部颜色逐渐加深,表明米糠氧化酸败产物诱导清蛋白发生了氧化交联。米糠贮藏第10天时,24 ku和60 ku附近的条带也明显加深,同样表明清蛋白发生了一定程度的氧化分解,形成新的多肽片断。结合前面巯基氧化的结果推断,二硫键和非二硫键共同参与了米糠酸败过程中清蛋白的氧化交联反应,由于巯基氧化形成二硫键的过程是可逆反应,二硫键共价交联的聚集体可能会部分降解。

图 1 米糠酸败诱导米糠清蛋白氧化聚集和交联Fig. 1 Oxidative aggregation and cross-linking of rice bran albumin induced by rice bran rancidity
2.3 米糠酸败对米糠清蛋白空间结构的影响
2.3.1 傅里叶变换红外光谱分析
蛋白质的二级结构组成与酰胺I带(1 700~1 600 cm-1)的振动频率密切相关。参考Sun Weizheng等[12]方法对米糠清蛋白的酰胺I带吸收光谱进行Gaussian拟合发现,新鲜米糠制备的清蛋白具有10 个特征吸收峰(图2A)。1 611 cm-1是由氨基酸侧链(尤其是酪氨酸残基等)产生的特征吸收峰[12,21]。1 618 cm-1特征吸收峰由β-折叠平行排列产生,1 630、1 639、1 674~1 694 cm-1特征吸收峰则由β-折叠反平行排列产生[12,22]。1 655 cm-1强吸收峰由α-螺旋结构的C=O伸缩振动产生[23]。1 647 cm-1特征吸收峰是由无规卷曲结构产生[21]。1 666 cm-1特征吸收峰是由β-转角结构产生[12]。随着米糠贮藏时间延长,氨基酸侧链、β-折叠结构和β-转角结构对应的特征吸收峰都发生了红移,并且在1 661 cm-1产生新的特征吸收峰,这一特征吸收峰通常被认为是随机结构产生的[23]。

图 2 不同酸败程度米糠制备的清蛋白傅里叶变换红外光谱分析Fig. 2 Fourier transform infrared analysis of rice bran albumin prepared from rice bran with different degrees of rancidity
如图2B所示,新鲜米糠制备的清蛋白中α-螺旋、β-折叠、β-转角、无规卷曲和氨基酸侧链的占比分别为20.09%、45.13%、18.93%、14.24%和1.62%。随着米糠贮藏时间延长,米糠清蛋白的α-螺旋、β-折叠、β-转角含量逐渐减少,无规卷曲和氨基酸侧链含量增加。当贮藏第10天,米糠清蛋白中α-螺旋、β-折叠、β-转角相对含量分别减少到17.49%、38.24%、14.88%,而无规卷曲和氨基酸侧链相对含量分别增加到27.41%和1.98%。Zhou Feibai等[21]采用亚油酸/脂肪氧合酶构建的模拟氧化酸败体系研究蛋白质氧化改性时发现,猪肌原纤维蛋白的二级结构呈现类似的β-折叠向无规卷曲结构转化的现象,并认为这与蛋白质氧化聚集体的形成有关。此外,α-螺旋/β-折叠可以在一定程度上反映蛋白质柔性的变化程度,α-螺旋/β-折叠的数值越大,蛋白质分子的柔性越小[24]。不同酸败程度米糠制备的清蛋白α-螺旋/β-折叠分别为0.445、0.446、0.448、0.453和0.457,表明米糠酸败过程中清蛋白的柔韧性逐渐降低,结构变得更加致密,这可能也与蛋白质氧化交联和聚集有关。
2.3.2 荧光光谱分析

图 3 不同酸败程度米糠制备的清蛋白荧光光谱分析Fig. 3 Fluorescence spectral analysis of rice bran albumin prepared from rice bran with different degrees of rancidity
如图3A所示,随着米糠贮藏时间延长,米糠清蛋白的内源荧光强度显著(P<0.05)下降,这是因为色氨酸残基具有较低的单电子氧化势能,极易被自由基等氧化形成犬尿氨酸,产生荧光猝灭现象[19]。随着米糠贮藏时间延长,米糠清蛋白的最大荧光峰位蓝移,从359 nm蓝移到357 nm,表明米糠清蛋白中色氨酸残基微环境的非极性增强,结合前面液相色谱和凝胶电泳结果推断,这应该是带有色氨酸残基的部分疏水性侧链被脂质氧化产物诱导形成了结构致密的聚集体,从而避开外部极性环境造成的[19]。
如图3B所示,随着米糠贮藏时间延长,米糠清蛋白的表面疏水性显著(P<0.05)下降。这一方面可能是因为自由基、活性醛类等脂质氧化产物极易与蛋白质疏水性侧链基团反应,导致其表面疏水性下降[19];另一方面可能归因于蛋白质-蛋白质相互作用(二硫键、二酪氨酸、疏水作用力等)形成的氧化交联或聚集体,屏蔽了米糠清蛋白中的疏水位点[9]。
2.4 米糠酸败对米糠清蛋白界面性质的影响
2.4.1 米糠酸败对米糠清蛋白溶解度和Zeta电位的影响
如图4A所示,在pH 7.0条件下,新鲜米糠制备的清蛋白溶解度为64.0%,随着米糠贮藏时间延长,米糠清蛋白的溶解性逐渐下降,表明米糠氧化酸败产物还会诱导米糠清蛋白产生不溶性的氧化聚集体。Wu Wei等[25]关于蛋白质氧化改性的研究发现,脂质过氧化产物中丙烯醛是诱导蛋白质氧化交联产生不溶性聚集体的主要化合物。
如图4B所示,在pH 7.0条件下,米糠清蛋白羧基去质子化,使蛋白质分子表面带负电荷。新鲜米糠制备的清蛋白溶液Zeta电位绝对值为11 mV,通过负的静电斥力使蛋白质溶液体系稳定。随着米糠贮藏时间延长,Zeta电位绝对值显著(P<0.05)降低,结合前面研究结果推断,这可能是因为氧化交联形成的可溶性和不溶性聚集体阻碍了蛋白质羧基解离,从而使蛋白质分子间的静电斥力减弱。

图 4 米糠酸败对米糠清蛋白溶解度(A)和Zeta电位(B)的影响Fig. 4 Effects of rice bran rancidity on the solubility (A) and zeta potential (B) of rice bran albumin
2.4.2 米糠酸败对米糠清蛋白乳化性质和起泡性质的影响


图 5 不同酸败程度米糠制备的清蛋白乳化性质和起泡性质Fig. 5 Emulsifying properties and foaming properties of rice bran albumin prepared from rice bran with different degrees of rancidity
如图5A、B所示,随着米糠贮藏时间延长,米糠清蛋白的乳化性和乳化稳定性均呈现逐渐下降的趋势,乳化性由65.20 m2/g下降到50.10 m2/g,乳化稳定性由8.77 min下降到5.05 min。目前大量研究已证实,较高浓度的羟基自由基、过氧自由基等自由基类氧化剂会导致蛋白质的乳化性质下降,较高浓度的13-氢过氧化十八碳二烯酸也会导致谷物蛋白的乳化性和乳化稳定性下降,并认为是由于氧化聚集行为使蛋白质的溶解性、持水性、持油性下降所致[12,19,26]。可见,米糠酸败过程中清蛋白乳化性和乳化稳定性的下降是脂质氢过氧化物、自由基等氧化剂协同作用的结果。
米糠蛋白的起泡性取决于蛋白质分子在气-液界面通过构象变化和分子间作用力快速形成黏弹性蛋白膜的能力,起泡稳定性则取决于已形成的稳定蛋白膜抵抗重力和机械应力的能力[5]。如图5C、D所示,随着米糠贮藏时间延长,米糠清蛋白的起泡能力和起泡稳定性均呈现逐渐下降的趋势,起泡能力由55.84%下降到39.90%,起泡稳定性由67.80%下降到53.50%。尤翔宇等[19]研究发现较高浓度(>3 mmol/L)的过氧自由基会导致米糠蛋白起泡性和起泡稳定性下降,并认为是蛋白质-蛋白质相互作用形成的不溶性聚集体阻碍了蛋白质分子在气-液界面形成黏弹性好的连续蛋白膜。
2.4.3 米糠清蛋白氧化程度、结构特征、界面性质之间的相关性分析

表 3 不同酸败程度米糠制备的清蛋白氧化程度、结构特征与界面性质之间的相关性分析Table 3 Correlation analysis between oxidation markers, structural characteristics and interfacial properties of rice bran albumin prepared from rice bran with different degrees of rancidity
通过对米糠清蛋白氧化程度、结构特征和界面性质之间进行相关性分析,进一步探索米糠酸败诱导的氧化修饰对米糠清蛋白界面性质的影响。如表3所示,米糠清蛋白的乳化性、乳化稳定性、起泡能力和起泡稳定性与其羰基含量、α-螺旋/β-折叠呈极显著(P<0.01)负相关,与游离巯基含量、表面疏水性、Zeta电位绝对值、溶解度呈极显著(P<0.01)正相关。α-螺旋/β-折叠反映了蛋白质分子的柔性程度,而柔性对蛋白质的界面性质具有显著影响。王健等[27]关于大豆蛋白的改性研究发现,大豆分离蛋白的柔性与乳化性和乳化稳定性呈显著正相关,Li Rui等[28]研究发现蛋白质柔性不仅与乳化性质呈显著正相关,还与起泡能力和起泡稳定性呈显著正相关。较好的柔性有利于蛋白质在油-水界面或气-液界面的初始吸附和结构重排[27]。蛋白质界面性质与其表面疏水性和溶解性的相关性也被多项研究证实,这是因为表面疏水基团的暴露和溶解度的增加同样可以促进蛋白质在油-水界面或气-液界面吸附[29-30]。Zeta电位是维持蛋白质胶体分散体系稳定性的主要因素。Hu Zhenying等[31]研究发现Zeta电位绝对值的降低会导致溶液稳定性下降,促进液滴凝聚,降低蛋白质的乳化活性。可见,米糠酸败过程中米糠清蛋白的氧化交联或聚集降低了蛋白质分子的柔性和表面疏水性,并导致蛋白溶液Zeta电位下降,在这些变化的共同影响下,米糠清蛋白的界面性质持续下降。
3 结 论
米糠酸败会诱导米糠清蛋白发生羰基化和巯基氧化反应。通过对米糠清蛋白氧化程度和米糠酸败程度之间进行相关性分析发现,米糠清蛋白的氧化修饰主要是由脂质氧化产物诱导发生的,并且次级氧化产物活性醛类在这一过程中发挥了重要作用。米糠酸败过程中,米糠清蛋白会通过二硫键和非二硫共价键交联形成可溶性的氧化聚集体,在氧化交联的同时还伴随少量氧化分解。米糠酸败诱导的蛋白质氧化会促使米糠清蛋白的空间结构发生复杂变化,主要表现为二级结构中的α-螺旋、β-折叠、β-转角含量减少,无规卷曲和氨基酸侧链含量增加,同时维持蛋白质三级结构稳定性的疏水作用力减弱。米糠清蛋白的结构变化会极大地影响其界面性质。随着米糠酸败程度增加,米糠清蛋白溶液的Zeta电位和蛋白质溶解度下降,乳化性、乳化稳定性、起泡能力和起泡稳定性等界面性质也随之下降。总的来说,米糠氧化酸败产物诱导米糠清蛋白通过蛋白质-蛋白质相互作用(二硫键、非二硫共价键、疏水作用力等)形成可溶性和不可溶的聚集体,导致蛋白质分子柔性和表面疏水性下降,分子间静电斥力减弱,进而对米糠清蛋白的界面性质产生负面影响。

