L-组氨酸修饰乳清蛋白结构及其热诱导凝胶特性
王耀松,马天怡,胡荣蓉,张唯唯,应瑞峰,黄梅桂,唐长波,*
(1.南京林业大学轻工与食品学院,江苏 南京 210037;2.肉品加工与质量控制教育部重点实验室,南京农业大学食品科学技术学院,江苏 南京 210095;3.南京农业大学食品科学技术学院 农业农村部肉品加工重点实验室,江苏省肉类生产加工与质量控制协同创新中心,江苏 南京 210095)
近些年来对小分子物质碱性氨基酸——精氨酸(Arg)、赖氨酸(Lys)和组氨酸(His)与蛋白质相互作用机制等理论方面的研究取得了一些进展[1-5]。同时也开展了这些氨基酸在食品蛋白体系中的应用研究,以改善食品蛋白基质凝胶性[3,6]、乳化性[7]和溶解性[5,8]等功能特性。碱性氨基酸是构成蛋白的基本单元,无毒、无免疫性且来源广泛、经济便宜[9],现已批准作为香料添加剂加入食品中[10]。
研究发现His在低离子强度环境下通过延长鸡胸肌球蛋白轻链和杆部的长度提高蛋白的溶解性,降低成胶温度并促使蛋白形成结构更加细致的透明凝胶[11-12];在鳙鱼肌纤维蛋白体系中通过添加His改变溶液的pH值从而改变蛋白带电量、并与芳香族氨基酸相互作用而抑制蛋白成胶[13],另外在低离子强度的蛋白溶液中,His通过打断蛋白结构展开的蛋白间静电作用力、扰乱蛋白表面疏水性而弱化蛋白凝胶[14]。Guo[15]和Zhang Yawei[16]等发现,His引起猪肉肌纤维蛋白的二级结构有序性降低、暴露疏水基团和巯基基团而提高蛋白溶解性,再结合NaCl处理能够提高肌纤维蛋白热诱导凝胶性和持水性[16]。Hayakawa等[17]研究结果显示His通过抑制鸡胸重链肌纤维蛋白聚合而促进凝胶完整结构的形成。Chen Xing等[5]认为His的咪唑基结构对提高肌纤维蛋白的溶解性起到重要作用。此外His能显著增强兔肉肌球蛋白的溶出率、凝胶强度和保水性[18];还可以通过与铁离子配位提高血红蛋白的稳定性[19]。从营养功能上来讲,His是人体营养的必需氨基酸[20]。
目前研究内容集中在肌纤维蛋白的结构及其凝胶性能,鲜见对L-His的质量浓度效应、乳清蛋白构象及所成凝胶中化学作用力的影响作系统研究。本课题组在近期的研究中比较了不同碱性氨基酸对乳清蛋白热诱导凝胶功能性有修饰作用[9],选用乳清蛋白作为模式蛋白,着重讨论系列质量浓度的L-His在不同pH值下(2.00、5.20、7.59、9.74、10.76;后4 种pH值分别对应乳清蛋白、His、Lys和Arg的等电点)对蛋白结构的影响,以及这种影响与蛋白所成凝胶功能性之间的内在关系,以期为L-His改善蛋白凝胶性提供理论参考。
1 材料与方法
1.1 材料与试剂
乳清蛋白WPI-90 美国加州Hilmar公司;L-His生工生物技术(上海)股份有限公司;其他试剂均购自国药集团化学试剂有限公司;所有试剂均为分析纯。
1.2 仪器与设备
TA-XT plus质构仪 英国Stable Micro Systems公司;BT-90纳米激光粒度分布仪 丹东百特仪器有限公司;Nanoplus 2 Zeta电位仪 麦克默瑞提克(上海)仪器有限公司;NanoDrop2000C超微量分光光度计 赛默飞世尔科技(中国)有限公司;SpectraMax®i3x多功能酶标仪美谷分子仪器(上海)有限公司;FE28 pH计 梅特勒-托利多仪器(上海)有限公司;DK-S26电热恒温水浴锅上海精宏实验设备有限公司;UVmini-1240紫外-可见分光光度计 岛津企业管理(中国)有限公司。
1.3 方法
1.3.1L-His/乳清蛋白混合溶液的制备
称取一定质量乳清蛋白加入去离子水中充分搅拌直至全部溶解,使得蛋白质量浓度为120 mg/mL;加入最终质量浓度分别为0、1、3、5 mg/mLL-His后充分搅拌,将每个质量浓度分成5 部分,使用1 mol/L HCl或NaOH溶液,再将各组蛋白溶液pH值分别调节至2.00、5.20、7.59、9.74和10.76。放置4 ℃备用。
1.3.2 粒径和Zeta电位测定
根据Cheng Yu等[21]的方法修改。用蒸馏水将新鲜制备的储备溶液均稀释到10 mg/mL,使用BT-90纳米激光粒度分布仪测定粒径,并用Nanoplus 2 Zeta电位仪测定其Zeta电位。
1.3.3 紫外光谱测定
根据Agyare等[22]的方法修改。使用与储备样品相同pH值的蒸馏水将蛋白样品稀释到2 mg/mL,再应用超微量分光光度计记录已稀释好的样品在240~380 nm波长范围的吸光度。
1.3.4 荧光光谱扫描
根据Agyare等[22]的方法修改。使用1.3.3节方法稀释的样品,应用SpectraMax®i3x多功能酶标仪扫描上述稀释蛋白溶液的荧光强度。激发光波长和发射光波长(300~500 nm)的狭缝设置为5 nm,激发波长设置为280 nm,测定300~500 nm波长下荧光强度。
1.3.5L-His/乳清蛋白凝胶的制备
将不同质量浓度的L-His、不同pH值的蛋白储备溶液每份准备25 mL,加入内径35 mm、高度30 mm的小烧杯内,90 ℃水浴中加热30 min,取出置于冰水浴冷却至室温,置于4 ℃以下过夜(12 h)成凝胶后待用。从烧杯内小心取出,倒置于黑色背景绒布上,为凝胶竖立面拍照及功能性、化学作用力测试用。
1.3.6 凝胶质构测定
采用质构仪2 次下压的模式测定凝胶的质构特性。探头测试前、测试中及测试后的速率分别设置为1.0、2.0 mm/s和5.0 mm/s;下压距离10.0 mm,触发力5.0 g;凝胶形状为圆柱形(35 mm×30 mm)。凝胶质地以Bourne[23]定义计算其硬度、弹性、黏聚性、胶黏性、咀嚼性和回复性。每个处理重复测定3 次。
1.3.7 化学作用力测定
参照Chawla等[24]的方法测定对照组(0 mg/mL)、5 mg/mLL-His/乳清蛋白混合凝胶中的化学作用力。采用在4 种溶剂中的溶解度表示,分别将它们标记为S1、S2、S3、S4,试剂分别为S1:pH 8.0 20 mmol/L Tris-HCl;S2:pH 8.0 20 mmol/L Tris-HCl含有10 mg/mL十二烷基硫酸钠(sodium dodecyl sulfate,SDS);S3:pH 8.0 20 mmol/L Tris-HCl含有10 mg/mL SDS和8 mol/L尿素;S4:pH 8.0 20 mmol/L Tris-HCl含有10 mg/mL SDS、8 mol/L尿素和2%β-巯基乙醇。每份称取1.0 g的凝胶,分别加入8 mL上述溶液,在室温条件下摇匀静置过夜,采用双缩脲法测定溶解出的蛋白质含量。溶解度定义为溶出蛋白所占凝胶块内总蛋白的比例。
1.3.8 持水性测定
参考Wang Yaosong等[25]的方法,取适量质量(2.0 g)乳清蛋白凝胶置于含滤纸的离心管中,3 000×g离心20 min,再称离心后的凝胶质量。持水性(waterholding capacity,WHC)按下式计算:

式中:m1为凝胶、离心管和滤纸的质量;m为离心管与滤纸的质量;m2为离心后去除凝胶的质量。
1.4 数据处理
数据处理使用Statistix软件(Analytical Software,Tallahassee, FL, USA)进行统计分析;用LSD检验数据间的差异显著性,P<0.05,差异显著。
2 结果与分析
2.1 L-His对乳清蛋白粒径、比表面积和Zeta电位的影响

图 1 不同pH值时L-His对乳清蛋白粒径(A)、比表面积(B)及其Zeta电位(C)的影响Fig. 1 Influence of L-His on whey protein particle size (A), specific surface area (B) and zeta-potential (C) at various pH values
如图1所示,从分子聚集、静电行为的角度来看,L-His与乳清蛋白间的相互作用改变了蛋白聚集行为及其带电性,进而造成对蛋白凝胶性能的影响。在乳清蛋白等电点时(即pH 5.2),蛋白粒径在1 680~1 780 nm波长范围内,显著大于在其他pH值时所形成的蛋白聚集体粒径(约为370~470 nm),而越远离等电点时蛋白聚集体粒径越小[26],并随着L-His质量浓度的增加而进一步减小聚集体粒径。蛋白聚集体的比表面积与蛋白聚集体粒径有相反的变化规律;在pH 5.2时,其比表面积值达到最小值;越远离等电点,特别是在碱性pH值条件下蛋白聚集体的比表面积增大50~70 倍。此外,蛋白分子在pH 2.0时带有少量的正电;在乳清蛋白等电点时,其中非乳球蛋白可能因蛋白羧基、氨基去质子化而使蛋白带少量的负电荷;pH值的提高促使蛋白分子去质子增多而带更多的负电荷,而L-His进一步提高蛋白分子的带负电荷。L-His不及pH值对蛋白聚集体的粒径、比表面积及带电性的影响显著,然而在同等pH值时它能够进一步改变乳清蛋白聚集体的粒径、比表面积和带电量,从而为乳清蛋白所形成凝胶功能性的改善提供了重要的分子基础。
2.2 L-His对乳清蛋白结构的影响

图 2 不同pH值时L-His与乳清蛋白相互作用的紫外光谱Fig. 2 UV absorption spectra of whey protein interacted with L-His at various pH values
为进一步说明L-His对乳清蛋白分子结构的影响,采用紫外光谱和荧光光谱的方法对乳清蛋白成胶溶液进行表征。蛋白分子中能够引起紫外吸收和荧光吸收的主要是色氨酸(Trp)和酪氨酸(Tyr)及苯丙氨酸(Phe)[27-28]。从图2可以看出,在低于乳清蛋白等电点的pH值时,随着L-His质量浓度的提高,样品的紫外吸收强度明显上升(图2A);在蛋白等电点时,L-His质量浓度的提高反而引起样品的紫外吸收强度下降,但比对照组要高(图2B);随着pH值越过蛋白等电点并进一步提高时,样品的紫外吸收强度开始降低,L-His质量浓度的提升在此基础上进一步降低蛋白的紫外吸收强度(图2C~E)。
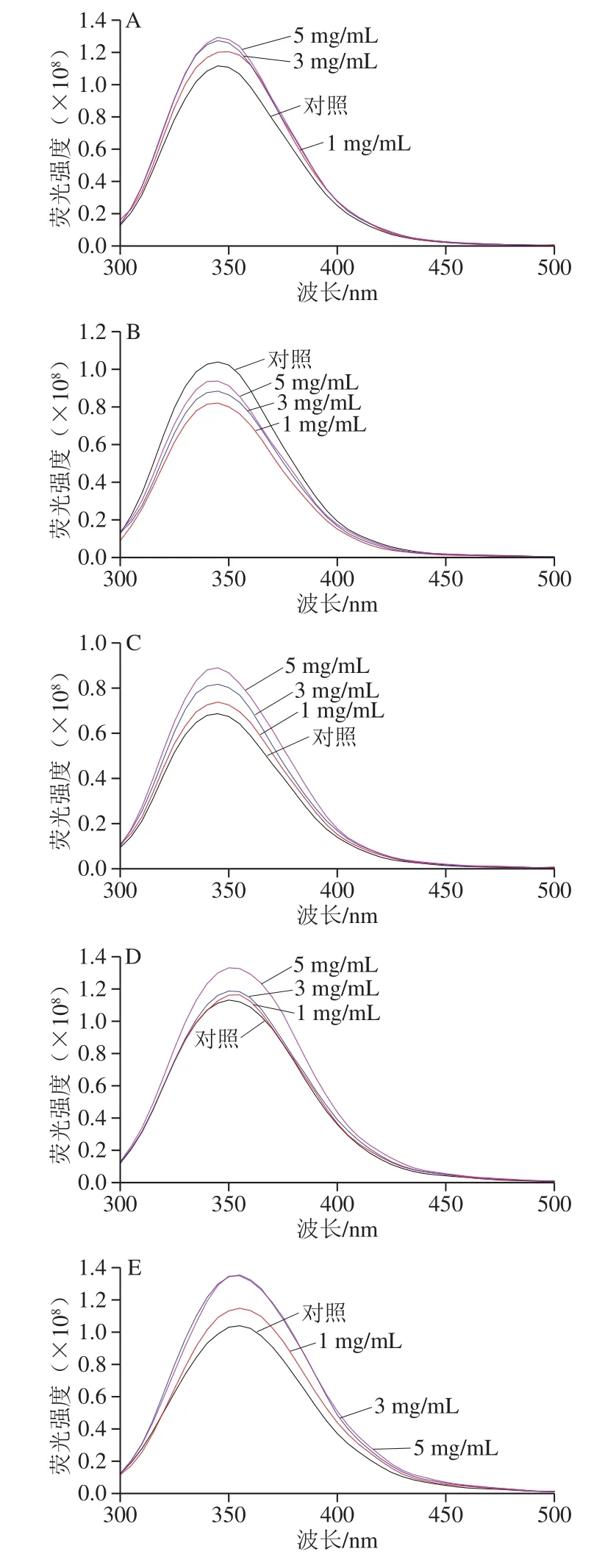
图 3 不同pH值时L-His与乳清蛋白相互作用的荧光光谱Fig. 3 Fluorescence spectra of whey protein interacted with L-His at various pH values
在荧光光谱中(图3),除在乳清蛋白等电点之外的pH值,L-His的加入均能有效提高样品的荧光强度,在pH值远离等乳清蛋白电点时样品的荧光强度更大(图3A、E)。对荧光强度提升贡献的氨基酸主要是Trp、Tyr和贡献极小的Phe[28],并且3 种氨基酸的疏水性顺序依次为Phe、Trp和Tyr。结合以上2 种蛋白光谱在不同pH值和不同质量浓度L-His下的行为,可推测越远离等电点的pH值,L-His赋予蛋白带有更多的绝对电量,促使蛋白分子结构“折叠”和聚集体形成;即在酸性环境下(pH 2.00)促使乳清蛋白分子间聚集体变小从而致使Tyr和Trp暴露,而碱性条件(特别是pH 9.74、10.76)导致单个蛋白分子更多展开而使Tyr更多暴露,并让蛋白变得更易亲水而显著提高蛋白荧光强度。此外在远离等电点的pH值中,特别是在碱性pH值条件下,蛋白分子从Tyr残基到Trp残基之间还可能存在能量转移而导致Tyr荧光猝灭及Trp荧光增强[29-30]。综合蛋白分子间聚集、单个蛋白分子结构展开程度和发生在氨基酸之间的荧光转移等因素的效应,L-His在一定程度上进一步促进这些因素的影响程度,从而实现对乳清蛋白的结构改变而改善其所成凝胶的功能性。
2.3 L-His对乳清蛋白热诱导凝胶形貌及质构的影响

图 4 不同pH值及不同质量浓度L-His时乳清蛋白热诱导所成凝胶的感官形貌图Fig. 4 Appearance of heat-induced whey protein gels with added L-His at various pH values
作为蛋白凝胶,其形貌和颜色对其在真实食品体系中的应用极为重要。从图4可看出,在其等电点处,乳清蛋白可形成白色、粗糙的凝胶;而在远离等电点pH 2.00时,凝胶的“完整性”开始降低,且黄度显著增加;随着pH值越过乳清蛋白等电点时,凝胶在结构上更加完整、细腻且颜色呈现更高的黄度。对于在同一pH值时,L-His的加入能够有效提高凝胶的完整性,但对颜色影响不及pH值的影响大。在以前的一些研究中,也发现了碱性氨基酸加入到蛋白中,能够促进疏水基团及反应性巯基基团的外露而致使凝胶性能的提升[31-32]。至于颜色的变化,在一些报道中认为是美拉德反应造成的[33]。
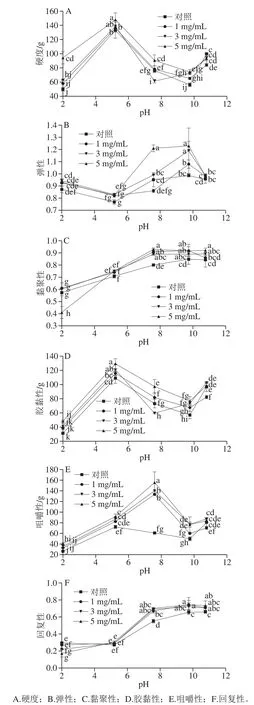
图 5 不同pH值时L-His对乳清蛋白热诱导凝胶质地的影响Fig. 5 Influence of L-His on textural properties of heat-induced whey protein gels at vairous pH values
如图5所示,为了满足对食品多功能性凝胶质构多样性的要求以符合真实食品体系的不同要求,本研究对乳清蛋白热诱导凝胶的全质构进行了系统测定。在乳清蛋白等电点pH 5.20处所形成的凝胶要比其他pH值条件下所形成的蛋白凝胶具有极显著性高的硬度,其数值在130 g左右;而在pH 2.00或pH 7.59及pH 9.74条件下所形成蛋白凝胶的硬度偏低,但随着pH值升至10.76,其强度又显著上升至80~100 g。L-His的加入,特别是当L-His的质量浓度为5 mg/mL之时(图5A),能够显著提升凝胶的硬度。凝胶的胶黏性(图5D)也有类似的现象。凝胶的弹性除了在等电点处有所降低,在pH 7.59和pH 9.74时达到最高值后随即略有下降(图5B)。而对于凝胶的黏聚性和回复性,其值均随着pH值的提高而显著提高(P<0.05),在pH 7.59之后趋向平稳。L-His质量浓度效应对凝胶的黏聚性和回复性的提高不及pH效应显著,但对于同一pH值下,特别是pH 2.00和pH 7.59下却能够显著提高黏聚性和回复性(P<0.05)。随着pH值的升高至7.59,凝胶的咀嚼性值升到最大值,在pH 9.74时咀嚼性显著下降(P<0.05),但在pH 10.76时其值又略有上升;而L-His的加入则能够提高凝胶咀嚼性,特别是能够极显著地提高在pH 7.59时所成凝胶的咀嚼性(P<0.05)。总体看,L-His能够显著提升和改造乳清蛋白热诱导凝胶的一些质构特性;再结合pH值成胶条件,则能够形成多质构功能特性的凝胶。
2.4 L-His对乳清蛋白热诱导凝胶分子间作用力的影响
热诱导凝胶中分子间的作用力主要是二硫键和疏水相互作用力、氢键和静电相互作用力,这些力维系胶体的凝聚态[34]。为了探究在加入L-His后热诱导蛋白凝胶中作用力的变化,测定了凝胶中的蛋白在4 种不同溶液中的相对溶解度,结果如表1所示。在对照组中(无L-His),pH 2.00下所形成凝胶中的疏水作用力、氢键是主要作用力;在乳清蛋白等电点(pH 5.20)下所成凝胶,其中主要作用力是氢键及少量的二硫键;在pH 7.59和pH 9.74下所成凝胶中的作用力则主要是二硫键,相比之下疏水相互作用力和氢键则很微弱;然而在pH 10.76,凝胶中主要作用力又转为氢键,而其他2 种作用力对胶体内部作用力贡献不大。加入5 mg/mLL-His后,则能显著降低(P<0.05)在pH 2.00下所成凝胶中的二硫键作用力,而在此时对凝胶中的疏水相互作用力和氢键影响不显著(P>0.05);却能显著提高(P<0.05)在pH 5.20和pH 7.59时所成凝胶中的二硫键作用力,但对疏水作用力和氢键影响不大;也显著降低了在pH 9.74下所成凝胶中的二硫键作用力;当pH值提升到10.76后所成凝胶,L-His的加入却显著提高疏水作用力和氢键作用力,但对二硫键影响不显著。在一些研究中,发现二硫键与凝胶的弹性有极强的正相关关系[35];在本研究中也发现此现象,图5B显示凝胶弹性变化规律与表1中的二硫键含量变化之间有一致的关系。总之,L-His的加入改变了凝胶中的各种作用力,这为凝胶质地多样功能性提供了一种策略。
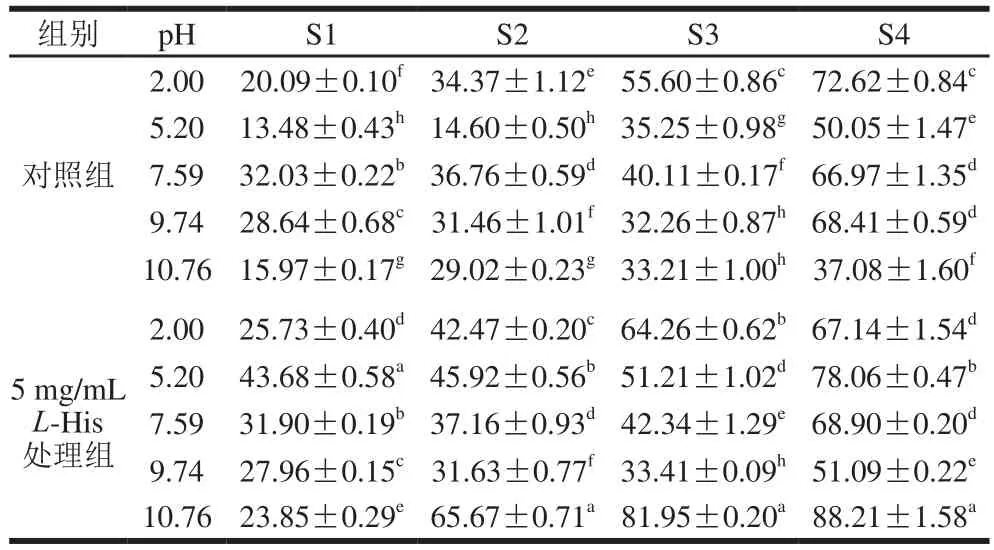
表 1 L-His修饰乳清蛋白热诱导凝胶在不同溶液中的蛋白溶解度Table 1Protein solubility of heat-induced whey protein gels modified by L-His in various solvents
2.5 L-His对乳清蛋白热诱导凝胶持水性的影响

图 6 不同pH值时L-His对乳清蛋白热诱导凝胶持水性的影响Fig. 6 Influence of L-His on WHC of heat-induced whey protein gels at various pH values
持水性是凝胶的一个重要功能性质,同时也是凝胶微观结构的反映[36]。由图6可以看出,在乳清蛋白等电点处所形成的蛋白凝胶,其持水性最低。在pH 2.00时凝胶持水性显著性高,随着pH值越过等电点提升到7.59后,无论是对照组还是加入L-His的处理组,凝胶持水性均随着pH值升高而显著提高(P<0.05)。此外,对于同一pH值下,L-His的加入则能进一步显著提高凝胶持水性(P<0.05),特别是质量浓度5 mg/mLL-His的加入。在乳清蛋白等电点处所形成的凝胶,蛋白分子由于几乎不带电,其形成比在其他pH值下大4~5 倍的聚集体平均粒径并有极小的比表面积(图1B),这些粒子与水分子相互作用较弱[37];在微观结构上也发现这些粒子形成结构松散的球形聚结体[9];这些结果预示着良好的蛋白凝胶形成要选择远离其等电点。除在乳清蛋白等电点pH 5.20外,L-His通过抑制蛋白聚集、提高聚集体比表面积并促进蛋白分子带电量,形成有序微观结构而显著提高凝胶持水性。
3 结 论
在乳清蛋白中加入L-His并结合pH值调节,可形成具有不同质构特性、持水性和不同颜色的热诱导凝胶。pH值改变乳清蛋白构象和带电量,在微观尺度上形成不同粒径和比表面积的聚集体;L-His在此基础上进一步促进这些物理化学效应,改变凝胶中的化学作用力,形成有序结构进而显著提高凝胶的质构性能和持水性。此外在乳清蛋白等电点时,乳清蛋白所形成凝胶呈现白色并且结构粗糙,而越远离其等电点时凝胶黄度越大且结构细腻(特别是在碱性条件下),但L-His对颜色和细腻度影响不显著。廉价且安全的天然产物L-His,可作为一种提高蛋白基质凝胶功能的增强剂。

