超声引导下经“肾盏穹隆-盏颈轴线”两步穿刺法
——PCNL通道建立的解剖学研究及临床应用
饶 婷,阮 远,程 帆
(武汉大学人民医院泌尿外科,湖北武汉 430060)
尿路结石是泌尿系统常见病、多发病,流行病学研究显示我国患病率为1.0%~5.0%,并呈逐年递增趋势,其高患病率、高复发率、高治疗成本给患者及社会带来沉重的负担[1]。经皮肾镜碎石取石术(percutaneous nephrolithotomy,PCNL)作为一种微创方法被广泛应用于上尿路结石的临床治疗,建立安全、高效的经皮肾通道是该技术的关键点。PCNL治疗效果高度依赖于通道建立的安全性及有效性,理想的操作通道在彻底清除结石的同时,能最大限度减少手术并发症。肾脏血管解剖是建立安全通道的基础,基于集合系统结构及其与结石分布关系的效率原则是最大限度提高结石清除率的关键所在[2]。基于大量临床实践和应用研究,我们摸索出了一套利用超声定位实现精准穿刺建立安全、高效经皮肾通道的方法,并逐渐形成了基于肾脏血管及集合系统解剖的PCNL通道建立的理论体系,本文就PCNL通道建立的相关经验和认识进行分析总结。
1 PCNL的发展历程
PCNL发展与演变历程是一部通道建立的发展史。1976年,FERNSTROM和JOHANSSON首先报道X线引导下使用经皮肾镜技术处理肾结石,从而促成PCNL技术的诞生[3]。我国自20世纪80年代开始引入PCNL技术,2005年后该技术发展迅猛,在传统X线引导基础上逐渐向超声引导建立经皮肾通道过渡,并逐步在国内应用推广。
1.1 体位及无管化1987年VALDIVIA-URIA等报道了仰卧位PCNL(supine PCNL,sPCNL)的第一个大型临床研究,开启了内镜联合肾内手术的时代[4]。尽管俯卧位不再是进行PCNL的唯一体位,但许多泌尿外科医师仍不愿考虑sPCNL,开展一项大型的前瞻性、多中心、随机临床试验以验证sPCNL的有效性和安全性可能有助于突破当前的困境。1984年WICKHAM等[5]首次报道了术后无管化PCNL。目前,普遍认为无管化PCNL与较低的术后镇痛需求和较短的住院时间相关,且不会增加术后失血量。尽管尚未明确无管化PCNL的适应证,但需注意的是无管化PCNL最初仅在高度选择的病例中进行。完全无管化PCNL在术后不放置引流管的同时不留置输尿管支架,有研究表明在把握好适应证的前提下,完全无管化PCNL是安全、有效的,但同样面临着普适性的安全问题[6]。
1.2 通道小型化HELAL等[7]在1997年首次报道对儿童肾结石患者使用F15通道进行微创经皮肾镜碎石取石术(minimally invasive percutaneous nephrolithotomy,MPCNL),并提出微通道经皮肾镜手术(mini-PCNL)的概念。近10年来,超微通道经皮肾镜手术(ultramini-PCNL)及micro-PCNL也已被逐渐广泛采用,以减少PCNL相关的手术并发症。尽管定义并不统一,但需要注意的是这些代表通道大小的术语不仅表明通道鞘的尺寸,还涵盖了特定的操作器械及手术概念。由于在减少出血和缩短住院时间等方面的疗效明显,通道小型化已成为PCNL发展的主要趋势之一。然而,较小的通道可能会增加手术操作时间,如何平衡安全和手术效率仍然是主要挑战[8]。
1.3 引导技术最初PCNL通道建立是在X线引导下进行的。X线引导穿刺不仅对肾脏集合系统具有很好的识别效果,在建立多通道及经上下肾盏穿刺方面也具有独特优势。超声(ultrasound,US)引导穿刺建立皮肾通道已被广泛应用于临床实践。超声没有抗辐射要求,便于推广使用,是PCNL穿刺不可或缺的重要工具。彩色多普勒超声对血管的敏感性更高,可以充分地显示肾脏动脉分布,有助于穿刺时识别并避开通道内异位血管。对于复杂病例,同时使用超声和X线引导的组合方法同样值得尝试。
针对不同的引导设备目前已开发出多种辅助穿刺技术。ClearGuideOne、SonixGPS和UProbe-2等计算机辅助可视化系统能够在超声监视器上实时显示穿刺针的轨迹,使得穿刺线可视化成为现实[9]。多种技术及设备联合引导是PCNL穿刺技术发展的重要方向之一。术前计算机断层扫描(computed tomography,CT)和术中US动态融合成像引导下穿刺是一个有趣的尝试,相关临床研究显示该技术是安全可靠的[10]。需要注意的是,该技术虽然实现动态融合成像,但本质上是CT横截面图像重建,难以用于纵向穿刺。
2 PCNL通道建立的相关肾脏应用解剖与安全路径
PCNL通道建立相关肾脏应用解剖的发展历程主要包括三个阶段,包括早期解剖学研究的贡献,此后过渡到开放手术时代,最后现代医学影像学进一步定义了肾脏应用解剖。SAMPAIO在20世纪90年代对尸体肾脏集合系统和血管解剖的研究具有重要意义[7],因为它进一步帮助泌尿外科医师建立一种操作规范,即应通过穿刺肾盏穹隆而不是漏斗部来进入集合系统,以最大程度地减少出血的风险。
出血是PCNL最常见的手术并发症之一,对患者的治疗和预后影响极大,曾是PCNL手术面临的最大挑战。肾脏血管解剖是建立安全皮肾通道的基础,选择准确的穿刺路径是减少手术出血的关键所在。建立从皮肤到肾集合系统的通道来实现碎石取石,这一过程中如何避开大的肾脏血管分支,关系到PCNL手术的安全与效率。事实上,肾脏血管分布在X线和普通超声中并不能清晰显示,穿刺过程的完成均是以集合系统作为定位标志而进行的,因此血管解剖的重要性并没有得到足够的重视。
根据现有肾脏的血管解剖认识,肾动脉(Ⅰ级)及前后主干动脉(Ⅱ级)分布在肾窦内,髓质层中的肾段动脉(Ⅲ级)发出叶间动脉(Ⅳ级)走形于肾锥体两侧的肾柱内。叶间动脉在肾锥体底部发出弓形动脉(Ⅴ级),走形过程中进一步发出小叶间动脉(Ⅵ级)进入肾皮质。PCNL严重手术出血通常与Ⅲ级和Ⅳ级动脉损伤相关。在以超声或X线作为引导手段进行穿刺时,肾锥体并不能作为穿刺的定位标志来寻找其“中心线方向”,因为肾锥体与肾皮质在超声和X线下对比不明显,难以辨识其具体位置。根据肾锥体与肾小盏一对一的解剖关系,肾锥体中心线的延长方向应该正好是肾小盏的轴线方向,而肾小盏因其内部为“尿液”填充,在超声和X线下可清楚显示轮廓,因此以肾小盏轴线作为定位标记穿刺进入集合系统,理论上是对肾柱内血管的最小损伤线。
3 超声引导下经“肾盏穹隆-盏颈轴线”两步穿刺法
我们团队[11]在国内外率先提出的超声引导下经“肾盏穹隆-盏颈轴线”两步穿刺法(简称“两-两穿刺法”)建立PCNL通道,经过国内同行的应用实践以及我们单中心8 000余例的临床实践,已被证实是一种基于肾脏血管及集合系统解剖安全、高效的通道建立方法。该方法核心主要包括3个方面的内容,首先是根据肾脏结石分布和肾集合系统结构,结合术前影像资料和术中超声实时动态扫描,选定最佳穿刺目标盏;其次是根据肾脏血管解剖与集合系统关系,选择目标盏穹窿部正中至盏颈平面中心点的连线,即目标盏“穹窿-盏颈轴线”,为最终进针方向;第三是熟练应用超声实时监控穿刺针道,根据肾脏随呼吸移动及肋骨遮挡情况,灵活选择皮肤穿刺点,根据“两-两穿刺法”按既定路径准确穿刺进入目标肾盏。我们团队[12]的系列回顾性研究显示,超声引导下经“两-两穿刺法”建立PCNL通道的总体输血率约为1.2%~3.6%,由于血流动力学波动及保守治疗无效进行超选择性动脉栓塞的比例约为0.7%。同时,“两-两穿刺法”在马蹄肾、孤立肾及经腹途径盆腔异位肾PCNL通道建立中也均展示出可靠的临床应用价值[13-14]。
受肾脏随呼吸移动的影响,皮肤选点常具有不确定性,采用“两-两穿刺法”可有助于实现目标肾盏“穹窿-盏颈轴线”方向穿刺进入集合系统(图1)。“两-两穿刺法”的第一个“两”是指两点定位,即目标肾盏“穹窿-盏颈轴线”的两个端点,一个是肾小盏穹隆的正中点,另一个是目标盏开口平面的中心点;第二个“两”是指两步进针,第一步是从皮肤穿刺点至肾皮质附近,根据穿刺路径与目标盏穹窿-盏颈轴线偏离情况判断皮肤选点是否合适,如果偏离较远则推针至皮肤外调整皮肤穿刺点位置,第二步是随肾脏在呼吸影响下的移动,穿刺进入肾集合系统,如果穿刺时机把握不当,则退针至肾包膜外,跟随肾脏上下移动选择恰当时机再次进针。实际操作中常存在肋骨位置及肾盏方向的不利影响,一般而言小角度偏离轴线方向不影响整体效果,但在允许情况下应尽可能贴近目标肾盏“穹窿-盏颈轴线”方向。该方法将PCNL通道建立的方法系统化和理论化,可以帮助快速完成学习曲线,且不需要特殊的设备,在一般超声下即可实现精准穿刺和通道建立,便于推广[15]。

图1 “两-两穿刺法”有助于实现目标肾盏“穹窿-盏颈轴线”方向穿刺进入集合系统
4 融合肾锥体
通常认为肾锥体是肾实质内相对乏血管的区域。实际上,在使用肾脏增强CT或多普勒超声检查的过程中,我们经常发现人体肾脏中有两种不同类型的肾锥体,即正常肾锥体(normal renal pyramid,NRP)和融合肾锥体(fused kidney pyramid,FRP)。 NRP与肾小盏呈一对一的解剖关系。FRP是指肾髓质层中相邻的两个或多个肾锥体发生融合后进入同一肾小盏,其内存在异位血管走形(图2)。FRP的出现会对以肾小盏轴线作为定位标记的穿刺引导方法带来挑战。以FRP对应的肾小盏轴线作为定位标记,穿刺路径经过的可能是FRP内部的血管变异区。这可能是一些看似很“精准”的穹隆穿刺却出血较多的解剖学原因。我们在猪肾和尸体肾标本中的研究表明,融合肾锥体广泛存在,尤其是上组和下组肾盏出现FRP的比例较高,中组肾盏相对较少,经FRP穿刺可能会增加血管损伤风险[16]。由于FRP的存在,肾锥体路径并不一定是安全的,但存在风险并不意味着损伤一定会发生,准确把握手术风险并及时调整以获得满意的手术效果是建立安全通道的关键[17]。
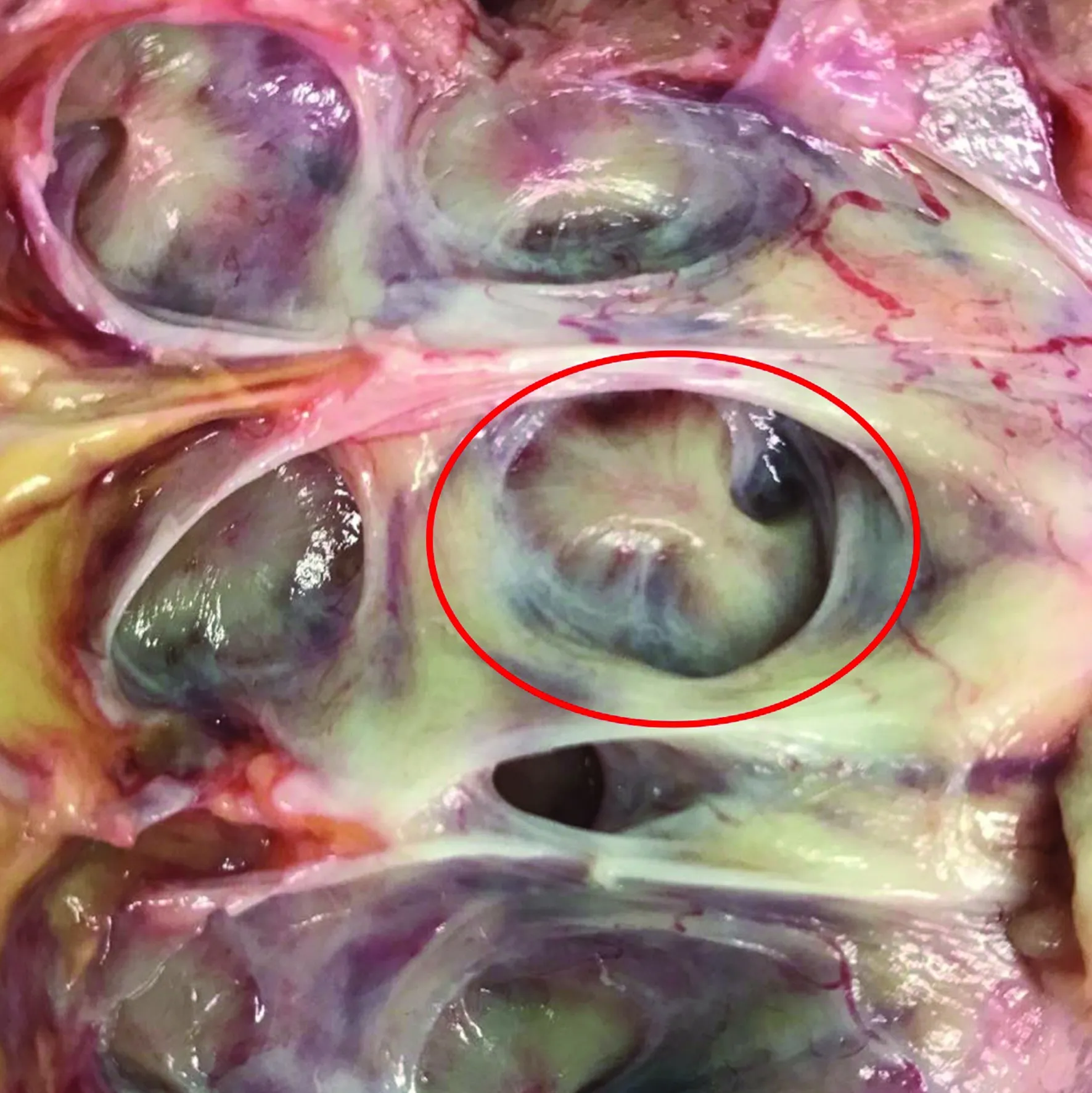
图2 融合肾锥体解剖图
融合肾锥体作为一种解剖变异广泛存在,在PCNL手术中就不可避免会遇到经融合肾锥体穿刺建立通道的情况。肾脏增强CT扫描皮质期可以清楚地显示FRP,这有助于术前规划安全的穿刺路径。实际上,解剖学意义上的FRP很难仅通过普通超声来识别,术中应用多普勒超声则可较准确地识别分布在FRP中的异位血管[18]。执行术前影像检查如肾脏增强CT,并在术中进行系统的超声检查以评估目标肾盏与肾内血管解剖之间的关系,这将有助于建立更加安全的PCNL通道。
5 影像融合及人工智能与PCNL通道建立
近年来,多种医学图像融合技术在临床诊疗中的应用范围越来越广,相关设备也层出不穷,极大促进了前沿医学影像技术在临床中的应用与转化,其中“高精度”和“全自动”是医学影像融合技术发展的两个重要方向。PCNL相关CT-US融合成像技术具有很大的发展潜力,理论上利用术前高精度CT图像与术中实时超声进行多模态CT-US自动配准融合,能够实现术中实时定位规划精准的穿刺路径。即便如此,目前CT-US多维影像融合仍然处于起步阶段,精度及实用性尚无法取得令人满意的效果,如何实现精准实时多维融合成像并提供智能化操作是突破瓶颈的关键所在。
实时精准多维CT-US融合图像的获取、识别、分析及处理是融合影像技术发展的主要难题之一,人工智能在这方面拥有无可比拟的深度挖掘能力。未来我们将围绕PCNL实时CT-US多维智能融合成像及人工智能规划体系这一核心问题开展工作,可分三步执行。首先,在基于PCNL通道建立解剖学研究的基础上实现CT影像随超声实时扫描图像的同步显示,提高PCNL穿刺的精准性;其次,通过3D技术与虚拟现实技术实现术中CT-US多维图像实时智能配准与融合,更为直观地显示穿刺路径的状态;最后,将深度学习和人工智能等技术应用于规划最佳的PCNL穿刺路径,突破关键技术难题,以期实现PCNL技术的真正可视化及标准化,从而达到安全与高效。

