2例胸膜肺母细胞瘤的临床病理观察
龙 倩,王悬峰,肖 海
(1. 赣南医学院2019级硕士研究生;2. 赣南医学院2018级硕士研究生;3. 赣南医学院第一附属医院,江西 赣州 341000)
胸膜肺母细胞瘤(pleuro pulmonary blastoma,PPB)主要发生在小儿肺部、纵膈及胸部,是一种少见的肺间叶组织恶性肿瘤,具有家族发病倾向[1],肿瘤发生进展较快,恶性程度较高,早期不易明确诊断。1988 年首先由MANIVEL 等[2]提出这种与传统的成人型双相上皮基质形态不同的肺母细胞瘤,1999 年被WHO 确立为是一个独立于经典肺母细胞瘤以外的病种[3],在2004 年WHO 会议上将其归为肺间叶性恶性肿瘤。本文报道2 例PPB,并通过相关文献的复习,进一步了解其临床病理学特征、诊断与鉴别诊断,帮助临床加深此病的印象。
1 资料与方法
1.1 临床资料收集赣南医学院第一附属医院2015 年12 月至2018 年6 月间手术摘除并经病理科证实的胸膜肺母细胞瘤2例。病例1:男性,6岁1个月,因喘息气急,腹部疼痛6 小时余,呕吐灰褐色血性液体1 次入院。CT 示右侧胸腔占位,其内可见约97.7 mm×160.6 mm 大小的团块状软组织密度影,边界不清,其内见片状高密度影,部分区域见灶状钙化影及气体密度影,占位效应明显。病例2:女性,3 岁8 个月,因胸闷、胸痛1 周余入院。胸部CT示左侧前胸壁见多发团块状软组织肿块影向肺内突出,形态不规则,最大者约25 mm×28 mm,增强扫描呈中度不均匀强化,局部胸腔可见巨大囊腔影,内见气液平面(图1)。
1.2 方法手术切除标本用4%中性甲醛缓冲溶液固定后,经取材、脱水固定、石蜡包埋、切片、HE染色,显微镜下观察。免疫组化染色采用EnVision法。所用抗体EMA、CK、CK19、CD117、CD99、S-100、Vimentin、MSA、Desmin、MyoD1、Ki-67等及试剂盒均购自福州迈新生物技术开发有限公司,均按照说明书步骤及要求进行操作。
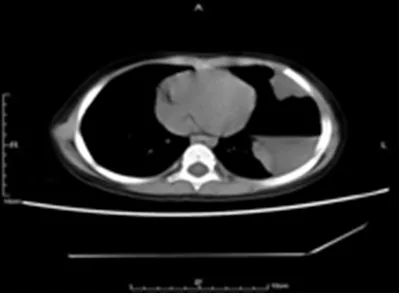
图1 病例2胸部CT图
2 结 果
2.1 巨检病例1送检物为部分切除肺组织,大小15 cm×10 cm×7 cm,表面见面积为9 cm×6 cm 的破溃区,内可见血凝块,切面见一直径为4 cm 囊腔,内为灰褐色胶冻样物。病例2送检物为灰白灰褐色囊实性组织(图2),大小8 cm×8 cm×2 cm,囊壁厚0.2~0.4 cm,囊内壁光滑,内见丰富淡黄色透亮液体,实性区域大小5 cm×3 cm×2 cm,切面灰白质软,呈鱼肉样。
2.2 镜检肿瘤组织镜下呈囊实性,其中病例1以囊腔和腺样结构为主。部分囊壁被覆纤毛柱状上皮,肿瘤细胞部分区域呈巢团状排列(图3A),部分区域细胞排列疏松,部分区域细胞排列致密,瘤细胞呈短梭形、卵圆形,胞质较少,核深染,部分瘤细胞呈星芒状。
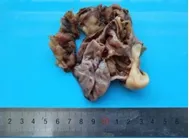
图2 病例2 肿物大体形态
2.3 免疫表型病例1:肿瘤细胞Vimentin(+),CD99(+),Ki-67(50%+),其余EMA、CK、S-100、MSA、Desmin、MyoD1 均(-)。病例2:肿瘤细胞Vimentin(+)、Desmin(+)(图3B)、CD99(部分+)和CD56(+)(图3C),CD34(血管+),Bcl-2(+/-),Ki-67(80%+)(图3D),EMA、CK、S-100、CR、CK7、CK19、M-SMA、CD117、TTF-1、CgA和Syn均(-)。
2.4 病理诊断胸膜肺母细胞瘤。
2.5 随访病例1 患儿在手术切除3 个月后复发,患者家属自行出院后失访。病例2患儿出院后情况良好继续随访中。
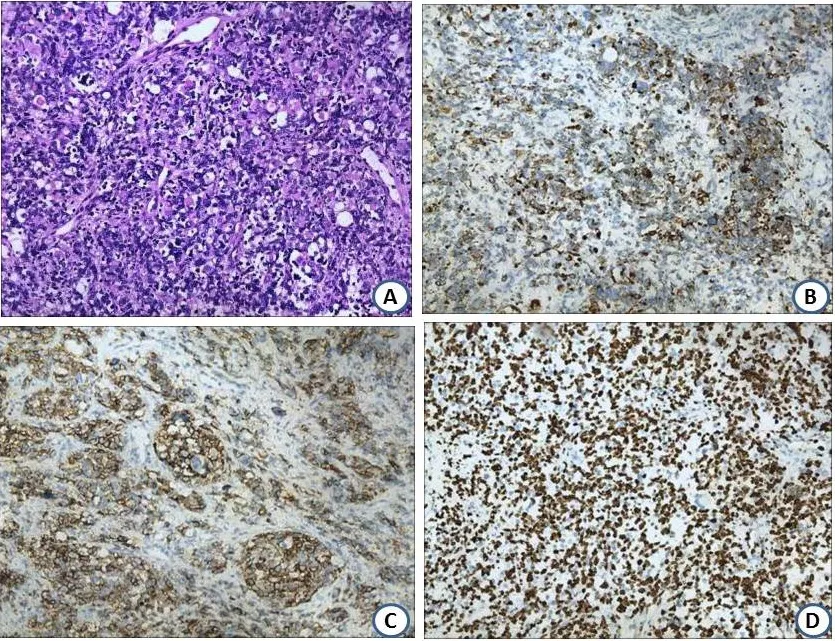
图3 病理组织学检查结果
3 讨 论
PPB 常表现为肺和/或胸膜肿物,其主要由原始细胞组成,具有混合样和/或肉瘤样外观。好发于6岁以下儿童,12 岁以上人群少见[4],有家族发病倾向,恶性程度高,侵袭性强,常表现为咳嗽、胸闷、发热等非特异性症状,抗感染,抗病毒治疗无明显效果,易被临床误诊。影像学显示PPB 多呈孤立性病灶,境界清楚、体积较大,Ⅰ型PPB 常为局限性囊肿,Ⅱ型呈现囊实性混杂占位性病变,有时可见边界不清,密度不均软组织肿块等,而Ⅲ型则为完全实性占位性病变,均可伴同侧胸膜增厚,肿瘤压迫致使同侧肺不张。而在本次报道的病例中,肿瘤均呈现囊实性混杂占位性病变,这与以往报道的Ⅱ型PPB 相符。总的来说PPB 影像学表现形态多样,其发生可能与肺先天性囊性腺瘤样畸形(congenital cystic adenomatoid malformation,CCAM)有 一 定联系[5]。
3.1 病理学特征
3.1.1 巨检与影像学表现相似,PPB 也具有3 种不同的组织学分型。Ⅰ型PPB 为多房囊性组织,囊壁较薄,其内可见丰富的淡黄色透亮液体;Ⅱ型PPB为囊实性肿物,囊性区为节段性斑样增厚的囊壁或内附大量柔软结节样组织的内壁,囊内含暗红色血液,实性区切面灰白质软,呈鱼肉样;Ⅲ型PPB 为灰白灰褐色实性肿物,与Ⅱ型实性组织部分相似,切面灰白质软、鱼肉样,且在少数病例中可见肿瘤组织有出血坏死现象。
3.1.2 镜检PPB 镜下可有3 种形态:Ⅰ型:多囊型,表现为囊壁内衬以成熟的呼吸道上皮细胞,上皮无异型性,但在上皮下可见呈“颗粒层”样分布的原始间叶细胞,肿瘤细胞小而圆,有时可有向横纹肌母细胞分化现象。在光镜下有时可见坏死、玻璃样变性或形成含铁血黄素细胞的囊壁区域,此为退行性变现象,这可能与Ⅰ型PPB 预后较好有关。Ⅱ型:多囊伴实性结节型,表现为既有囊性结构,局部又有实性区域,其囊性结构与Ⅰ型PPB 相似,成熟的呼吸道上皮细胞下紧密分布着原始间叶细胞,而实性区域由不成熟的圆形或梭形细胞组成,可伴有不同分化方向的间叶组织,如胚胎性横纹肌肉瘤、软骨肉瘤、纤维肉瘤等或者这些肿瘤的混合成分。本次报道的病例中,肿瘤囊壁可见纤毛柱状上皮细胞,部分区域可见瘤细胞呈短梭形、卵圆形,胞质较少,且核深染。Ⅲ型:实体型,肿瘤组织可见丰富的不成熟的间叶细胞,与Ⅱ型的实性区域无本质区别,但没有明显囊性结构,在光镜下局部可见出血坏死。随着病情的发展或手术切除不完全,Ⅰ型PPB可向Ⅱ型或Ⅲ型PPB发展、转化,由多囊性逐渐转变为囊实性或实性,平均转化时间为2~6年,这可能与间叶细胞过度增殖、分化,形成囊实性或实性结构有关。
3.1.3 免疫表型目前,PPB 在免疫组化中,主要通过原始间叶细胞不同的分化方向出现的相应免疫表型来确定其分子标记物。通常胚芽及其他原始间叶细胞Vimentin 表达阳性,向骨骼肌分化的间叶成分Desmin、Myogenin、SMA 表达呈阳性;向软骨分化的间叶成分S-100 表达呈阳性;向纤维组织细胞分化的间叶成分CD68 表达呈散在阳性。在一些病例中NSE、CgA 表达也会呈阳性,是因为其肿瘤上皮出现了原始内分泌功能。而病例1患儿肿瘤手术切除后复发可能与其主要为原始间叶细胞分子标记物表达阳性、分化程度较低有一定关系。
3.1.4 分子遗传学在大多数早期病变病例中,8号染色体增加可能是该病唯一的遗传异常。RONALD 等[6]通过比较基因组杂交和荧光原位杂交分析了5 例PPB 患者的遗传改变,比较基因组杂交鉴定了所有PPB 的基因畸变。最常见的DNA 增殖异常在于8q11-22.2(4例)和20q(2例),通过荧光原位杂交证实了8 号染色体的增加,每个细胞核检测到多达5 个增殖的8 号染色体着丝粒。VARGAS等[7]通过比较研究11 例CCAM 患者和2 例PPB 患者,发现PPB 的发生可能与p53 突变有关[8]。最近还有研究发现,所有具有家族史的PPB 儿童都携带了1种变异的DICER1基因,这种异常的基因会抑制附近细胞的信号转导,并引起这些细胞转变成肿瘤细胞,但是这种具有变异DICER1 基因的细胞自身却不会转化为肿瘤细胞[4,9]。
3.2 鉴别诊断PPB 是一种可向多种方向分化的侵袭性肿瘤,根据其发生部位及组织学形态,不同分型的PPB 需与不同疾病相鉴别。首先,Ⅰ型PPB需要与CCAM 相鉴别,Ⅰ型CCAM 和Ⅰ型PPB 在组织学改变上有部分相似,如存在大的厚壁囊腔,囊腔内衬假复层纤毛柱状上皮,厚壁周围有平滑肌和弹力组织[10]。而存在大的厚壁囊腔、囊腔内衬假复层纤毛柱状上皮及后壁周围有平滑肌和弹力组织,这些结构与原始间叶细胞分布比较局限的Ⅰ型PPB之间区别较为困难。但Ⅰ型PPB 常伴有原始间叶细胞分化,如横纹肌母细胞样分化、脂肪样分化,肿瘤细胞常有核型异常,免疫组化p53阳性等,可从这些方面加以鉴别。其次,Ⅱ、Ⅲ型PPB 原始间叶细胞因具有多种分化方向,需与不同的肿瘤相鉴别:⑴ 炎性肌纤维母细胞瘤(Inflammatory Myofibrobalstic Tumor,IMT),IMT 常发生于儿童胸膜,常见为胸部肿物、发热、疼痛等与PPB 相似的非特异性临床表现。但其梭形细胞束状或旋涡状排列的肿瘤组织周围有水肿性黏液样背景,且肿瘤细胞具有类似于平滑肌细胞的细长的丰满核[11]。光镜下偶可见到呈现黏液水肿的间质。⑵经典型肺母细胞瘤(Pulmonary blastoma,PB),与PPB 主要发生在小儿患者不同,PB在各个年龄阶层均有案例报道,但其常见于30~50岁的成年人,约有20%发生于20 岁以下,女性患者略多于男性,分为双向型和上皮型。双向型PB 由恶性原始上皮成分和原始间叶成分共同构成,单层立方状上皮细胞,散在分布于幼稚间叶细胞中,呈管腔样排列,多见间叶成分,细胞为圆形或短梭形,可有黏液样变;也有少数病例间叶成分多向分化,其中可见肉瘤样成分和/或混合性成分,此型常与PPB 难鉴别。但这两种类型的PB中均可见恶性的原始上皮细胞,与高分化的胎儿型肺腺癌的上皮细胞类似,而PPB 中的上皮细胞则是正常形态的呼吸道上皮。⑶肉瘤样间皮瘤(Sarcomatoidmesothelioma,SM),SM 的细胞成分较单一,主要由梭形细胞组成,呈长条束状、交织状或鱼骨样排列,细胞之间可见多少不等的胶原纤维[12]。但一般难以发现PPB 中常有的原始间叶细胞及横纹肌母细胞样成分,免疫表型中Vimentin、钙结合蛋白抗体(Calretinin)、间皮细胞抗体(Mesothelial cell,MC)阳性。⑷滑膜肉瘤(Synovial sarcoma,SS),SS常发生于青年人,以肢体大型关节旁的深部软组织多见。镜下形态多样,具有向上皮和纤维双相分化的特点,间质血管丰富,常常可见血管外皮细胞瘤样结构,以及神经鞘瘤样的栅栏状结构[13],局部间质内可见钙化灶。肿瘤细胞通常同时表达EMA、CK和Vimentin,而EMA、CK 常呈散在阳性。⑸胚胎性横纹肌肉瘤(Embryonic rhabdomyosarcoma,ERMS),ERMS 与PPB 的发病年龄相似,主要发生于小儿和青少年,具有胚胎型骨骼肌分化的表型和生物学特征,常与有横纹肌母细胞分化的Ⅱ型和Ⅲ型PPB 相鉴别,但ERMS好发于鼻腔、女性生殖道等有腔隙的器官或组织间,且为单向性肌源性分化,无原始间叶细胞及软骨样成分。
3.3 治疗与预后目前,完整切除肿瘤组织是胸膜肺母细胞瘤的主要治疗手段之一,术后化疗也具有一定的治疗效果,主要的化疗方案为IVADo 方案(异环磷酰胺+长春新碱+阿霉素+放线菌素D)[14],若肿瘤出现复发或远处转移则可使用放射治疗。预后与肿瘤体积大小、包膜是否完整及分化程度有直接关系,据报道,肿瘤囊性成分越多预后越好。PPB 5 年生存率Ⅰ型为80%~85%,Ⅲ型为45%~50%,Ⅱ型介于两者之间[15],大多数PPB 复发时间常在随访期间的前2~3 年[16]。本文中病例1 患儿在手术切除3 个月后复发,患者家属放弃治疗,自行出院后失访。病例2患儿目前情况良好,继续随访中。

