肿瘤坏死因子α在大肠杆菌周质空间中的表达
武玉露,夏玲珍,王佳玲,成 骋,何冰芳,
(1. 南京工业大学 生物与制药工程学院,江苏 南京 211800; 2. 台州市中心医院(台州学院附属医院),浙江 台州 318000; 3. 南京工业大学 药学院,江苏 南京 211800)
肿瘤坏死因子α(TNFα)最初被鉴定为导致小鼠中可移植肿瘤快速坏死的因子,现在它被认为是参与先天免疫应答和炎症反应的多功能细胞因子[1-2]。TNFα发挥许多重要的生理和病理作用:TNFα通过与肿瘤细胞表面的TNFα受体结合而引起肿瘤细胞坏死和细胞凋亡;TNFα是急性和慢性系统性炎症反应的关键介质,TNFα不仅诱导其自身分泌,而且还刺激其他炎性细胞因子和趋化因子的产生[3]。此外,TNFα在自身免疫疾病中起重要作用,例如类风湿性关节炎、炎性肠病(包括克罗恩病和溃疡性结肠炎)、多发性硬化、系统性红斑狼疮和系统性硬化症[4]。TNFα已成为肿瘤发生,肿瘤增殖、侵袭和转移的重要危险因素,是癌症相关慢性炎症的关键中介。因此,TNFα是一种具有潜力的应用于抗肿瘤、抗病毒以及免疫调节的生物制剂[5-6]。大肠杆菌(E.coli)[7-10]、毕赤酵母(Pichiapastoris)[11]和中国仓鼠卵巢细胞(CHO)[12-13]等表达系统已经应用于重组TNFα的表达研究。在这些表达系统中,大肠杆菌是重组TNFα生产的主要宿主,因其具有遗传背景清晰、生长周期短、操作简便、培养成本低、表达系统成熟稳定等优势[14]。但外源蛋白在大肠杆菌细胞质中的表达存在一些问题:在细胞质中存在大量杂蛋白质而导致后续纯化工艺的复杂性与产量的降低[15];过表达可导致包涵体的形成[16],而包涵体体外复性可能会带入一些复性剂对活性的影响。
大肠杆菌的内外膜双层膜结构之间的区域即所谓的周质空间。E.coli的细胞周质中含有一系列氧化还原酶及二硫键异构酶,生物体独特的氧化还原环境有利于二硫键的正确形成,帮助蛋白正确折叠,提高活性蛋白的表达水平;与细胞质中相比,周质空间的蛋白酶活性更低,可减少目的蛋白的胞内降解从而使其稳定存在。利用定向释放技术释放周质蛋白,使细胞外膜破损而不损害细胞内膜,可减少宿主菌蛋白的污染,简化重组蛋白下游纯化工艺[15]。
在大肠杆菌中实现外源蛋白可溶性表达的常用工具和有效手段是融合标签技术,主要是将其与目的蛋白基因连接以介导目的蛋白的可溶性表达和纯化。本课题组筛选到来源于阿氏节杆菌(Arthrobacterarilaitensis)NJEM01的β-呋喃果糖苷酶(β-Ffase),该酶在大肠杆菌中能够高效分泌表达,N末端含有53个氨基酸残基组成的自身信号肽,具有强的折叠和分泌能力等特性。课题组前期工作中将其高度可溶且稳定的截短体开发成一种新型的融合标签Ffu,Cheng等[17]利用该融合标签融合一些难以表达的外源蛋白在大肠杆菌中实现可溶性表达甚至胞外表达。
本研究的目的是筛选几种融合标签Ffu与目标蛋白TNFα形成重组蛋白,介导TNFα分泌至大肠杆菌周质空间中。另选取两种常用的增溶性融合标签MBP和NusA用来评估Ffu标签的增溶效果;通过对诱导表达条件的优化来提高重组蛋白Ffu-TNFα的可溶性和产量,采用渗透压休克和溶菌酶法研究Ffu标签介导TNFα在大肠杆菌中异源表达的细胞定位,采用Western blotting和MTT 法检测重组蛋白Ffu-TNFα的抗原性和细胞毒活性,以期获得高效可溶性表达且具有生物活性的重组肿瘤坏死因子α。
1 材料与方法
1.1 材料
表达载体pFfu、表达菌株E.coliBL21(DE3)、小鼠成纤维癌细胞L929,何冰芳教授实验室保存。
各种内切酶、T4连接酶,TaKaRa公司;DNA回收、质粒提取试剂盒,Axygen公司;Anti-TNF alpha鼠源单抗,Proteintech(武汉)公司;HRP2羊抗鼠抗体,正能公司。
PCR引物及编码人TNFα的基因均由金唯智生物科技有限公司(苏州)合成。
1.2 方法
1.2.1 重组表达质粒的构建
以构建好的包含新型融合标签Ffu的质粒pFfu用于表达人源TNFα。将全基因合成的人源TNFα(构建在pUC57质粒中)作为模板进行PCR扩增。含有不同融合标签的质粒pFfu209和pFfu217用NdeⅠ和XhoⅠ进行双酶切,胶回收并纯化扩增后的目的片段及质粒载体基因片段,以T4 DNA连接酶16 ℃连接过夜。将连接产物转入宿主菌E.coliBL21(DE3)中,在含有卡那霉素(50 mg/mL)的LB琼脂平板上37 ℃培养过夜。随机挑取重组子进行菌落PCR验证,将阳性重组子测序。所涉及的相关实验操作方法参照文献[18]。
1.2.2 融合标签的选择及重组蛋白的诱导表达优化
将含有表达载体pFfu209-TNFα、pFfu217-TNFα的重组菌,接种至含有卡那霉素的LB培养基中,37 ℃、200 r/min培养12 h。以2%(体积分数)的接种量转接于新鲜含有卡那霉素的LB培养基中,37 ℃培养90 min,当OD600为0.6~0.8时加0.5 mmol/L IPTG,25 ℃诱导表达6 h。收集菌体,在1 mmol/L PMSF (phenylmethanesulfonyl fluoride)、20 mmol/L Tris-HCl缓冲(pH8.0)中超声破碎,用冷冻离心机(5424R型,Eppendorf公司)离心(12 000 r/min,20 min,4 ℃),收集破碎上清及破碎沉淀,SDS-PAGE分析表达结果。分析各标签对TNFα的增溶效果,选择表达效果较好的重组蛋白,分别从诱导剂浓度、诱导表达温度以及诱导时间上进行优化。分析重组蛋白的表达情况,以得到较优的表达条件。
1.2.3 重组蛋白的细胞定位
分别应用渗透压休克法和溶菌酶法定向释放大肠杆菌周质蛋白。渗透压休克法是参照文献[19]的方法将培养物分离成周质和细胞质部分。取1 mL发酵液12 000 r/min,离心2 min,得菌体;用1 mL高渗缓冲液(100 mmol/L Tris-HCl、10 mmol/L EDTA,质量分数20%的蔗糖,pH 9.0)重悬菌体,室温放置30 min,离心弃上清,再加入1 mL低渗缓冲液(20 mmol/L Tris-HCl,pH 8.0),冰上放置20 min,离心,所得上清即为周质蛋白。
溶菌酶法是根据French等[20]的方法将1 mL培养物以3 000g离心20 min,将沉淀重悬于1 mL破碎缓冲溶液(0.5 mg/mL的鸡蛋清溶菌酶、200 mmol/L Tris、500 mmol/L蔗糖、1 mmol/L EDTA,pH 8.0)中。混悬液冰上放置15 min,15 000g离心30 min,所得上清即为周质空间中的蛋白。
1.2.4 重组蛋白的纯化
通过软件ExPASY在线预测重组蛋白Ffu209-TNFα的理论pI值约为5.64,使用DEAE-sepharose FF柱联合AKTA Prime Plus System(GE Healthcare Life Science Inc.)进行阴离子交换色谱层析。选择pH为6.5的平衡缓冲与洗脱缓冲液。固相载体用平衡缓冲液(20 mmol/L Na2HPO4,pH 6.5)平衡,将5 mL蛋白样品以0.5 mL/min的流速加入,再平衡;洗脱缓冲液(20 mmol/L Na2HPO4、1 mol/L NaCl,pH 6.5)以1 mL/min的流速在不同NaCl浓度下进行梯度洗脱。收集各梯度浓度的洗脱液,进行12%SDS-PAGE电泳,确定目的蛋白洗脱时所需的盐浓度。透析法除盐,选用合适分子量的透析袋,20 mmol/L Tris-HCl(pH 8.0)作为置换缓冲,4℃透析过夜。BCA(bicinchoninic acid)法测定蛋白浓度。
1.2.5 Western blotting鉴定重组蛋白的免疫原性
将纯化得到的重组蛋白Ffu209-TNFα在12% SDS-PAGE 上分离,并转印到PVDF膜上。转印结束后将膜在5%脱脂牛奶中室温振摇封闭 1 h。将膜加到用封闭液稀释的抗TNFα一抗溶液中4 ℃孵育过夜,TBST (TBS+Tween)洗涤 3 遍(每次10 min)后加入 HRP 标记的二抗(用封闭液稀释),室温孵育 2 h,TBST 洗涤3遍(每次10 min)。将膜上水分吸干,加入显色液,用增强化学发光(ECL)检测系统(GE Healthcare Life Science Inc)显影。
1.2.6 重组蛋白Ffu209-TNFα的体外细胞毒活性
L929细胞于DMEM-10%(体积分数)FBS,37 ℃,5% CO2培养箱中贴壁培养。将 L929 细胞传于96孔板(105个/孔),37 ℃、5% CO2贴壁生长24 h后小心弃培养基,每孔加入100 mL待测样品,样品溶于含放线菌素D的DMEM-10%FBS(放线菌素D的终质量浓度为1 μg/mL),每个样品设5个平行点,37 ℃、5% CO2继续培养18 h。每孔加入20 μL MTT (5 mg/mL),继续培养 4 h。小心弃上清液,每孔加入150 μL二甲基亚砜(DMSO),摇床上低速混匀。测定490 nm处的A490值。细胞存活率计算见式(1)。
细胞存活率=[(A490Ffu-TNFα-A490空白)/
(A490对照-A490空白)]×100%
(1)
2 结果与讨论
2.1 融合蛋白重组质粒的构建
为了设计合适片段长度的Ffu标签利于融合表达载体的构建,不同长度Ffase截短体的可溶性进行了预测使用了修正后的Wilkinson和Harrison法[17],根据Ffase截短体的氨基酸序列、蛋白分子量和等电点信息,预测了相应的Ffase截短体蛋白可溶性数据。基于原子经济性原则,结合初步的截短体可溶性验证实验结果,选择了分子量大小适中,可溶性高的β-FFase截短体,即Ffu209和Ffu217,融合标签Ffu209、Ffu217的部分特征分析见表1。由表1可知:截短体Ffu209和Ffu217的亲水性平均值(GRAVY)较低,表明它们具有较高的亲水性。MBP和NusA是最常用来提高融合蛋白溶解度且增溶性较好的融合标签。相比较于MBP和NusA而言,Ffu融合标签具有分子量适中、亲水性较强并且自身具有极好的可溶性且稳定等特性。由此可见Ffu标签的这些特征使其有望开发成很有潜力的融合标签。本研究中,选择MBP和NusA作为对照组来比较Ffu融合标签的增溶能力。

表1 Ffu融合标签的特征
将全基因合成的人源TNFα与含有不同融合标签的质粒pFfu209、pFfu217、pMAL-MBP和pET/NusA酶切后,用T4 DNA连接酶连接,得到重组质粒pFfu209-TNFα、pFfu217-TNFα、pMAL-MBP-TNFα和pET/NusA-TNFα,进行PCR鉴定,结果见图1。由图1可知:pFfu重组子基因长度分别是1 400、1 500 bp左右,与理论值一致;pMAL-MBP-TNFα和pET/NusA-TNFα使用对应引物显示目的基因长度为700 bp左右。重组子的阳性单菌落经测序后结果显示目的基因成功地克隆到表达载体中。结果表明成功构建了融合表达TNFα的重组菌E.coliBL21(DE3)/pFfu209-TNFα、E.coliBL21(DE3)/pFfu217-TNFα、E.coliBL21(DE3)/pMAL-MBP-TNFα和E.coliBL21(DE3)/pET/NusA-TNFα。

(a):1~3—重组子pFfu209-TNFα,4~6—重组子pFfu217-TNFα;(b):1~3—重组子pMAL-MBP-TNFα,4~6—重组子pET/NusA-TNFα。M—标准DNA图1 重组子菌落的鉴定Fig.1 Identification of recombinant colonies
2.2 重组融合蛋白的选择
pFfu209-TNFα、pFfu217-TNFα、pMAL-MBP-TNFα和pET/NusA-TNFα重组表达载体,经0.5 mmol/L IPTG诱导、25 ℃培养6 h后分别分析细胞破碎液上清液(可溶性)以及细胞破碎液沉淀(包涵体),结果如图2所示。

M—标准蛋白;S—可溶性组分;ib—包涵体沉淀图2 融合标签对TNFα在大肠杆菌中表达的影响Fig.2 Effect of fusion tags on the expression of TNFα in E. coli
由图2可见:所选的2种Ffu融合标签分别介导TNFα在大肠杆菌中成功表达且不同程度地提高了TNFα的可溶性表达;相对而言,Ffu209标签对TNFα的增溶效果较好且表达量高,几乎没有包涵体产生;MBP标签在提高融合蛋白的可溶性同时会产生较多的包涵体;NusA标签在提高TNFα总体表达水平上也较有效。然而,分子量较大的融合标签对细胞产生更大的代谢负担,而且可能会导致对融合蛋白可溶性和总体表达量过于乐观的评估[21-22]。NusA标签分子量大小为5.45×104,Ffu209标签的分子量为1.76×104,约为NusA分子量的1/3。因此,Ffu209标签对细胞的代谢负担远低于NusA。同时,考虑到原子经济学原则,故选取Ffu209作为融合标签进行诱导表达条件的优化以得到更多的可溶性重组蛋白。
2.3 重组蛋白Ffu209-TNFα的诱导表达优化
对诱导温度、IPTG的浓度、IPTG与乳糖联合诱导以及诱导时间等条件进行优化,结果如图3所示。由图3可知:重组蛋白Ffu209-TNFα在20 ℃、IPTG浓度为0.3 mmol/L、乳糖为1 g/L条件下联合诱导,发酵24 h时,表达效果较优。
SDS-PAGE分析该条件下重组蛋白的表达情况,结果见图4。由图4可知:利用灰度扫描计算重组蛋白Ffu209-TNFα占总蛋白表达量的76%左右,其中可溶性组分占89%左右。此外,还可发现破碎上清与破碎沉淀中的目标蛋白存在分子量上的高度差,这可能是由于融合标签Ffu的N末端含有一段53个氨基酸残基的自身信号肽,在重组蛋白分泌至周质空间表达时被剪切,由此产生了分子量的差异。
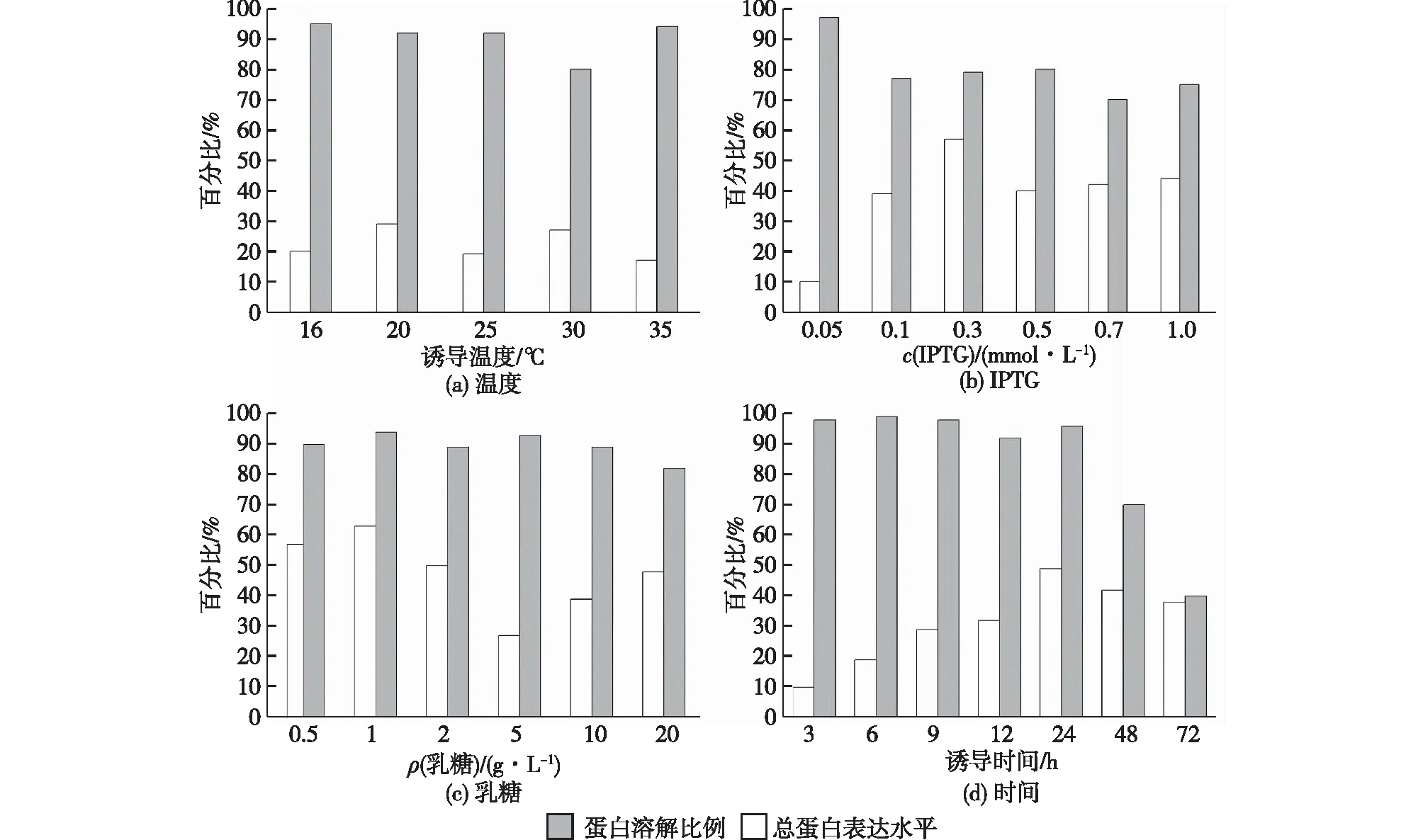
图3 不同诱导条件对应重组蛋白Ffu209-TNFα的表达量和可溶性比例Fig.3 Different induction conditions correspond to the expression level and soluble ratio of the recombinant protein Ffu209-TNFα
2.4 重组蛋白Ffu209-TNFα的细胞定位
分别采用渗透压休克和溶菌酶法定向释放大肠杆菌周质空间蛋白,并以超声破碎样品为对照,结果见图5。由图5可知:渗透压休克法和溶菌酶法均可释放出目标蛋白,证明融合标签Ffu可以帮助TNFα实现可溶性甚至周质空间分泌表达。两种方法提取的周质空间蛋白中杂蛋白数量比超声破碎中的杂蛋白低了一个数量级,并且溶菌酶法提取的杂蛋白量更少,故在后续大量释放周质蛋白选取溶菌酶法,溶菌酶可以在下一步纯化中除去。由此可知,使用新型融合标签Ffu可以基于质粒pET的表达系统将TNFα分泌至大肠杆菌周质中。TNFα含有2个半胱氨酸可以形成1个分子内二硫键,周质空间中含有一系列氧化还原酶及二硫键异构酶可以帮助二硫键正确折叠而更易获得有生物活性的重组蛋白。

M—标准蛋白;1—0.3 mmol/LIPTG诱导24 h后超声破碎上清;2—超声破碎沉淀图4 SDS-PAGE分析重组蛋白在大肠杆菌中表达Fig.4 Analysis of recombinant protein expression in Escherichia coli by SDS-PAGE

M—标准蛋白;1—超声破碎上清;2—溶菌酶法;3—渗透压休克法图5 SDS-PAGE分析不同方法提取周质蛋白Fig.5 SDS-PAGE analysis of different methods for extracting periplasmic proteins
2.5 重组蛋白的纯化
将提取的周质空间蛋白在阴离子交换色谱层析柱中分离,利用不同浓度的NaCl进行梯度洗脱,当NaCl浓度为200 mmol/L时,目的蛋白被洗脱下来,结果如图6所示。由图6可知:获得电泳纯的重组融合蛋白Ffu209-TNFα,且灰度扫描得其纯度达95%左右。BCA法测定纯化后的重组蛋白浓度,计算得重组蛋白分泌到周质空间中的产量达12 mg/L。已有多种融合标签应用于帮助TNFα在大肠杆菌中高效表达,例如:Osaki等[7]构建了抗体-细胞因子融合蛋白(Ia1-TNFa),在大肠杆菌表达系统以可溶形式产生,产量达2 mg/L;Ma等[8]制备了由ACDCRGDCFCG肽融合TNFα组成的RGD-hTNFα,从大肠杆菌发酵菌体中获得约18 mg/L的RGD-hTNFα;Dai等[23]构建重组GST-TNFα融合蛋白原核表达载体,产量为0.466 mg/g。由此可见,融合标签Ffu可以帮助TNFα实现在大肠杆菌周质空间中以较高表达量来表达。

M—标准蛋白;1—周质蛋白;2—200 mmol/L NaCl的洗脱峰图6 SDS-PAGE分析阴离子交换色谱纯化周质中 重组Ffu209-TNFα Fig.6 SDS-PAGE analysis of recombinant Ffu209-TNFα in the periplasm by anion exchange chromatography
2.6 Western blotting鉴定重组蛋白的免疫原性
为了确认重组TNFα的性质,使用抗TNFα抗体进行蛋白质印迹分析,结果见图7。由图7可知:周质空间蛋白组分中及纯化洗脱峰中均有蛋白与抗TNFα抗体反应,显示的位置条带大小与重组蛋白Ffu209-TNFα的预期值一致,结果说明利用融合标签Ffu在大肠杆菌中实现了Ffu209-TNFα的周质空间分泌表达,且阴离子交换色谱成功纯化出重组Ffu209-TNFα。
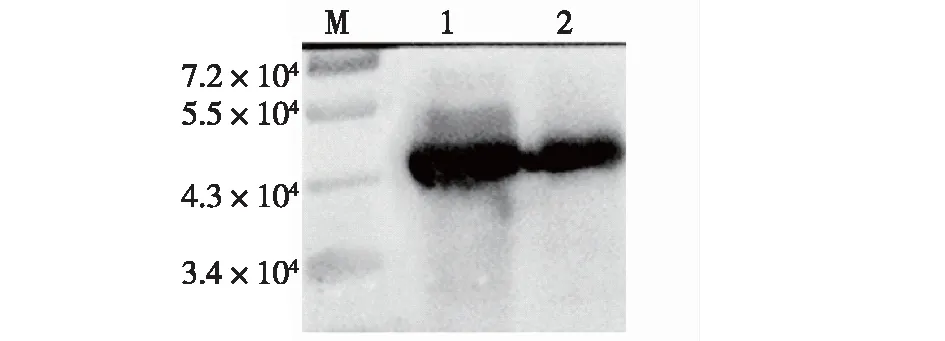
M—标准蛋白;1—周质组分Ffu209-TNFα;2—纯化后的Ffu209-TNFα图7 Western blotting鉴定重组蛋白Ffu209-TNFα的 免疫原性Fig.7 Immunogenicity of the recombinant protein Ffu209-TNFα was identified by Western blotting
2.7 重组蛋白Ffu209-TNFα的生物学活性
用L929小鼠成纤维细胞通过测定重组蛋白Ffu209-TNFα的体外细胞毒活性,结果见图8。以浓度值(以对数表示)作为自变量,细胞存活率作为因变量,并以50%的细胞毒活性作为活性单位(U),计算得重组Ffu209-TNFα的体外细胞毒活性为3.47×105U/mg。由图8可以看出:重组蛋白Ffu209-TNFα对L929细胞具有致死活性,并且致死率与Ffu209-TNFα浓度呈量效关系。在本研究中,周质TNFα是可溶的,且具有生物活性。因此,融合标签Ffu209对TNFα的活性不具有明显影响。Ma等[8]制备了由ACDCRGDCFCG肽融合人TNFα组成的RGD-hTNFhTNFα与RGD-hTNFα的体外比酶活分别为2.45×107和 4.15×107U/mg。Osaki等[7]构建了抗体-细胞因子融合蛋白(Ia1-TNFa),其生物活性比TNFα自身低7倍左右。Dai等[23]构建重组GST-TNFα融合蛋白原核表达载体,细胞毒活性为1.82×105U/mg。Tsukamoto等[24]使用Trx A硫氧还蛋白在大肠杆菌中表达TNFα重组蛋白,重组TNFα的EC50为0.19 pmol/L。尽管我们已经利用融合标签Ffu实现了TNFα在大肠杆菌周质空间中有活性的表达,但是与标准TNFα蛋白相比其活性有所降低,可能是融合标签的存在影响到目标蛋白的结构功能与生物活性。融合标签Ffu存在一定的局限性,标签分子量较大,对较小分子量的蛋白活性可能会有一定的影响。

图8 重组蛋白Ffu209-TNFα对L929的细胞毒活性(n=5)Fig.8 Cytotoxic activity of recombinant protein Ffu209-TNFα against L929 (n=5)
3 结论
利用新型标签Ffu得到了一个可以成功将TNFα高效可溶性表达分泌至大肠杆菌周质空间中的系统,经过诱导条件的优化,重组蛋白Ffu209-TNFα表达量占总蛋白表达量的76%左右,其中可溶性组分占89%左右,分泌至周质空间表达量达到12 mg/L。对重组蛋白的免疫原性及生物活性进行鉴定与检测,表明融合标签Ffu对周质的TNFα的正确折叠具有适当的促进作用。为一些生物活性蛋白,尤其是含二硫键的活性蛋白,在大肠杆菌周质空间表达提供了一个新的工具。

