发酵条件对毕赤酵母高密度表达地特胰岛素前体DesB30的影响
郑华亮,贾小峰,马鲁南,刘 忠,张贵民
(山东新时代药业有限公司 山东省蛋白类药物工程实验室,山东 临沂 273400)
2017年国际糖尿病联盟发布的第8版糖尿病概览数据显示,我国糖尿病(20~79岁)患病人数达到了1.14亿[1],糖尿病已成为继心血管疾病和癌症之后,严重危害我国人民健康的三大疾病之一[2]。人胰岛素分短效、中效和长效三类,目前市场上应用于临床的长效胰岛素有甘精胰岛素、地特胰岛素等。地特胰岛素由丹麦诺和诺德公司研制,于2004年在欧洲上市。地特胰岛素是第一个采用化学修饰方法获得的胰岛素类似物,即将天然人胰岛素分子B链上的第30位苏氨酸去掉,通过酰化反应在第29位赖氨酸上结合一个C14游离脂肪酸[3],C14游离脂肪酸可以与血液中的白蛋白结合,形成蛋白结合体,从而延长作用时间[4-5]。目前,国际市场仅有原研药诺和诺德上市,2019年销售收入15.4亿美元,国内地特胰岛素只有几家药企处于申报阶段,且普遍存在表达量低、表达的胰岛素前体容易形成包涵体等问题。
近年来,以低等真核生物酵母作为表达系统表达外源蛋白越来越被广泛研究和应用。与大肠杆菌相比,酵母表达的蛋白质可以进行翻译后加工、修饰以及合理的空间折叠,能有效克服大肠杆菌系统缺乏蛋白相关修饰的不足[6]。1983年,Wegner[7]为克服酿酒酵母的局限,开发了以毕赤酵母甲醇营养型酵母为代表的第二代酵母表达系统。毕赤酵母由于醇氧化酶(AoXl)基因的强启动子,特别适合于外源基因的调控表达[8],采用这个系统成功表达了200种以上蛋白,包括病毒、细菌、真菌、动植物和某些人源蛋白[9]。在甲醇毕赤酵母表达系统中,受不同蛋白氨基酸组成以及空间结构差异等因素影响,其最优表达条件不同,在发酵过程中,pH、温度、溶氧、甲醇诱导量和诱导前菌体浓度都可能对蛋白表达有很大影响[10-13]。
因此,本文中,笔者尝试采用酵母表达系统分泌表达胰岛素前体,以带有编码地特胰岛素前体DesB30基因的甲醇营养型重组毕赤酵母为实验菌株,使用5 L玻璃发酵罐进行培养条件的优化,考察pH、温度、诱导前菌体浓度和甲醇流加速度对地特胰岛素前体DesB30蛋白表达的影响,拟通过优化发酵条件得到高表达可溶性的目的蛋白。
1 材料与方法
1.1 菌株
毕氏酵母(Pichiapastoris)GS115菌株,载体为pPIC9K(分泌性表达载体),信号肽来自酿酒酵母的α-杂交因子。重组人胰岛素源类似物HMPIDesB30基因根据酵母密码子的偏好性人工合成。按照Multi-copyPichiaexpression Ki(Version B)经SalⅠ酶切,用电转化方法将重组质粒HMPIDesB30/pPIC9K转入毕赤酵母GS115中,随后通过组氨酸缺陷培养基以及G418抗性培养基筛选具有外源基因高拷贝数的菌株,整个实验操作参考毕赤酵母表达实验手册。构建的菌株保存于山东新时代药业有限公司。
1.2 培养基
YPD种子培养基(g/L):葡萄糖20.0,蛋白胨20.0,酵母粉10.0。
发酵罐培养基(BSM)(1 L):85%H3PO426.7 mL,CaSO40.93 g,K2SO418.2 g,MgSO4·7H2O 14.9 g,KOH 4.13 g,甘油40 g,PTM1微量元素溶液12 mL[14]。
补料培养基:质量分数50%甘油,每1 000 mL含有12 mL PTM1微量元素溶液。
PTM1(1 L):CuSO4·5H2O 6.0 g,KI 0.08 g,MnSO4·H2O 3.0 g,Na2MoO40.2 g,H3BO30.02 g,CoCl20.5 g,ZnSO420.0 g,FeSO4·7H2O 65.0 g,VH(生物素)0.2 g,H2SO45.0 mL。
1.3 方法
1.3.1 摇瓶种子培养
从平板上挑取单菌落接种至100 mL YPD培养基的摇瓶中,30 ℃、200 r/min培养过夜至OD600为5.0左右。
1.3.2 发酵罐培养
将摇瓶种子液按照体积分数4%接种量接入到装有2 L发酵罐培养基的五联装5 L玻璃发酵罐中,每升培养基添加4.35 mL PTM1微量元素溶液,用氨水调初始pH至5.0。当甘油耗尽,溶氧快速回升到80%以上后,开始补加质量分数50%甘油,流加速度为18.15 mL/(h·L)(以初始发酵体积计)。甘油补料结束后,待溶氧快速回升后调到合适的pH和诱导温度。随后补加甲醇进行诱导。开始保持低速流加甲醇,之后缓慢提高甲醇补加速度,根据Invitrogen公司提供的方法,补加速度最终提升至10.9 mL/(h·L),并保持至发酵结束,发酵时间为128 h左右。通过调节转速、罐压、空气流量使溶氧大于10%。甲醇诱导期间取样检测,测定菌体浓度(以菌体湿质量表示),离心收集上清液并进行蛋白浓度测定。在此基础上分别对诱导pH、诱导温度、诱导前菌体质量浓度和甲醇补速进行单因素实验优化。
1.3.3 细胞湿质量
取40 mL发酵液,12 000 r/min 离心10 min,去上清液,称菌体质量。
1.3.4 目的蛋白DesB30浓度测定
发酵液12 000 r/min离心,上清液用盐酸调pH至4.0,经0.45 μm膜过滤后进行HPLC(岛津公司)分析,色谱柱为C18。流动相A(5%乙睛,0.1%三氟乙酸),流动相B(95%乙睛,0.1%三氟乙酸)。洗脱条件:先用流动相A平衡柱子,洗脱条件为30 min流动相B从0~100%,流速1 mL/min,柱温40 ℃[15]。蛋白含量计算见式(1)。
发酵液蛋白浓度=发酵液上清液峰面积/标准品峰面积×标准品蛋白浓度
(1)
2 结果与讨论
2.1 pH对DesB30表达的影响
由于毕赤酵母可耐受较宽的pH(pH 3.0~7.0),因此可以通过优化 pH 条件来提高目的蛋白的表达量。为了确定DesB30表达最适的pH条件,在诱导温度为25 ℃、诱导前菌体质量浓度280 g/L培养条件下,选择pH 5.5、6.0、6.5和7.0不同梯度进行优化,结果如图1所示。由图1(a)发酵结果可知:在不同pH条件下,诱导前期和诱导后期的生物量相差不大,生长趋势几乎无差别,说明pH对菌体的生长影响较小,发酵后期湿菌体质量浓度均能达到500 g/L左右。

图1 不同pH对菌体湿质量和DesB30表达的影响Fig.1 Effects of pH on wet weight of bacteria and DesB30
在不同pH诱导条件下,诱导24 h后,经HPLC检测,DesB30已有少量表达。在pH 6.0和pH 6.5条件下,DesB30表达相差不大,具有较高的表达量。与pH 6.0和pH 6.5条件下的表达量相比,pH 5.5和pH 7.0条件下的表达量在诱导24 h后至发酵结束这一阶段明显降低(图1(b))。中性条件pH 7.0并不是蛋白表达的最适条件,因此,DesB30在中性条件下表达量很低,DesB30的等电点pI为5.5,在pH 5.5的条件下,DesB30的表达量偏低,可能是由于DesB30在等电点附近时目的蛋白溶解度较低,一部分蛋白分泌到上清液后沉淀出来造成单位偏低。综上,DesB30最适的表达pH为6.0~6.5,偏中性或者偏酸性都不利于目的蛋白的表达。
2.2 诱导温度对DesB30表达的影响
通过pH单因素实验发现DesB30最适表达条件为pH 6.0~6.5。选取诱导表达pH为6.0、诱导前菌体质量浓度280 g/L条件下,分别设置22、24、26、28和30 ℃这5个温度梯度,以考察温度对酵母工程菌的生长状况和DesB30表达量的影响,结果如图2所示。由图2可知:在22、24和26 ℃这3个温度条件下,菌体生长状态相似,生物量相差不大;在诱导48 h前,28和30 ℃这2个温度条件下的菌体生长状态与22、24和26 ℃这3个温度条件下的生长状态相似,但是在48 h以后,28和30 ℃这2个温度条件下的菌体生长明显变慢,并且96 h以后上清液变混浊,推测是在较高的温度条件下菌体生长过快,在诱导过程中由于受到甲醇补速的限制,碳源供应不足,影响了工程菌的生长,造成菌体部分自溶。
在诱导60 h前,在22、24、26和28 ℃条件下,DesB30表达量相差不大。诱导60 h后,22、24和26 ℃条件下的DesB30表达量明显更高,到发酵后期,3个温度条件下表达量相差不大。在22 ℃条件下,诱导表达104 h后表达量达到最大,而在24和26 ℃条件下,诱导表达128 h后表达量还有继续增长的趋势。考虑到发酵过程中较低的温度不易控制,选取26 ℃作为最合适的诱导温度。
DesB30为分泌性表达,在28和30 ℃条件下诱导时,由于菌体部分自溶,蛋白酶释放到上清液中,造成蛋白降解。因此,过高的温度不利于蛋白的积累,而过低的温度又影响了菌体的生长,随着发酵过程的进行,甲醇容易积累,毒害菌体,后期培养条件不再适合菌体发酵,也不利于蛋白的积累,因此在实际发酵中尽量控制合适的温度。
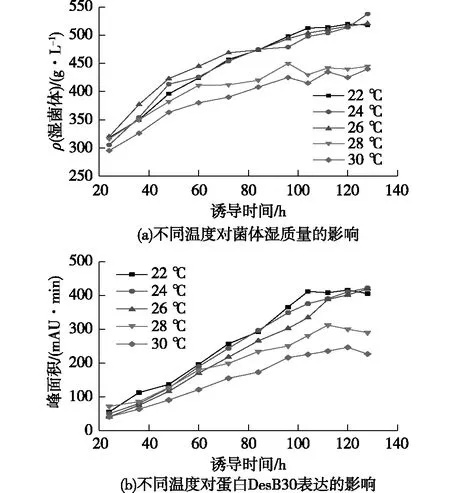
图2 不同温度对菌体湿质量和DesB30 表达的影响Fig.2 Effects of temperature on wet weight of bacteria and DesB30
2.3 诱导前菌体浓度对DesB30表达的影响
为了考察诱导前菌体浓度对DesB30表达的影响,在诱导pH为6.0、诱导温度26 ℃条件下,笔者选取了诱导前菌体质量浓度分别为120、200和280 g/L 3个条件,结果如图3所示。由图3可知:诱导前菌体质量浓度为120 g/L时,诱导后菌体质量浓度相比于诱导前200和280 g/L的菌体质量浓度一直偏小。这表明诱导前菌体浓度太低的情况下,在相同甲醇补速条件下,甲醇浓度偏高,对菌体的毒害作用影响了菌体生长,进而影响了DesB30的表达。当诱导前菌体质量浓度200 g/L时,诱导之后生长比280 g/L时的更快,这可能是诱导前太高的菌体浓度,而甲醇补料不足导致碳源不足,使菌体生长受限,蛋白表达受影响;到后期菌体进入平台期,两者菌体浓度相差不大。在诱导表达50 h前,3个诱导条件下,DesB30的表达区别不大;但在诱导表达60 h后,诱导前菌体质量浓度200 g/L时的DesB30表达量比另外两个条件下的表达量更大,这表明合适的诱导前菌体浓度对蛋白表达具有很大影响。由此确定200 g/L为最适的诱导前菌体质量浓度。
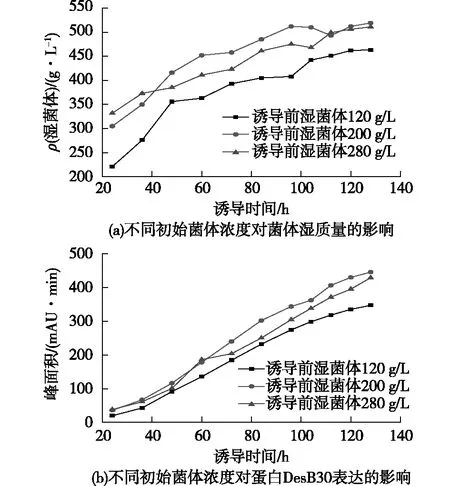
图3 不同初始菌体浓度对菌体湿质量和DesB30 表达的影响Fig.3 Effects of initial concentration on wet weight of bacteria and DesB30
2.4 甲醇流加速度对DesB30表达的影响
在诱导pH为6.0、诱导温度26℃、诱导前菌体质量浓度200 g/L条件下,继续考察甲醇流加补速对DesB30表达的影响。根据Invitrogen公司提供的方法,选取甲醇终诱导补速分别为10.9、16.3和21.8 mL/(h·L)3个条件,结果如图4所示。由图4可知:甲醇流加速度越大,菌体浓度越高,生长越旺盛,培养后期受各种条件影响,菌体生长进入平台期。在诱导前期,由于甲醇补速是逐渐增加的,在诱导40 h前,DesB30表达量相差不大;而在诱导40 h后,甲醇补速越大,DesB30表达量越大。由此可见,提高甲醇流加速率使发酵液中的甲醇浓度维持在较高水平,有利于DesB30的表达。但在诱导100 h后,较高的甲醇流加速率已造成细胞损伤,菌体浓度开始降低,逐渐进入衰亡期。另外,在实验中发现,在较高的甲醇补速条件下,细胞代谢甲醇需要更多氧气,受发酵罐条件限制,无法维持合适的溶氧水平,因此在诱导过程中合适的甲醇补速对细胞生长和蛋白表达至关重要。在诱导过程中,较高的甲醇补速致使菌体生长越旺盛,产热严重,耗氧增加,对发酵罐的要求较高,而且甲醇终补速为16.3和21.8 mL/(h·L)条件下,诱导后期DesB30表达量相差不大。因此,综合各种条件及考虑成本因素,确定甲醇终流加补速16.3 mL/(h·L)为最适条件。
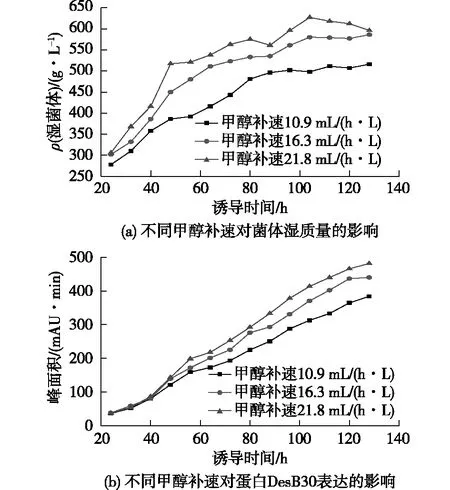
图4 不同甲醇补速下对菌体湿质量和DesB30 表达的影响Fig.4 Effects of different methanol flow rate on wet weight of bacteria and DesB30
2.5 优化条件下的发酵结果
在上述优化的发酵条件下,使用5 L玻璃发酵罐进行发酵实验。在30 ℃、pH 5.0培养条件下消耗基础培养基,待培养基中甘油消耗完毕后补料50%甘油,补料结束后调温度至26 ℃,pH至6.5,0.5 h后甲醇诱导,15 h内将甲醇补速提至16.3 mL/(h·L),发酵过程中将溶氧控制在15%以上,直至发酵结束。发酵结束时,下罐DesB30表达量能够达到2.5 g/L左右。彭强强等[16]利用一株重组毕赤酵母,通过优化的培养工艺,在5 L反应器水平发酵生产人胰岛素前体,108 h后产量达到1.85 g/L。与彭强强等[16]研究结果相比,本研究的DesB30表达量高出35%左右,具有明显的提升,说明本研究优化的条件更能利于DesB30的表达。
3 结论
毕赤酵母具有能够高效表达并有效分泌胞外蛋白、生产成本低等优点,普遍用于重组蛋白商业生产。在本研究中,笔者通过毕赤酵母成功地表达了地特胰岛素前体DesB30,并通过单因素实验,初步确定了DesB30蛋白的最优表达条件:诱导pH为6.0~6.5,诱导温度26 ℃,诱导前菌体质量浓度200 g/L,甲醇终补速16.3 mL/(h·L)。在优化的发酵条件下,5 L玻璃发酵罐中DesB30表达量能够达到2.5 g/L左右。
单因素试验能确定DesB30各种发酵因素的最佳发酵条件,但各因素之间可能存在交互作用,后续还需通过中心复合实验确定各因素之间最优的比例。另外在实验中发现,这种固定的甲醇诱导补料方式在发酵后期存在甲醇补料不足的问题,影响菌体正常生长,需要根据生长状况和蛋白表达情况及时调整甲醇流加速率。本结果对下一步利用大型发酵罐进行重组毕赤酵母发酵有借鉴作用,从而为DesB30大规模工业生产提供实验基础。

