HEV经输血感染兔模型研究*
梁春南 刘志国 黄维金 赵晨燕 邢 进 付 瑞 王佑春 佘锐萍
(1.中国农业大学动物医学院,北京 100193)(2.中国食品药品检定研究院实验动物资源研究所,北京 102629)(3.中国食品药品检定研究院,国家卫生健康委员会生物技术产品检定方法与标准化重点实验室,国家药品监督管理局生物制品质量研究与评价重点实验室,北京 102629)
戊型肝炎病毒(hepatitis E virus,HEV)是目前引起人类急性病毒性肝炎的重要病原体之一,为人畜共患病毒[1]。经估算,每年全球约有2 000万人感染HEV,相关死亡人数约7万,孕妇感染HEV后病死率可达20%[2]。传统上认为其主要经粪-口途径传播,HEV感染后造成的戊型肝炎主要表现为急性自限性疾病[1]。而近十年研究者们发现,HEV感染免疫抑制患者可造成慢性化并引起纤维化甚至肝硬化等严重疾病表现,危及生命[3-5]。同时,多项近期研究报道HEV感染后还可引发多种肝外疾病,包括神经系统疾病、肾脏疾病和血液系统疾病等[6-7]。这些新的临床表现,引起了全球广泛关注。
随着研究不断深入,HEV除粪-口途径之外的其他传播途径也被研究者发现。日本学者Matsubayashi等[8]首先报道了HEV经输血传播的临床案例报告,此后英国于2006年[9]、美国于2019年也有疑似案例报道[10]。目前,已有多国报道在当地血制品中检测到HEV RNA[11],我国近年来也有检出[12-17]。在英国开展的一项调查当地225 000份合格的献血样品研究中,发现其中79份为HEV RNA阳性(1∶2 878),基因型均为HEV基因3型(HEV-3)。后续跟踪未被召回的血制品发现,有43位患者接受了污染血制品输血,其中18位发生HEV感染(41.9%)。该研究引起广泛关注[18],目前欧洲多国已将血制品HEV RNA筛查纳入常规筛查项目,以加强输血安全[11]。
临床上关于HEV经输血传播案例逐渐增多,但目前仍缺乏有关其感染建立和感染动态的基础研究和动物模型。因此,需要使用理想的动物模型模拟输血传播过程。实验兔是目前用于HEV感染研究的较理想的小动物模型之一[19],其体型适中,可以通过接收足够体积的血类样品,满足感染建立对HEV总病毒载量的需求。实验兔虽然有血清分型,但同种输血无需进行血型配对[20]。相比非人灵长类和猪等HEV感染常用实验动物,兔在经济和伦理上也更容易被接受和利用。本研究使用HEV感染实验兔作为输血供体,采集供体抗凝血模拟输血给受体兔,开展经输血感染的兔模型的研究。
1 材料和方法
1.1 实验材料
1.1.1HEV病毒:兔HEV,为中国食品药品检定研究院实验室从兔体中自行分离的GDC9株,GenBank登录号为:FJ906895,研究开始前经SPF兔传代复苏,感染兔粪便加入到含2%BSA的生理盐水中,制成30%的粪便悬液,抽样检测病毒滴度,分装后冻存在-80 ℃冰箱中。
1.1.2实验兔:SPF级,由中国食品药品检定研究院实验动物资源研究所提供,实验动物生产许可证号:SCXK (京)2017-0005,经检测排除HEV感染和免疫史,实验动物使用许可证号: SYXK(京)2017-0013,本研究通过中国食品药品检定研究院实验动物福利伦理委员会的审查。
1.1.3仪器与耗材:QIAcube® HT 高通量核酸提取仪及配套的cador® Pathogen 96 QIAcube® HT Kit(5)和QIAcube®HT Plasticware组合套装;ABI7500实时荧光定量PCR仪;戊型肝炎病毒RNA检测试剂盒,购自北京金豪制药有限公司;戊型肝炎病毒抗原检测试剂盒(酶联免疫法)、戊型肝炎病毒抗体(HEV-Ab)酶联免疫法诊断试剂盒(双抗原夹心法),购自北京万泰生物药业股份有限公司。
1.2 实验方法
1.2.1供体兔培育:4只SPF级离乳兔(约45日龄),分别编号为D01~04。检疫适应期1周,检测排除HEV感染和免疫史后,经耳缘静脉注射接种兔HEV,病毒来源于兔粪便悬液,接种次数为1~2次,4只兔接受攻毒总剂量比例约为1∶1∶1∶2(D01∶D02∶D03∶D04)。每周收集粪便和耳缘静脉血,检测抗原、抗体和核酸等感染指标,以追踪供体兔的感染动态,选择抗原和核酸阳性的兔采集静脉血。
1.2.2受体兔准备:根据供体兔培育方案,在输血样本采集日前1周,按2倍受体兔的数量购入SPF离乳兔,检疫适应期1周,检测排除HEV感染和免疫史后,研究实际采用受体兔5只(编号分别为R01~05),均于输血当天称体质量。
1.2.3输血样本采集:根据供体兔培育方案,在设定日期,在采用舒泰与塞拉嗪复合全身麻醉后,以肝素钠真空采血管自供体兔后腔静脉窦(膈与肝静脉汇入口之间,后腔静脉膨大部)采集抗凝血,每只供体兔预留1.5 mL抗凝血以检测输血样本中HEV核酸载量外,其余部分用于后续输血。
1.2.4输血及输血后监测指标:按1.2.3采集的输血样本,根据受体兔体质量,于采集后立即以约10 mL/kg经耳缘静脉推注给予输血受体兔,输血后观察30 min确定受体兔无异常。输血当日、输血后连续13周,每周收集受体兔粪便和耳缘静脉血以监测受体兔粪便HEV抗原、核酸,血清抗体,以评估抗体对输血感染SPF兔成模率、持续排毒时间长短等。操作按照试剂盒说明书进行,酶联免疫法检测结果计算样品吸光度值与临界值的比值(S/CO)。输血方案及监测指标详见表1所列。

表1 输血方案及监测指标Table 1 Blood transfusion study design
1.3 数据分析
本研究采用EXCEL和GraphPad处理实验数据和图表。
2 结果
2.1 供体兔和输血样本
4只供体兔接种HEV的情况见表2所列,接种HEV后的感染动态指标监测结果如图1~图4所示。4只兔的粪便和血液核酸均为阳性的当天采集静脉血,采集血液立即用于后续输血研究。其中,D01~03兔为同时耳缘静脉供给粪便HEV,采集3或5 周在急性感染阶段的血液,D04为一只慢性戊肝家兔,采集攻毒后26周的血液。
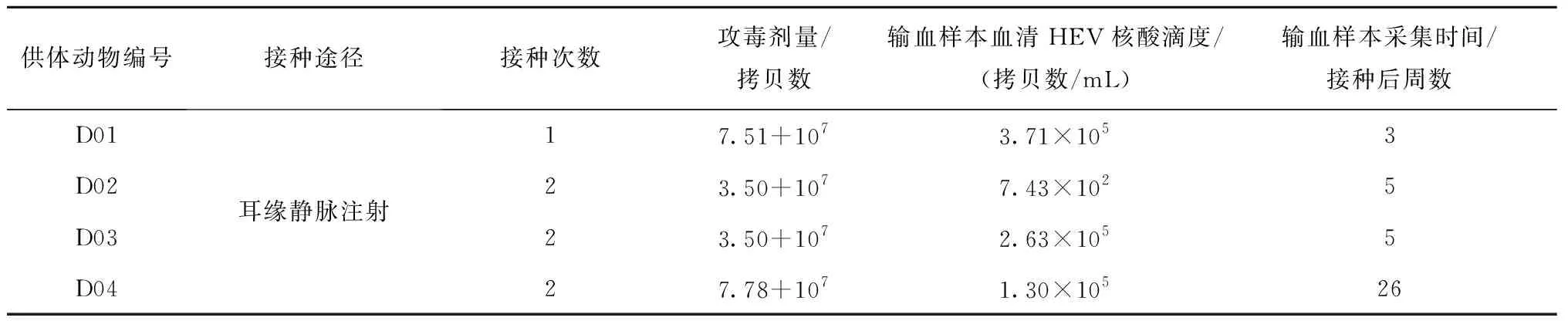
表2 供体兔培育方案Table 2 Profiles of the donor rabbits

图2 2号供体兔接种HEV后感染指标动态Fig.2 Dynamic of HEV markers in rabbit of No. D02

图3 3号供体兔接种HEV后感染指标动态Fig.3 Dynamic of HEV markers in rabbit of No. D03

图4 4号供体兔接种HEV后感染指标动态Fig.4 Dynamic of HEV markers in rabbit of No. D04
2.2 受体兔体质量及输血量结果
受体动物输血时周龄、体质量、输血量和输血次数信息见表3所列,R01-05号兔实际接受的输血剂量分别为9.5、10.7、11.7、12.6、10.2 mL/kg,每只受体兔实际接受输注HEV核酸拷贝数为5.19×106、1.19×104、1.26×104、5.00×105、2.21×106。

表3 受体动物输血时周龄、体质量、输血量和输血次数信息表Table 3 Profiles of the recipient rabbits
2.3 输血后HEV感染指标13周动态结果
静脉输血后,5只兔(图5~图9)均出现粪便排毒,输血感染HEV实验的成功率为5/5(100%)。其中2/5(R02和R03)兔排毒时间均小于6周,为急性HEV感染,仅有粪便排毒,血液中核酸和抗原检测均为阴性,但是血液抗体均为阳性,且抗体滴度S/CO只均大于13,属于强阳性,在4~7周便开始阳转。3/5(R01、R04和R05)兔排毒时间超过3个月以上,在13周的观察期末粪便核酸仍为阳性,为慢性HEV感染,除了粪便排毒外,同时有病毒血症和血液HEV抗原阳转,3只慢性感染的兔R01未发生抗体阳转,R04兔第8~10周抗体呈现弱阳性外,其他监测时段均呈阴性;R05兔的抗体在输血后第12 周才出现明显的阳转。

图5 1号受体兔输血后13周HEV感染指标动态Fig.5 Dynamic of HEV markers in recipient rabbits No.R01

图6 2号受体兔输血后13周HEV感染指标动态Fig.6 Dynamic of HEV markers in recipient rabbits No.R02

图7 3号受体兔输血后13周HEV感染指标动态Fig.7 Dynamic of HEV markers in recipient rabbits No.R03

图8 4号受体兔输血后13周HEV感染指标动态Fig.8 Dynamic of HEV markers in recipient rabbits No.R04
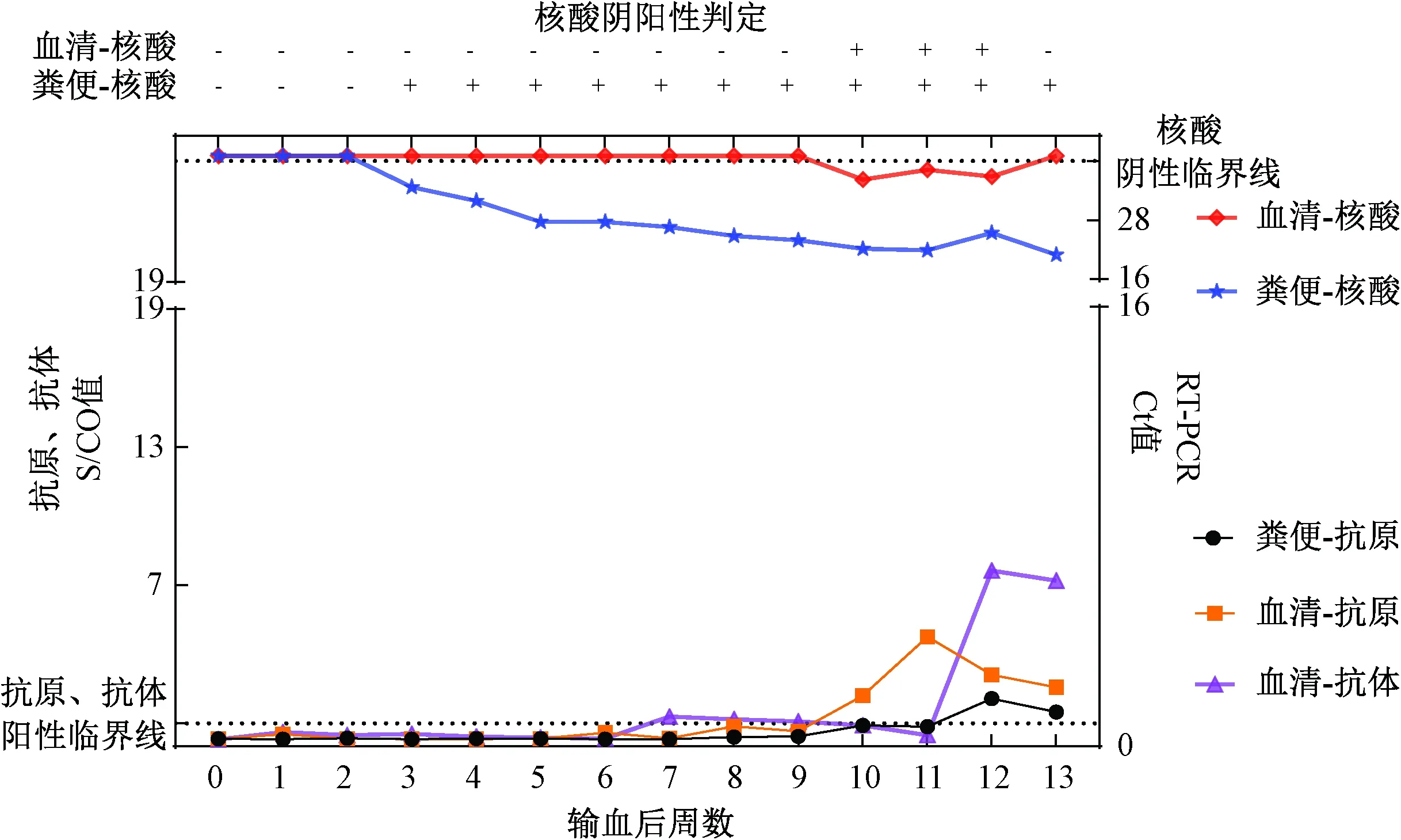
图9 5号受体兔输血后13周HEV感染指标动态Fig.9 Dynamic of HEV markers in recipient rabbits No.R05
3 讨论
自2002年日本报道首例输血传播HEV的临床病例[8]后,多国在当地献血员样品中检测到HEV RNA,且经输血传播HEV的案例报道不断增多,HEV的输血传播风险也越来越重视[12]。但临床研究的主要关注点在于血液样本的HEV血清学筛查,以及在发生疑似输血感染后的溯源调查。有报道表明戊型肝炎病毒可能存在有膜结构和无膜结构两种形态,并通常认为经肝脏进入血液的病毒为有膜状态,经肝脏进入胆汁后、通过粪便排出的病毒为无膜病毒[1,21-24]。因此,与HEV粪-口传播途径相比,HEV经输血传播后的感染性、致病性和疾病转归亟需详细研究。
早期有研究使用非人灵长类动物进行HEV输血传播,将一份来自于志愿献血员的10 mL HEV病毒血症的血浆输入1只恒河猴,发现该恒河猴出现了ALT急性升高、抗体升高和病理阳性,以及第5~8周粪便排毒、第7周检出病毒血症等较典型的急性肝炎表现,HEV RNA克隆片段测序显示与输入血浆携带一致,从而直接证实了HEV经血液传播并导致急性戊肝的可能性[25]。本研究使用5只SPF兔作为输血受体模型进行了探究,发现HEV经静脉输注全血方式成功在兔中除可获得急性HEV感染外,也可能获得慢性HEV感染(相关影响因素在后文另有讨论),为今后研究相关问题提供了新的模型和工具。
对比供体兔接种HEV核酸拷贝数与收集血液样本中HEV核酸拷贝数发现,两者之间未见明显相关性:在同样接种剂量、相同感染周期的情况,D03与D02两者收集的相同体积输血样品中HEV RNA载量倍数关系超过35倍;D01接种剂量约为D04的1/2,其收集的相同体积输血样品中HEV RNA载量约为后者2.85倍;这可能是感染剂量、感染周期、以及个体差异等综合因素共同决定。
血清中的HEV核酸载量常低至实验室手段无法检出而被界定为阴性,实验兔可以通过接收足够体积的血液样品而满足感染发生对HEV总载量的需求。本研究收集用于输血的全血样本中,采自D02的输血样本病毒核酸滴度低至7.43×102拷贝数/mL, 按实际输血体积10.7 mL/kg和11.7 mL/kg分别输注给R02和R03 2只受体兔,每只兔实际接受输注HEV核酸载量达到1.19×104和1.26×104个拷贝而实现了急性感染,另外3只受体兔,实际接受输注HEV核酸载量分别为5.19×106、5.00×105、2.21×106个拷贝,则呈现出慢性感染。该结果表明,输血导致的急性或者慢性感染,可能与受体兔接受输注的HEV核酸总拷贝数相关,高滴度的病毒可能更容易引起慢性感染。本研究中R02和R03 2只兔感染后出现高滴度的HEV抗体,抗体升高后粪便排毒消失,从而引起急性感染。而引起慢性感染的兔,抗体阳转不早于7周,而且抗体滴度低,所以,兔的自身免疫状态可能也是引起兔慢性戊肝的原因。
综上所述,本研究成功建立HEV经输血感染兔模型,感染成功率100%;同时研究还提供了输血感染兔详细的感染指标动态变化。兔模型可用于有关HEV输血传播的相关研究,特别是可在未来探索成功建立感染的最小病毒载量。最后,有关机构和临床应重视血液制品安全,对HEV进行筛查排除,确保用血安全。

