有机光催化在构建咪唑并[1,2-a]吡啶3-位C—C键中的研究
刘 想, 李 文, 黄昌凤, 曹 华
(广东药科大学 医药化工学院 广东省化妆品工程技术研究中心,广东 中山 528458)
含氮化合物咪唑并[1,2-a]吡啶是一种关键的结构单元,在光学、材料科学和药物化学等领域都具有广泛的应用[1](图1)。官能化的咪唑并[1,2-a]吡啶,尤其是C-3位官能化的咪唑并[1,2-a]吡啶,具有抗病毒、细胞毒性、抗菌、杀菌剂和抗炎等多种药理活性[2-5]。多年来,越来越多的有机化学家关注杂环化合物的C—H键官能化反应,该反应对具有生物活性和药物活性的杂环化合物来说意义非凡。目前,咪唑并吡啶结构成为了很多药物分子的核心结构,如唑吡啶、唑吡坦、阿吡坦等[6]。目前,已有多种合成C-3位官能化的咪唑并[1,2-a]吡啶的方法,但部分存在产率低、金属催化剂消耗大、成本高、污染环境等问题。因此,追求咪唑杂环的绿色合成和官能化方法,引起了医药研究和有机合成领域的极大兴趣[7]。
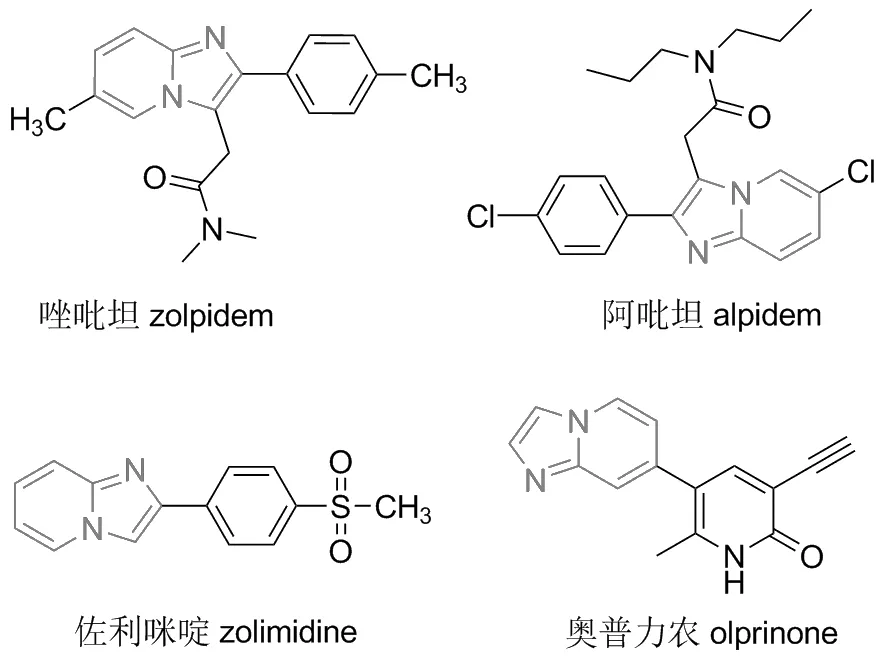
图1 含咪唑并吡啶结构的代表性药物Figure 1 Representative drugs of imidazolepyridines compounds
在过去的一段时间里,可见光极大地促进了有机转变,已成为一种高效和环境兼容的合成策略[8-10]。有机光催化的合成反应是指催化剂参与下的光化学反应,常用催化剂主要有fac-Ir(ppy)3、 rose bengal和Ir(py)2(dtbbpy)PF6等,结构式如图2所示,常用光源有蓝光、日光和白光等。其反应机理基本如下:在光源的作用下,有机光催化剂吸收光能转变为激发态,激发态的光催化剂与其中一个反应物反应产生活性中间体自由基,进而与咪唑并[1,2-a]吡啶咪唑环上的碳碳双键作用合成新的化合物。光催化技术操作简单、能耗低、无二次污染、效率高,是一种绿色安全的有机合成方案,有效推动了有机合成的发展[11]。因此,在光催化下推动咪唑并[1,2-a]吡啶C-3位官能化,从而构建新的C—C键,已经得到越来越多化学工作者的关注(图3)。本研究小组一直致力于基于绿色化学导向的C—H键官能化反应,并且在构建咪唑并[1,2-a]吡啶等含氮杂环化合物中取得重要进展[12-15]。
鉴于有机光化学的快速发展,本文从构建咪唑并[1,2-a]吡啶3位C(sp2)—C(sp3)和C(sp2)—C(sp2)两种形式,简要综述了近年来在有机光催化下构建咪唑并[1,2-a]吡啶3-位C—C键的相关研究。
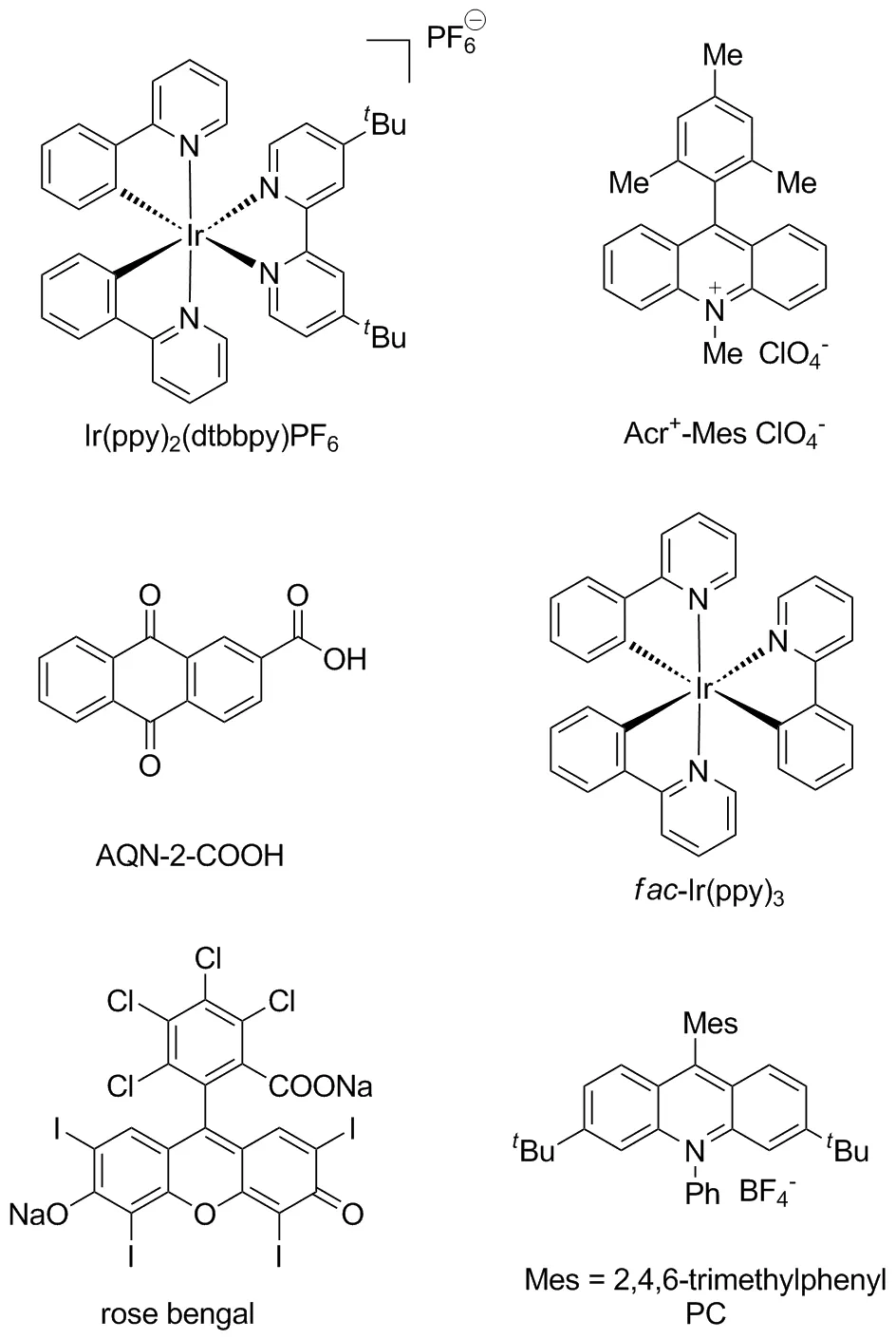
图2 有机光催化剂的结构Figure 2 Structures of organic photocatalysts
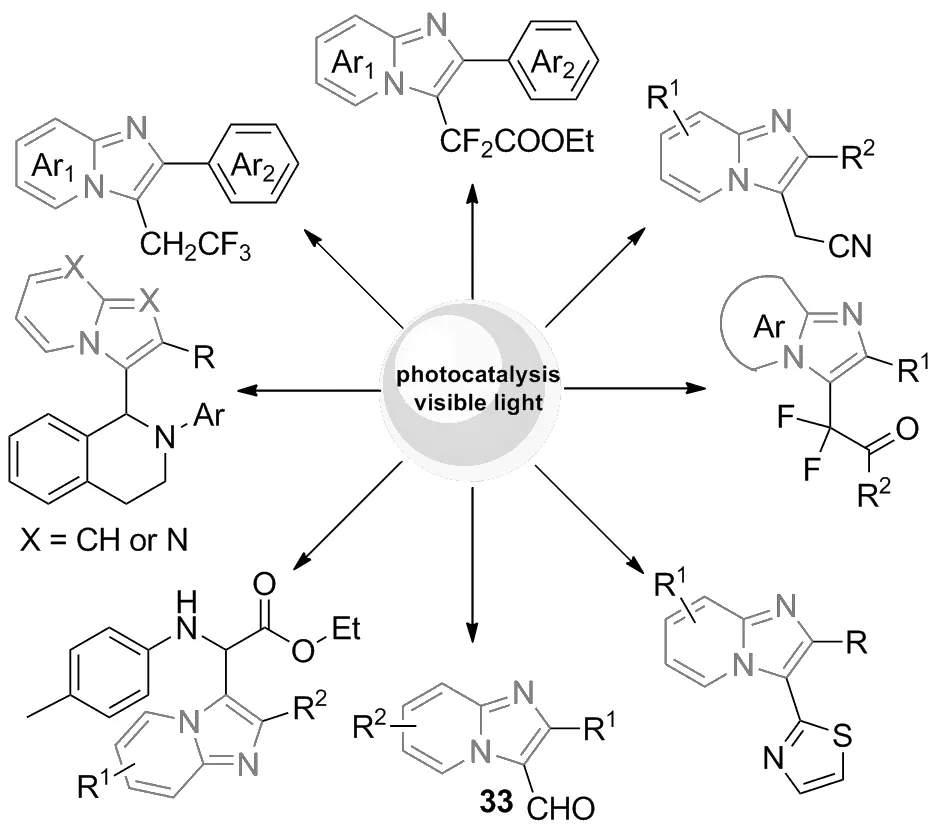
图3 有机光催化在合成咪唑并吡啶类化合物中应用Figure 3 The application of synthesis of imidazolopyridine compounds via organic photocatalysis
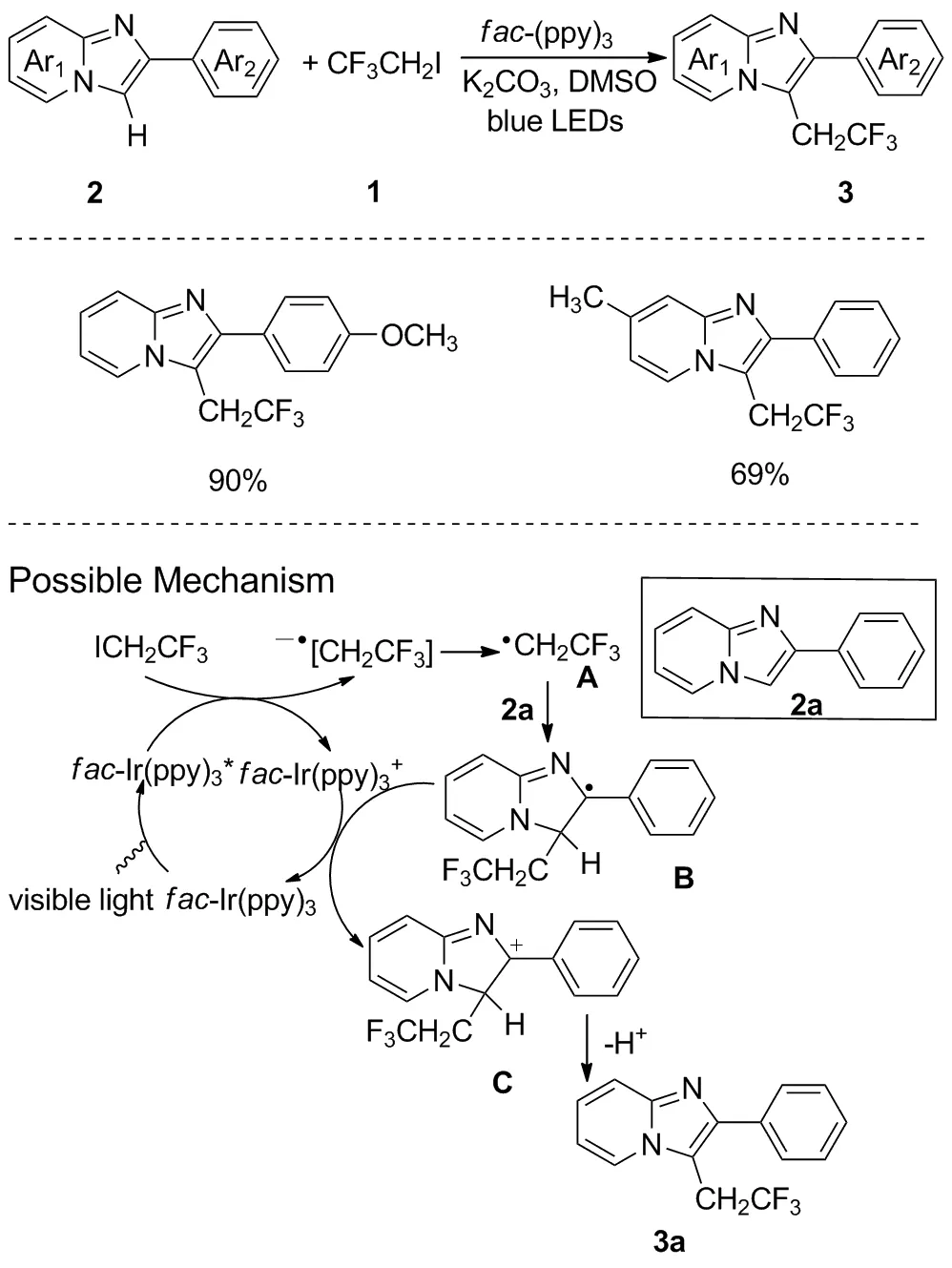
图4 可见光下咪唑并[1,2-a]吡啶的区域选择性三氟乙基化反应Figure 4 Regioselective trifluoroethylation of imidazo[1,2-a]pyridines under visible-light irradiation
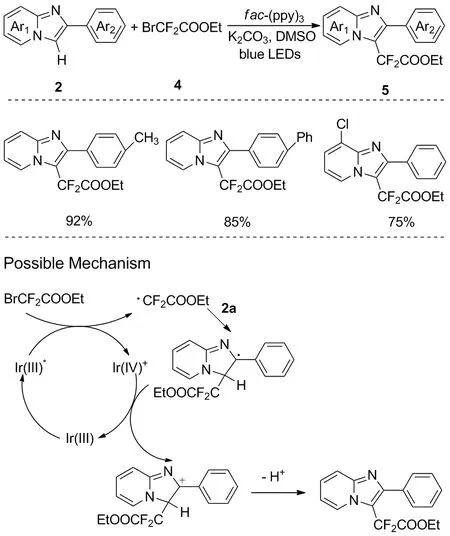
图5 咪唑并[1,2-a]吡啶的区域选择性二氟乙酰化反应Figure 5 Regioselective difluoroacetylation of imidazo[1,2-a]pyridines
1 可见光催化咪唑并[1,2-a]吡啶3-位C(sp2) —C(sp3)键的构建
在可见光的催化下,咪唑并[1,2-a]吡啶3-位C—H官能化构建C(sp2)—C(sp3)键的合成方法多种多样,包括咪唑并[1,2-a]吡啶的三氟乙基化[16]、二氟乙酰化[17]、氰甲基化[18]、烷基化[19-20]、三氟甲基化[21,24]等。下面是按时间顺序对可见光诱导咪唑并[1,2-a]吡啶3-位C(sp2)—C(sp3)键形成的反应进行的概述。
2016年,Zhu等以1,1,1-三氟-2-碘乙烷(1)为三氟乙基自由基源,发展了一种可见光诱导的咪唑杂环2的C-3选择性三氟乙基化反应[16]。该反应以fac-Ir(ppy)3为光催化剂,经蓝光照射可实现咪唑并[1,2-a]吡啶C(sp2)—C(sp3)键的构建。该反应具有良好的区域选择性,可选择性在咪唑并[1,2-a]吡啶C3官能化。且无论芳香环上连有吸电子基团还是给电子基团,均表现为良好的耐受性,但咪唑并吡啶环上连有卤素等基团时所得产率较低。反应反应机理如下:首先,催化剂fac-Ir(ppy)3在光照射下形成激发态[fac-Ir(ppy)3*],然后被CF3CH2I氧化,生成中间体[CF3CH2]·-和[fac-Ir(ppy)3]+,接着中间体[CF3CH2]·-转变为成自由基A;随后自由基A与2-苯基咪唑并[1,2-a]吡啶2a结合生成自由基中间体B;自由基B被[fac-Ir(ppy)3]+氧化,形成阳离子中间体C;最后,由碱辅助的去质子化产生所需的产物3a(图4)。
和上述工作类似,2017年,Yin等用BrCF2CO2Et4为碳源,实现了可见光催化咪唑并[1,2-a]吡啶杂环2的直接区域选择性二氟乙酰化反应,可以合成一系列化合物5[17](图5)。该反应的光催化体系和反应机理与2016年Zhu等报道的方法类似,具有较高的官能团耐受性,其中芳香环上带有Me、 OMe等给电子基团时比带有卤素等吸电子基团时的产率较高,并且当咪唑并吡啶环上带有氯原子时所得产物产率较低。
同年,Chang等发现了可见光诱导的咪唑并吡啶的选择性氰甲基化反应。该反应以fac-Ir(ppy)3作为光催化剂,在蓝光照射下,使咪唑并[1,2-a]吡啶6与溴乙腈7反应,合成3-氰甲基化咪唑并吡啶8[18](图6)。该反应对给电子基团和吸电子基团均耐受,所得产率较高,且具有合成路线短、成本低、反应条件温和等特点,对类似物唑吡坦和阿吡坦等药物的合成具有重要意义,其反应机理与Zhu等提出的机理类似。当采用碘乙腈作为碳源时,反应也能顺利进行。此外,可见光诱导的氰甲基化反应也可能发生在咪唑环上,适用于其他咪唑杂环底物,如2-苯基苯并[d]咪唑[2,1-b]噻唑和6-苯基咪唑[2,1-b]噻唑等。
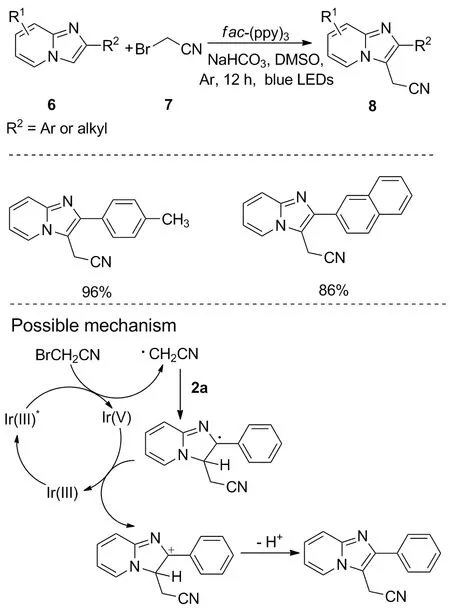
图 6 咪唑并[1,2-a]吡啶的选择性氰甲基化反应Figure 6 Regioselective cyanomethylation of imidazo[1,2-a]pyridines
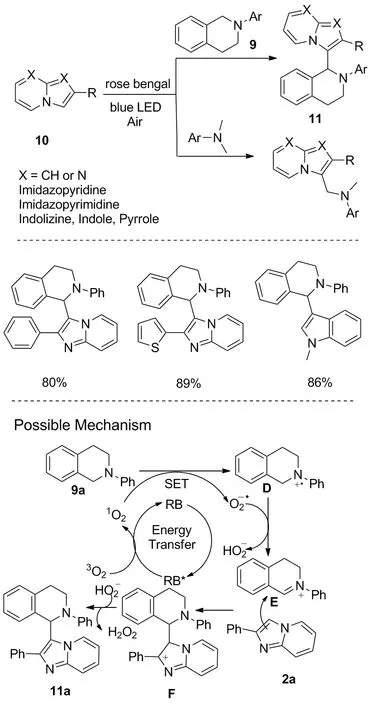
图7 可见光诱导的咪唑并[1,2-a]吡啶的交叉脱氢偶联反应Figure 7 Visible-light-promoted cross-dehydrogenative coupling of imidazo[1,2-a]pyridines
同一时期,Zhu等报道了可见光促进N-芳基甘氨酸酯12与咪唑并[1,2-a]吡啶13交叉脱氢偶联反应,以此可以合成化合物14[20](图8)。该反应无需添加任何光敏剂,只需添加金属铜催化剂即可。需要注意的是,反应中的分子氧扮演着重要的角色。在最佳条件下将反应置于氮气氛围下时,反应完全不能进行。作者认为首先是二价铜与N-芳基甘氨酸酯12中的氮、氧原子配位,随后该中间体在可见光照射和氧气的作用下生成亚胺中间体,最后亚胺中间体和咪唑并[1,2-a]吡啶2a加成从而得到目标产物。另外,当原料N-芳基甘氨酸酯12的苯环上含有强吸电子基时,不利于该反应的转化。而当N-芳基甘氨酸酯酯基中含有不同烷基取代基时,对反应的产率影响较小。

与Singsardar发表文章同期,Qu等提出了一种利用可见光促进的溴二氟芳基酮20与咪唑并[1,2-a]吡啶21作用生成化合物22的二氟烷基化反应[23](图11)。该反应条件温和、操作简单,为简化含二氟化合物的合成提供了一种新的方法。
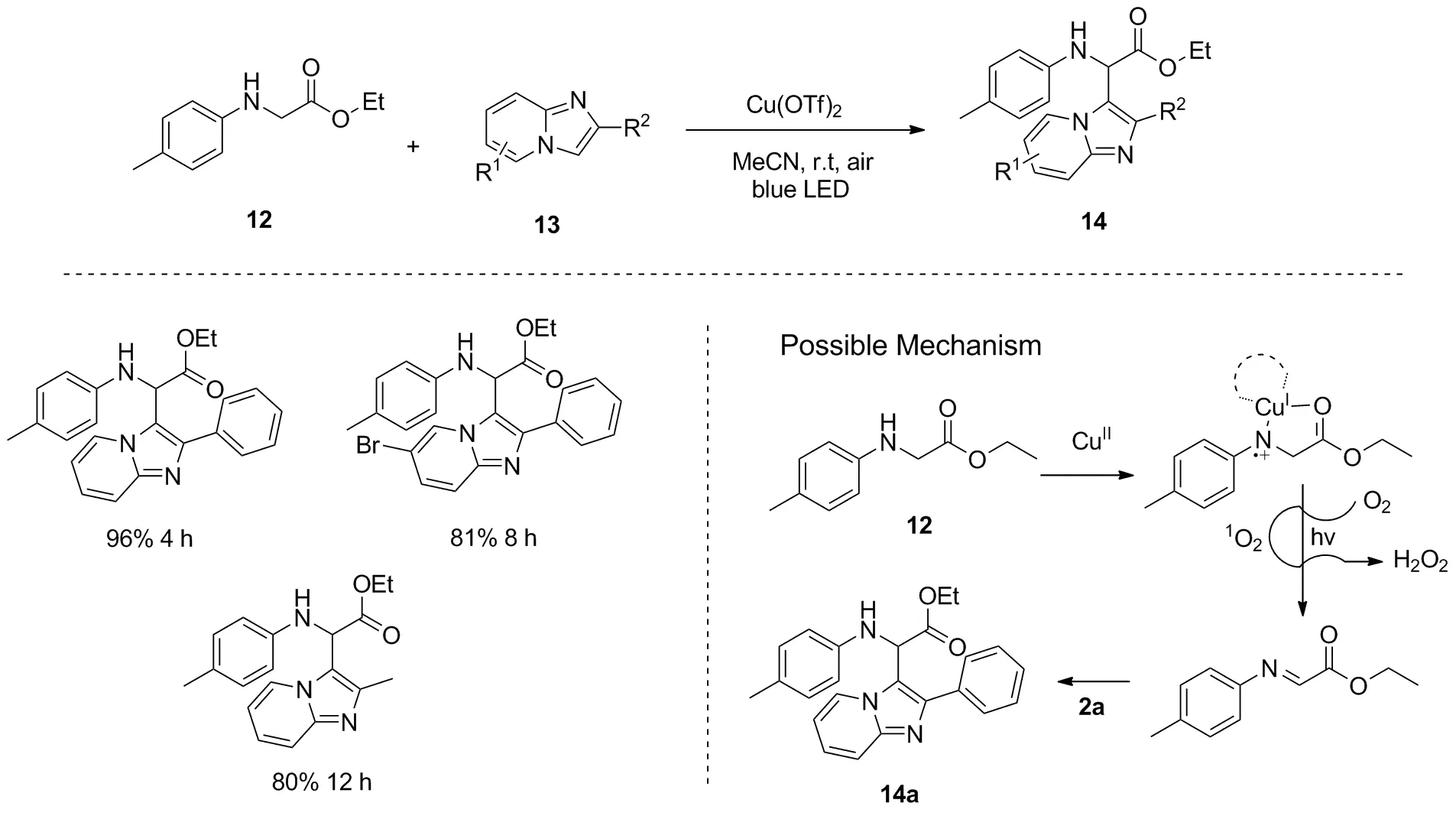
图8 可见光促进N-芳基甘氨酸酯与咪唑并[1,2-a]吡啶的交叉脱氢偶联反应Figure 8 Visible-light-promoted cross-dehydrogenative-coupling reaction between N-arylglycine estersand imidazo[1,2-a]pyridines
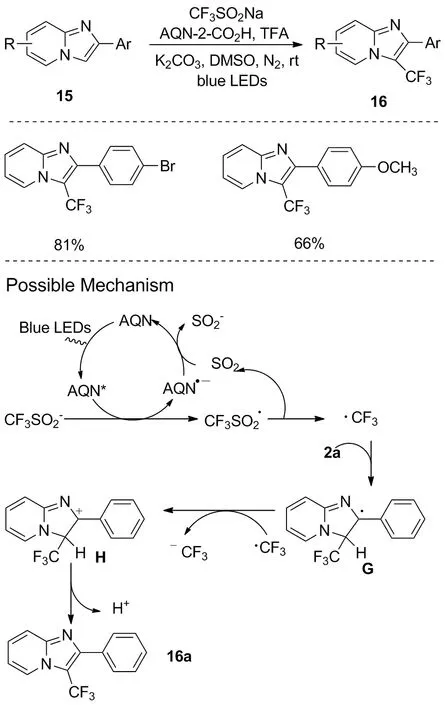
图9 可见光介导的咪唑并[1,2-a]吡啶的区域选择性三氟甲基化Figure 9 Visible-light-mediated regioselective triflfluoromethylation of imidazo[1,2-a]pyridines
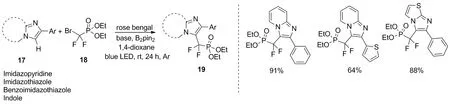
图10 咪唑杂环化合物的二氟亚甲基膦化反应Figure 10 Difluoromethylenephosphonation of imidazoheterocycles
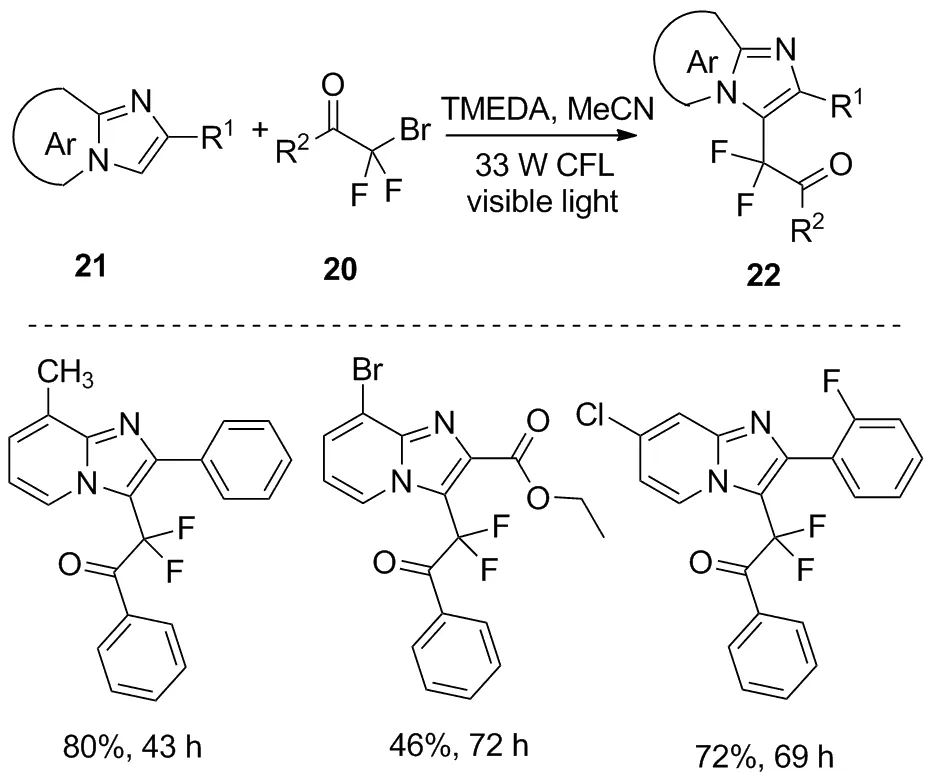
图11 咪唑并吡啶的光化学二氟烷基化反应Figure 11 Photochemical difluoroalkylation of imidazolopyridines

图12 咪唑并[1,2-a]吡啶的三氟甲基化Figure 12 Trifluoromethylation of imidazo[1,2-a]pyridines
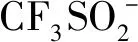
同年,Shi等以CsPbBr3作为非均相光催化剂,咪唑并吡啶杂环化合物25与N-苯甘氨酸类衍生物26的氨基甲基化反应,合成化合物27[25](图13)。在该反应中,无论咪唑并[1,2-a]吡啶苯基上的取代基为吸电子基团(F、 Cl、 Br、 CN和CF3)或给电子基团(OMe、 Me),均表现出良好的耐受性,其中R1含有噻吩和萘环时也适用于该转化,且均获得良好的收率。
2017年,Chang等在Ir(py)2(dtbbpy)PF6(Ir(III))催化下,通过可见光诱导咪唑并[1,2-a]吡啶28与2-溴噻唑29反应,来合成化合物30[26]。该反应是在温和的反应条件下进行的,并以中等至良好的产率获得目标产物。反应机理如下:首先,催化剂Ir(ppy)2(dtbbpy)PF6在光的照射下转变为激发态;然后,2-溴噻唑与激发态Ir(III)*反应生成噻唑基自由基I;接着,噻唑基自由基I加入到2a中生成杂环自由基J。同时,胺还原Ir(IV)时生成一个胺基阳离子K,该阳离子从J中捕获一个氢自由基形成铵离子,最终得到30a(图14)。此外,该反应亦适用于5-溴-2-糠醛,6-苯基咪唑[2,1-b]噻唑等咪唑杂环化合物。
图13 咪唑杂环的光催化脱羧甲基化反应Figure 13 Photocatalytic decarboxylative aminomethylation of imidazo-fused heterocycles

图14 可见光催化咪唑并[1,2-a]吡啶与2-溴噻唑的C-3偶氮反应Figure 14 Visible-light-mediated C-3-azolylation of imidazo[1,2-a]pyridines with 2-bromoazoles
随后,Kibriya等在有氧的条件下以rose bengal为光敏剂,四甲基乙二胺(TMEDA)31为单一碳源,发展了一种可见光诱导的咪唑并[1,2-a]吡啶32的C-3甲酰化反应,合成了化合物33[27](图15)。在氧气存在条件下,利用该策略有效地合成了芳基/杂芳基/烷基咪唑并[1,2-a]吡啶。该反应具有较高的底物耐受性,所得产物产率高,如Me、 OMe、 F、 Cl、 Br、 OH、 CN、 CF3、 SO2Me等基团都能兼容。重要的是,对于未取代的咪唑并[1,2-a]吡啶也能区域选择性地获得3-甲酰基化产物。从绿色化学的角度来看,该方法的可扩大规模反应也是一个重要方面。另外,除咪唑并[1,2-a]吡啶外,该策略也适用于吲哚嗪的甲酰化反应。
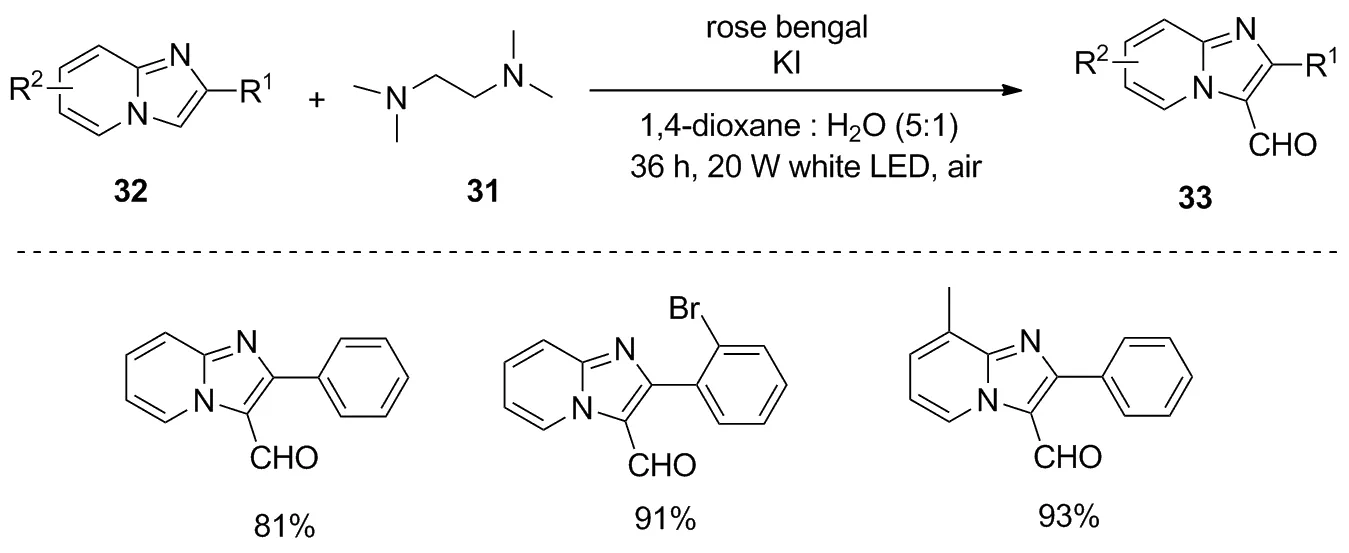
图15 咪唑并[1,2-a]吡啶的甲酰化反应Figure 15 Formylation of imidazo[1,2-a]pyridines

图16 咪唑并[1,2-a]吡啶的区域选择性羰基化Figure 16 Regioselective Carbonylation of imidazo[1,2-a]pyridines
2019年,Tang等以9-甲酰-10-甲基吡啶离子(Acr+-Mes)为高效有机光敏剂,氧分子作为氧化剂,使咪唑并[1,2-a]吡啶34与硝基化合物35反应合成化合物36,实现了咪唑并[1,2-a]吡啶的区域选择性C-3羰基化[28](图16)。该反应作用条件温和,底物适用范围广,但对于苯并呋喃、吲唑等杂环化合物则不能发生该反应。
综上所述,有机光催化咪唑并[1,2-a]吡啶的C-3官能化吸引了很多学者的关注,为合成官能化的药物分子提供了良好的策略。这种有机光催化的合成方法实现了多种生物活性含氮杂环的C—H官能化,如咪唑并吡啶、咪唑并噻唑、吲哚等,C—H官能化也能在过渡金属光催化剂或有机光氧化还原催化剂,甚至在没有任何光催化剂的情况下进行。此外,这种光催化咪唑并[1,2-a]吡啶3-位官能化,从而构建C—C键的合成方法绿色友好、作用条件温和、可持续能力强、产率较高。近年来,很多研究者对咪唑并吡啶进行了研究,并在其3-位C—H官能化方面取得了巨大突破,然而仍然存在一些问题和挑战:(1)在适当的条件下,咪唑并吡啶5-位也可以发生官能化反应,目前通过光催化途径对5-位官能化的报道较少;(2)光催化氮杂环化合物的C—H官能化在药物开发和先导化合物后期修饰的应用还有待进一步研究。期待出现更多有机光催化咪唑并[1,2-a]吡啶区域选择性C—H键官能化的新研究。

