多孔氧化铝担持NiFe2O4水热解制氢
应 耀,王春阳,王能超,车声雷
(浙江工业大学 材料科学与工程学院,浙江 杭州 310014)
化石能源日趋枯竭、环境污染日益严重等问题已经对人类生产生活构成重大威胁[1],开发和使用无污染的绿色能源成为人类实现可持续发展所必须解决的重要课题。因此,电能的来源已经由采用煤作为原料的热电向核电、水电、风电、光电和光热发电等洁净的发电方式转变。但是,这些发电方式也或多或少存在例如核电的核泄漏风险、水电的地域和季节限制、风力发电的传输和费电问题等各种各样的现实困难,而且电力的输送以及存储(充电与用电)过程中的损耗问题也逐渐引起人们的关注。另外,新能源汽车行业经过几年的实践,纯电动汽车所存在的续航短、易燃易爆、电池生产和废弃造成的二次污染等问题也逐渐暴露了出来,因此燃料电池车开始得到广泛的关注。氢能源作为一种清洁、高效的绿色能源在替代传统化石燃料上被寄予厚望[2],如果能够解决氢的清洁制造和安全使用问题,其有可能成为清洁能源的终极形态。美国、欧盟、日本和韩国都投入了大量资金和人力进行燃料电池车辆的研究,丰田、本田、通用、福特和奔驰等公司都已经开发出燃料电池车型并已开始上路[3]。随着全球氢燃料电池汽车产业的快速发展,氢气来源和制氢技术备受关注[4]。太阳能光热制氢的方式有直接热解水制氢、两步式热化学循环制氢、太阳能光化学分解水制氢以及太阳能光电化学电池分解水制氢等。目前,电解水制氢依然依赖于贵金属,但受限于其价格昂贵、资源稀缺,无法大规模商用化[5],而两步式热化学循环制氢可以利用光热发电的设备,尤其受到研究者关注。

1 实 验
1.1 主要原材料
Fe2O3粉末(CSR-900,Cheminite)、NiO粉末(N108314,阿拉丁)、多孔氧化铝陶瓷(红袖环保陶瓷店,HC-CH-02)。
1.2 材料制备
1.2.1 NiFe2O4粉末制备
采用传统固相法制备NiFe2O4粉末,按摩尔比1∶1称量适量的Fe2O3和NiO粉末,利用球磨混合均匀,然后在箱式高温炉(HMF1400-30A,上海皓越高温设备有限公司)中1 200 ℃温度下预烧30 min,再经球磨粉碎后得到平均粒度约150 μm的NiFe2O4粉末。
1.2.2 多孔Al2O3陶瓷担持NiFe2O4的制备
将NiFe2O4粉末和适量的PVA溶液(质量分数8%)置入烧杯,混合搅拌至均匀黏稠的悬浊液,取孔隙率87.92%的多孔氧化铝陶瓷浸入悬浊液中,使NiFe2O4粉末均匀地分布在多孔氧化铝陶瓷上,于110 ℃下干燥1 h,使粉末和陶瓷黏结紧密,反复进行上述步骤直至粉末将多孔氧化铝陶瓷表面包覆。
1.3 实验设备及实验过程
水热解制氢实验装置如图1所示,该实验装置主要由管式炉(GSL-1600X,合肥科晶材料有限公司,管长1 m,外径80 mm,内径70 mm),氢气浓度分析仪(KE200-B,西安科鹏机电设备有限公司),加热套,流量计(量程1 L)组成。
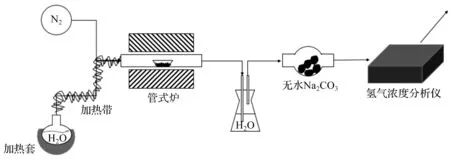
图1 实验装置图Fig.1 Scheme of the experimental set
水分解制氢由两步组成:第一步是在氮气的气氛下将NiFe2O4进行高温还原,将5 g样品(m(ZrO2)∶m(NiFe2O4)=1∶1、质量比同为1∶1的以氧化铝为基体的NiFe2O4)置入氧化锆瓷舟,以500 mL/min的速率向管式炉通入氮气,同时以5 ℃/min的速率将管式炉内样品分别升温至一定还原温度(1 400,1 300,1 250,1 200 ℃),并在该温度下保温1 h,使样品被充分还原;第二步是在相对低温下发生水解,管式炉以5 ℃/min的速率降至1 000 ℃,打开加热套、加热带等设备,向管式炉内同时通入H2O(g)和N2(g),微调N2进入管式炉的速率,使管式炉气体排出流量保持500 mL/min,同时开启氢气浓度分析仪对氢气浓度进行测量并自动记录数值。实验完成后管式炉冷却至室温,取出样品,通过USB数码电子显微镜(威尔德百思)对其进行形貌分析。在不同的条件下分别进行数次热化学循环,对每组样品的制氢能力、循环次数进行分析。
2 结果与讨论
2.1 掺杂ZrO2阻隔剂的NiFe2O4与氧化铝陶瓷担持NiFe2O4粉体循环制氢能力的对比分析
将NiFe2O4、质量比m(ZrO2):m(NiFe2O4)=1∶1掺杂混合物与多孔氧化铝陶瓷担持的NiFe2O4在1 400 ℃下还原,1 000 ℃下水解制氢,记录其在多次热化学循环中的氢气质量浓度。
图2,3分别为NiFe2O4、NiFe2O4与ZrO2的掺杂混合物经多次热化学循环的SEM显微形貌图,可以看出:随着热循环次数的增加,两幅图中的NiFe2O4颗粒粒径均因烧结有一定程度的增大,其中图3中NiFe2O4粒径的增大幅度略缓,这是因为ZrO2的掺杂一定程度上缓解了镍铁氧体的烧结。从图3中也可以看出:ZrO2和NiFe2O4的掺杂分布并不均匀,阻隔剂对NiFe2O4粉体之间的烧结没有产生足够的阻隔作用,NiFe2O4粉体仍然可以通过烧结作用聚集结块。图4为担持在多孔氧化铝陶瓷上的NiFe2O4粉体,与图3相比,担持在多孔氧化铝陶瓷上的NiFe2O4粉体在循环中的烧结程度相对较低。这主要是由于该材料中NiFe2O4粉体经过加热与多孔氧化铝陶瓷紧密地结合在一起,铁氧体发生烧结时受到陶瓷基体的固着,粉体的移动变得非常困难,阻碍了NiFe2O4粉体的烧结集聚。粉体烧结聚集使其粒径增大,进而导致了材料比表面积的降低。镍铁氧体在水解制氢过程中作为催化剂,当水蒸气与经还原的镍铁氧体接触时,具有氧空位的镍铁氧体被水蒸气氧化,同时水蒸气被还原为氢气。催化剂的催化效果很大程度上是由反应物之间的接触面积决定的。催化剂的表面积越大,它所包含的活性中心就越多,催化剂的活性就越高。因此抑制粉体烧结,保持其催化活性是保证稳定循环制氢的关键。图5为NiFe2O4、m(ZrO2)∶m(NiFe2O4)=1∶1掺杂混合物与氧化铝陶瓷担持的NiFe2O4粉体制氢能力与循环次数图。从图5的氢气质量浓度和循环次数变化趋势中同样发现:相比于氧化锆掺杂的NiFe2O4粉体,担持在多孔氧化铝陶瓷上的NiFe2O4粉体氢气质量浓度更高,制氢量降低的趋势更缓。

图2 不同热化学循环后NiFe2O4显微形貌Fig.2 Micrographs of nickel ferrite powder after different thermochemical cycles

图3 不同热化学循环后质量比m(ZrO2)∶m(NiFe2O4)=1∶1的掺杂混合物显微形貌Fig.3 Micrographs of the mixed powder of zirconia and nickel ferrite at a 1∶1 mass ratio after different thermochemical cycles

图4 不同热化学循环后氧化铝陶瓷担持的NiFe2O4的显微形貌Fig.4 Micrographs of porous alumina loaded nickel ferrite after different thermochemical cycles

图5 制氢能力与循环次数图Fig.5 Hydrogen yield with thermochemical cycles
综上,相比于ZrO2掺杂NiFe2O4产生的阻隔效果,多孔氧化铝陶瓷担持的NiFe2O4在多次热循环过程中阻隔效果更佳,NiFe2O4烧结趋势更缓,在氢气质量浓度及循环寿命上具有明显优势。因此以多孔氧化铝陶瓷作为基体在长期的循环制氢过程中更具价值和意义。
2.2 还原温度对氧化铝陶瓷担持的NiFe2O4粉体循环制氢能力的影响
镍铁氧体的催化效果既取决于其比表面积,也取决于其还原温度。因此将多孔氧化铝陶瓷担持的NiFe2O4分别在1 200,1 250,1 300,1 400 ℃下还原,1 000 ℃下水解制氢,以寻找在多个热化学循环过程中最适宜的还原温度。记录每次热化学循环中的氢气质量浓度并绘制氢气质量浓度—循环次数的关系图(图6),分析其在第1,3,5次热化学循环后的显微形貌。

图6 多孔氧化铝陶瓷担持NiFe2O4在不同还原温度下氢气质量浓度随循环次数的变化Fig.6 Hydrogen yield with thermochemical cycle for porous alumina loaded NiFe2O4 at different reduction temperatures
粉体的烧结伴随着粉体的迁移和聚集,粉体聚集于基体鞍部使其表层变厚变宽,为了更准确地比较不同还原温度下NiFe2O4烧结程度,通过测量两定点之间距离(图7)的变化来对其进行分析。由于在利用显微镜反复观察各个热化学循环后的样品时很难保证每一次的物距都严格一致,各循环的照片放大倍数可能会有轻微的波动。为了消除这一影响,在每组图片中选取多孔氧化铝基体上的两点作为参照距离,以此为基准矫正USB显微镜照片放大倍率的偏差,测量并计算两定点间的相对距离(表1)。

图7 不同温度下还原的放大显微形貌图Fig.7 Enlarged micrographs of samples reduced at different temperatures

表1 材料经多次热循环显微形貌图两定点间相对距离Table 1 The relative distance between two fixed points of the micromorphology of the material during multiple thermochemical cycles
图8为还原温度1 200 ℃,水解温度1 000 ℃,多孔氧化铝陶瓷担持的NiFe2O4在不同次数热化学循环后的显微形貌。从图8可以看出:在还原温度为1 200 ℃时,NiFe2O4的烧结现象并不明显,由表1同样发现其两定点的相对距离a/b在多次热循环中基本保持不变,可以推断出在该温度下其比表面积变化不大,因而在多次热化学循环过程中其氢气质量浓度保持稳定。但同时该还原温度使NiFe2O4的还原程度较低,因此水解的氢气质量浓度偏低。

图8 不同次数热化学循环后的显微形貌(1 200 ℃)Fig.8 Micrographs under different thermochemical cycles(1 200 ℃)
图9为还原温度为1 250 ℃,水解温度1 000 ℃,多孔氧化铝陶瓷担持的NiFe2O4在不同次数热化学循环后的显微形貌。从图9可以看出:随着热化学循环次数增多,可以观察到NiFe2O4表面逐渐出现裂纹,同时通过表1发现在多次热循环中其两定点间相对距离略有增加,这是因为在热化学循环过程中,NiFe2O4在热能的驱动下轻微烧结。烧结使铁氧体暴露于水蒸气的表面积减小,活性中心数量减少,同时随着热化学循环次数增加,催化剂的活性降低,这是水解制氢质量浓度减少的原因。在该温度下材料表面基本很少发生NiFe2O4的脱落,因而其氢气质量浓度下降趋势较缓。相比于1 200 ℃下的还原,其氢气质量浓度有了显著提高。

图9 不同次数热化学循环后的显微形貌(1 250 ℃)Fig.9 Micrographs under different thermochemical cycles(1 250 ℃)
图10,11分别为还原温度1 300,1 400 ℃,水解温度1 000 ℃,多孔氧化铝陶瓷担持的NiFe2O4在不同次数热化学循环后的显微形貌。由图10,11可以发现:当还原温度达到1 300 ℃及以上时,随着热化学循环次数的增多,NiFe2O4粉体烧结明显并聚集结块,材料表面的脱落现象也很明显,这正是图6中氢气质量浓度急剧下降的原因。烧结进行到一定程度后,铁氧体的收缩率明显增大,由于多孔Al2O3基体的固着作用,铁氧体层的收缩受到牵制,不能沿着基体的表面自由地移动,这是铁氧体层产生开裂和脱落的直接原因。如果大面积发生铁氧体的脱落,将导致氢气质量浓度的断崖式下降,因此,必须降低热循环的温度以抑制铁氧体的烧结和开裂、脱落。

图10 不同次数热化学循环后的显微形貌(1 300 ℃)Fig.10 Micrographs under different thermochemical cycles(1 300 ℃)

图11 不同次数热化学循环后的显微形貌(1 400 ℃)Fig.11 Micrographs under different thermochemical cycles(1 400 ℃)
综上,当还原温度在1 200 ℃及以下时,催化剂热化学循环制氢质量浓度较低,不适宜水解制氢。当还原温度为1 250 ℃时,水解制氢质量浓度较1 200 ℃时有一定程度的提高。而当还原温度在1 300 ℃及以上时,催化剂的脱落导致氢气质量浓度断崖式下降,应适当降低还原温度以循环使用。综合考虑制氢质量浓度与循环寿命,将还原温度设定在1 250 ℃时可获得较优的使用价值。
3 结 论
比较了多孔氧化铝陶瓷担持镍铁氧体与掺杂氧化锆作为阻隔剂的镍铁氧体的制氢效果,结果表明:利用多孔氧化铝陶瓷担持镍铁氧体,可明显抑制镍铁氧体粉体的烧结,从而延缓氢气质量浓度的衰减,提高循环寿命。综合考虑制氢质量浓度与循环寿命,将还原温度设定在1 250 ℃时可获得较优的使用价值。今后可以在使用多孔结构担持的基础上,通过加入其他金属元素以进一步降低铁氧体的分解释氧温度,提高两步式热化学循环制氢的经济性。

