怀玉山高山马铃薯蔗糖合酶基因的克隆和分析
洪森荣,邓雨晴,吴洪婷,陈 婷,郭淑贞,杨于萱,蔡 红,陈荣华
(1. 上饶师范学院生命科学学院,江西 上饶 334001;2. 上饶市药食同源植物资源保护与利用重点实验室,江西 上饶 334001;3. 上饶市薯芋类作物种质保存与利用重点实验室,江西 上饶 334001;4. 上饶农业技术创新研究院,江西 上饶 334001;5. 上饶市红日农业开发有限公司,江西 上饶 334700)
0 引言
【研究意义】马铃薯(Solanum tuberosum L.)为茄科茄属(Solanum L.)双子叶一年生植物,原产于南美洲安第斯山区,是全球仅次于水稻、小麦、玉米的第四主粮作物,是全球最重要的块茎类作物,也是重要的粮菜兼用作物和工业原料[1−2]。马铃薯营养丰富,可实现周年供应,可作粮用、菜用、饲用[3]。玉米、小麦、水稻易受限于气候、水肥等条件,而马铃薯在偏远缺水地区仍可实现丰产,且产业链长,开发前景广阔,是我国脱贫攻坚的助力产业[3]。中国是第一大马铃薯生产国,种植面积和产量均居世界首位,在缓解我国食物压力、保障我国粮食安全方面作用突出[3]。高山马铃薯食用价值和营养价值高,管理成本和种植技术低,且高山马铃薯对高山地区环境适应能力强,可在高海拔山区推广种植,具有较强的产业化潜力[4]。江西怀玉山属于高海拔高山地区,紫外线强烈,昼夜温差大,马铃薯品种应选择早熟型,如怀玉山高山马铃薯(S. tuberosum L.cv. Huaiyushan)[5]。怀玉山高山马铃薯,又称麻籽洋芋,国家地理标志农产品(2013年)。怀玉山高山马铃薯药食兼优。食用,形椭圆,具麻点,色黄肉白(属于外观品质),营养丰富,切后不黑,味甘爽口,实为一道天然美味佳肴;药用,不含还原糖,富含膳食纤维,可和中养胃、健脾利湿、降糖降脂、美容养颜、防治胃癌[6]。蔗糖是运输和贮存光合碳水化合物的主要形式,是植物糖代谢的中心调控枢纽[7]。蔗糖合酶(Sucrose synthase,SuSy)可分解蔗糖,也可合成蔗糖,具有双重属性[8],主要参与植物韧皮部代谢、碳源分配、纤维素和淀粉合成,还可影响植物抗逆性、种子发育、果实品质形成、生殖生长、糖信号转导以及生物固氮能力,为植物体生长发育提供碳源和能量动力[9]。因此,分析怀玉山高山马铃薯蔗糖合酶的核酸序列信息,预测其蛋白结构与功能,对进一步揭示该酶生物学功能具有重要指导意义。【前人研究进展】目前已在苹果[10]、苦荞[11]、毛白杨[12]、木薯[13]和白及[14]等多种高等植物中分离得到了蔗糖合酶基因。而关于怀玉山高山马铃薯的研究主要集中于全基因组重测序分析[15]、转录组分析[5]、DNA甲基化MSAP分析[6]、遗传多样性同工酶分析[16]、脱毒方法[17]和病毒DAS-ELISA检测与分析[18]等研究。【本研究切入点】但有关怀玉山马铃薯蔗糖合酶基因结构与功能的研究还未见报道。【拟解决的关键问题】本研究通过从构建的怀玉山马铃薯转录组数据库中挑选蔗糖合酶基因序列(SuSy 4,PDSC Gene ID:PGSC0003DMG400002895,PDSC Transcript ID:PGSC0003DMT400007506,iTAG Transcript ID:Sotub12g008670.1.1,NCBI Reference Sequence/GenBank:M18745.1,Locus At:At3g43190),利用在线生物信息学分析软件分析蔗糖合酶基因序列的氨基酸序列、理化性质、蛋白二级结构、结构功能域、三级结构、亚细胞定位,为分析蔗糖合酶保守结构域提供基础资料,为马铃薯蔗糖合酶的进一步研究提供生物信息学方面的参考。
1 材料与方法
1.1 材料和试剂
怀玉山高山马铃薯试管苗(上饶师范学院生命科学学院植物组织培养室提供)、Trizol总RNA提取试剂、PCR反应2×GoldStarTaqMasterMix购自北京康为世纪公司;M-MLV cDNA第一链合成试剂、PrimeScript®RT Reagent Kit With gDNA Eraser(Perfect Real Time)、PMD18-T vector及SYBR® Premix Ex TaqTM II均购自TaKaRa公司;Gel Extraction Kit购自Omega公司;引物由上海生工生物工程有限公司合成。大肠杆菌(E. coli)DH5α 由本实验室保存;其 他常规试剂均为国产分析纯试剂。
1.2 试验方法
1.2.1 总RNA的提取和cDNA第一链的合成 用Trizol试剂提取怀玉山高山马铃薯试管苗的总RNA,提取步骤按说明书进行,使用紫外分光光度计和琼脂糖凝胶电泳检测RNA的浓度和完整性。以提取获得的RNA为模版,按照M-MLV cDNA第一链合成试剂盒说明书合成cDNA第一链。逆转录引物用Oligo(dT)18 Primer:5′-GGCCACGCGTCGACTA GTACTTTTTTTTTTTTTTTTTT-3′,具体步骤按说明 书进行。
1.2.2 怀玉山高山马铃薯蔗糖合酶基因的克隆 利用怀玉山高山马铃薯试管苗转录组数据库筛选到蔗糖合酶基因的核心片段(CDS全长),运用Primer Premier 5.0设计基因特异性引物(F:ATGGCTGAA CGTGTTCTGACTC;R:TCACTCAGCAGCCAATGGA AC)。PCR扩增条件:95 ℃ 2 min;95 ℃ 30 s,55 ℃30 s,72 ℃ 2.5 min,35个循环;72 ℃ 10 min。PCR产物经1%琼脂糖凝胶电泳检测后,将含有目的基因的条带与pMD19-T载体连接并用热激法转化到感受态细胞E.coli DH5α,经鉴定正确的阳性转化子提取质 粒送往上海生工进行测序。
1.2.3 怀玉山高山马铃薯蔗糖合酶基因的生物信息学分析 按照张林等[19]的方法对怀玉山高山马铃薯蔗糖合酶进行氨基酸序列分析、理化性质分析、结构预测、功能分析。使用BioEdit软件翻译4个基因序列为氨基酸序列,用ProtParam(https://web.expasy.org/protparam/)预测蛋白的理化性质,用ProtScale(https://web.expasy.org/cgi-bin/protscale/protscale.pl)预测蛋白疏/亲水性。使用GOR IV软件(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_gor4.html)在线预测蛋白质二级结构。使用SWISS-MOLD(http://www.swissmodel.expasy.org/interac)在线预测蛋白的三级结 构。
2 结果与分析
2.1 怀玉山高山马铃薯RNA提取
怀玉山高山马铃薯试管苗总RNA的电泳图见图1。RNA条带清晰,无色素、蛋白、糖类等杂质污染,28/23S亮度大于18/16S,浓度为602.00 ng·μL−1,总量为18.06 μg,RIN值=8.4,OD260/280=2.17,OD260/230=2.22,表明提取的RNA较为完整,质量较高,可以进 行后续实验。
2.2 怀玉山高山马铃薯蔗糖合酶基因cDNA序列
通过PCR扩增技术(图2),怀玉山高山马铃薯蔗糖合酶基因cDNA总长度为2 418 bp(图3),G+C 含量为45.08%。
2.3 怀玉山高山马铃薯蔗糖合酶蛋白氨基酸序列

图 1 怀玉山高山马铃薯总RNA的电泳Fig. 1 Electrophoresis of total RNA from Alpine potato of Huaiyushan

图 2 怀玉山高山马铃薯蔗糖合酶基因PCR扩增Fig. 2 PCR amplification of SuSy gene in Alpine potato of Huaiyushan
Protparam预测显示怀玉山高山马铃薯蔗糖合酶蛋白氨基酸序列见图4。怀玉山高山马铃薯蔗糖合酶蛋白由805个氨基酸组成,分子量92 471.33 Da,等电点5.87,为亲水性蛋白。Leu、Glu、Val、Ala、Lys、Ile、Gly和Arg是怀玉山高山马铃薯蔗糖合酶SuSy氨基酸序列中含量最为丰富的氨基酸,其平均含量分别为11.1%、9.3%、6.6%、7.0%、6.3%、6.0%、5.7%和5.5%,不含Pyl和Sec(表1)。带负电残基总数(Asp+Glu)为114,正电荷残基总数(Arg+Lys)为95。估计半衰期为30 h(哺乳动物网织红细胞,体外),>20 h(酵母,体内),>10 h(大肠杆菌,体内)。哺乳动物与酵母、大肠杆菌酶的半衰期差异较大,主要受氨基末端氨基酸残基(如Met、Ala、Glu等)影响。怀玉山高山马铃薯蔗糖合酶蛋白失稳指数(II)计算为33.96,组氨酸(His)、天冬氨酸(Asp)、精氨酸(Arg)、谷氨酸(Glu)、赖氨酸(Lys)5种氨基酸残基构成酶的活性中心,与酶的稳定性相关,表明怀玉山高山马铃薯蔗糖合酶蛋白分类为稳定的。

图 3 怀玉山高山马铃薯蔗糖合酶基因碱基组成Fig. 3 Base composition of SuSy gene in Alpine potato of Huaiyushan

图 4 怀玉山高山马铃薯蔗糖合酶蛋白氨基酸序列Fig. 4 Amino acid sequence of SuSy in Alpine potato of Huaiyushan
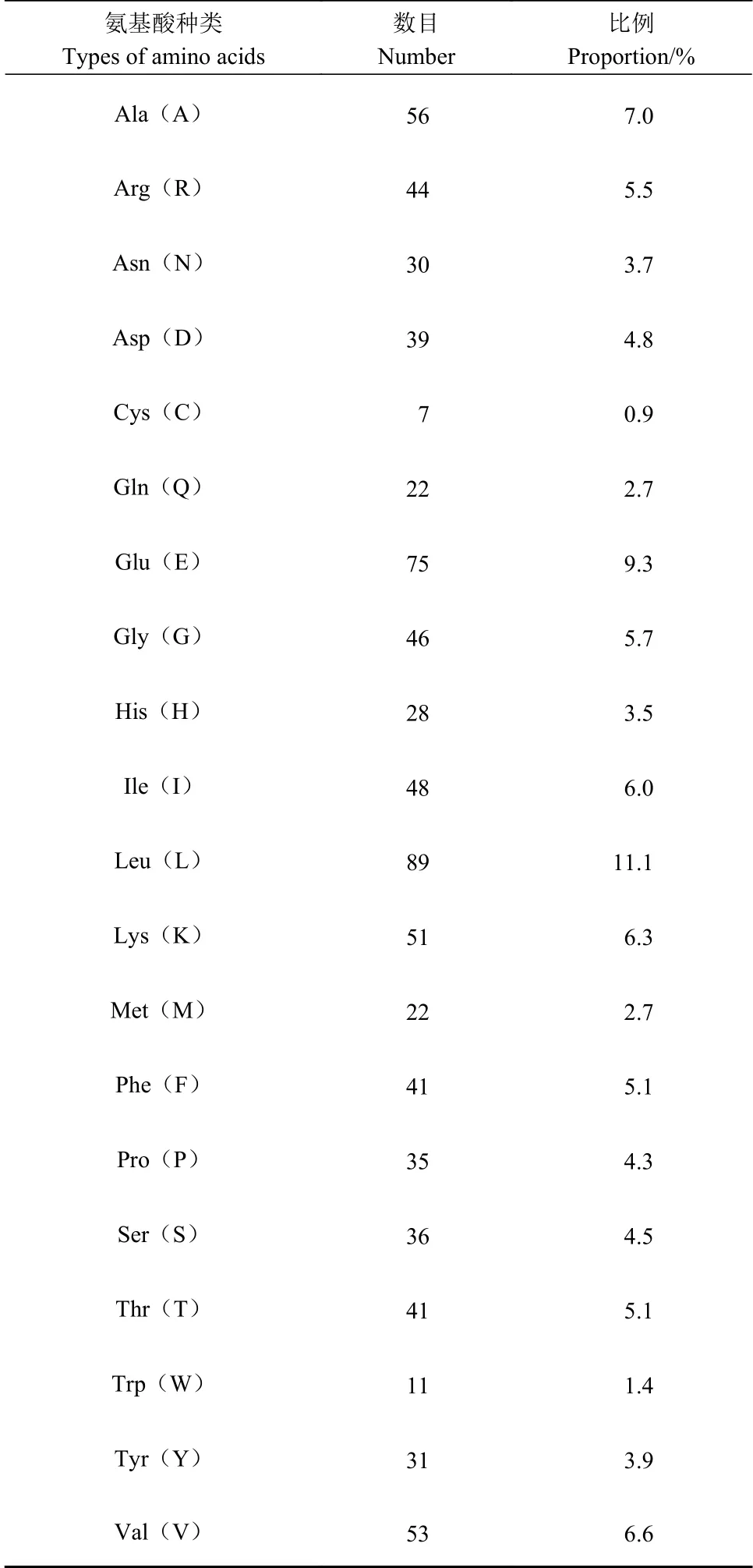
表 1 怀玉山高山马铃薯蔗糖合酶蛋白各氨基酸的数目和比例Table 1 Number and proportion of amino acids of SuSy in Alpine potato of Huaiyushan
2.4 怀玉山高山马铃薯蔗糖合酶蛋白亲疏水性分析
从图5可知,高峰值(正值)的区域表示疏水的区域,而低谷(负值)的区域是亲水区域。疏水性结果分析表明,最大疏水值为2.5左右,在该多肽中说明该处的疏水性最强;亲水峰最大值为−3左右,整个蛋白质表现出高度的亲水性,说明该蛋白为亲水性蛋白质。

图 5 怀玉山高山马铃薯蔗糖合酶蛋白亲疏水值分布Fig. 5 Distribution of relative and sparse water values of SuSy in Alpine potato of Huaiyushan
2.5 怀玉山高山马铃薯蔗糖合酶二级结构分析
怀玉山高山马铃薯蔗糖合酶的二级结构(图6)预测如下:GOR预测显示其二级结构由α-螺旋(Alpha helix,Hh,45.84%)、延 伸 链(Extended strand,Ee,15.16%)、无规则卷曲(Random coil,Cc,39.01%)构成(图7)。从分布位点上来看,C端和N端含延伸链和α-螺旋,而无规则卷曲、延伸链和α -螺旋则散布于整个蛋白质中。
2.6 怀玉山高山马铃薯蔗糖合酶三级结构分析
SWISS-MODEL预测显示怀玉山高山马铃薯蔗糖合 酶的三级结构为四聚体(图8)。
2.7 怀玉山高山马铃薯蔗糖合酶亚细胞定位
采用Psort在线软件对怀玉山高山马铃薯蔗糖合酶的表达部位进行预测,结果表明:定位于细胞质中的数量为5,线粒体中的数量为5,叶绿体中的数量为4,表明怀玉山高山马铃薯蔗糖合酶主要存在细胞 质、线粒体和叶绿体中。
2.8 怀玉山高山马铃薯蔗糖合酶系统进化分析
从构建的进化树(图9)中可见,怀玉山高山马铃薯与Solanum lycopersicum(番茄)、Solanum pennellii(潘那利番茄)、Solanum chilense(智利番茄)、Solanum tuberosum(马 铃 薯)、Capsicum annuum(辣椒)、Capsicum baccatum(风铃辣椒)等6种植物在一个大分支下,这说明怀玉山高山马铃薯蔗糖合酶基因在进化上与六者的亲缘关系较近,尤其是与马铃薯(Solanum ltuberosum)的进化上具有最高的亲缘关系。

图 6 怀玉山高山马铃薯蔗糖合酶二级结构Fig. 6 Secondary structure of SuSy in Alpine potato of Huaiyushan

图 7 怀玉山高山马铃薯蔗糖合酶二级结构各部分的比例Fig. 7 Proportion of various parts in secondary structure of SuSy in Alpine potato of Huaiyushan

图 8 怀玉山高山马铃薯蔗糖合酶三级结构Fig. 8 Tertiary structure of SuSy in Alpine potato in Huaiyushan
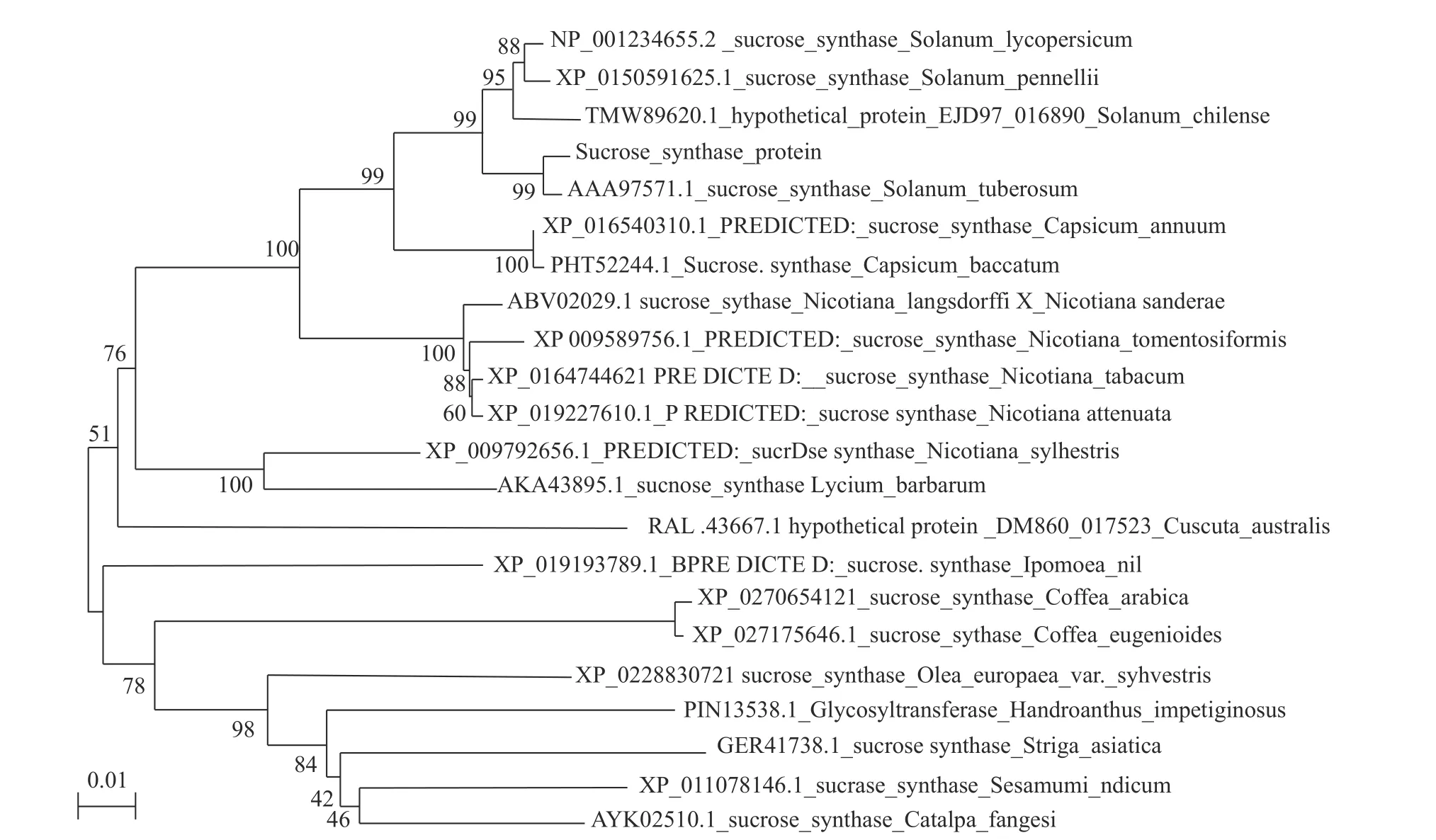
图 9 怀玉山高山马铃薯蔗糖合酶系统进化分析Fig. 9 Phylogenetic analysis of SuSy in Alpine potato of Huaiyushan
3 讨论
蔗糖合酶属于蔗糖代谢的关键酶,广泛存在于植物体内,负责催化蔗糖和UDP-果糖合成UDPG,也负责催化UDPG分解为蔗糖和UDP-果糖的反应[20]。蔗糖合酶与蔗糖代谢其他酶(转化酶、蔗糖磷酸合酶等)的不同处在于其可催化可逆反应,不需耗能且不需其他酶参与,直接参与植物体内的生物合成及利用[21]。
植物由于长期适应环境得到不断进化,但执行一定生理功能的基因会显得相对保守,因此,利用氨基酸序列构建的系统进化分析可确定物种之间的亲缘关系,还以此来评估蛋白功能的相关性[22]。本研究对怀玉山高山马铃薯(S. tuberosum L. cv.Huaiyushan)蔗糖合酶进行系统进化分析,表明怀玉山高山马铃薯(S. tuberosum L. cv. Huaiyushan)与番茄(Solanum lycopersicum)、潘那利番茄(Solanum pennellii)、智利番茄(Solanum chilense)、马铃薯(Solanum ltuberosum)、辣椒(Capsicum annuum)、风铃辣椒(Capsicum baccatum)等6种植物在一个大分支下,这说明该基因在进化上与这六者的亲缘关系较近,尤其是与马铃薯(Solanum ltuberosum)的进化上具有最高的亲缘关系。
蔗糖合酶(SuSy)是蔗糖分解的关键酶,被认为是衡量库强的生化指标,特别是在作物品种中。通过在棉花中表达马铃薯Sus基因,发现在Sus高表达系的幼叶中,果糖含量显著增加,而在伸长纤维中,果糖和葡萄糖含量均增加[23]。在转基因马铃薯中,蔗糖合成酶(Susy)的表达通过引入一个包含Susy编码区的嵌合基因而改变,Susy活性和淀粉含量增加[24]。随着对马铃薯蔗糖合酶的深入研究,马铃薯蔗糖合酶以不同亚型形式存在,这些亚型至少由两个基因编码,甚至更多,至今已在45种植物中发现超过80个Sus基因[25]。马铃薯蔗糖合成酶基因Sus4-16的5′侧翼序列、先导内含子和3′序列的3.6 kb和0.7 kb足以在发育中的块茎、腋芽和芽的基部组织、分生组织和根冠中诱导高水平表达,并赋予叶片蔗糖诱导能力[26]。在马铃薯中发现了两类不同的蔗糖合成酶基因Sus3和Sus4。根据序列同源性,它们似乎是在双子叶植物主要科分化之后、番茄和马铃薯分化之前进化而来的[21]。这个观点与本试验结果一致。也有研究表明,马铃薯蔗糖合酶与玉米蔗糖合酶cDNA序列相比,核苷酸序列的同源性约为70%,推导的氨基酸序列约为75%,3个氨基酸区的同源性约为90%[27]。蔗糖合酶通常以二聚体和四聚体的形式存在[28],但四聚体形式存在的蔗糖合酶是有活性的存在形式[29]。研究表明,马铃薯蔗糖合酶的N端的细胞靶向结构域(cellular targeting domain,CTD)结构域可以使酶与细胞内的肌动蛋白纤维、线粒体及液泡膜等相结合,参与细胞靶向的调控[30]。利用原位杂交技术研究马铃薯淀粉代谢相关基因的表达的影响,结果发现蔗糖合酶基因在块茎中表达,但在块茎形成的顶端分生组织或匍匐茎中不表达,编码颗粒结合淀粉合成酶和淀粉分支酶的mRNAs主要在淀粉质体周围积累,而编码蔗糖合成酶的mRNAs没有显示出优先分布[31]。本研究采用Psort在线软件对怀玉山高山马铃薯(S. tuberosum L. cv.Huaiyushan)蔗糖合酶的表达部位进行预测,结果表明怀玉山高山马铃薯(S. tuberosum L. cv. Huaiyushan)蔗糖合酶主要存在细胞质、线粒体和叶绿体中,并没有优先分布在某个部位。
4 结论
怀玉山高山马铃薯蔗糖合酶具有典型蔗糖合酶的结构特征,其氨基酸序列和核酸序列与同源物种相似度高,在进化上高度保守。

