双孢蘑菇W192液体菌种摇瓶培养过程中的生理生化分析
戴建清
(福建省农业科学院食用菌研究所/特色食用菌繁育与栽培国家地方联合工程研究中心,福建 福州 350014)
0 引言
【研究意义】双孢蘑菇(Agaricus bisporus)是世界上目前栽培地域最广、生产规模最大、产量最多的一种著名食用菌,有“世界菇”之称[1]。据统计,2018年我国的双孢蘑菇年产量达300多万t,所需栽培种用量近7.2万t。双孢蘑菇W192是采用同核不育株间杂交技术选育而成,高产优质形状表现稳定,适合工厂化栽培,于2012年获得福建省新品种认定(闽认菌2012007)[2]。目前,双孢蘑菇菌种主要通过母种、原种、栽培种三级固体菌种进行逐级扩繁。相对固体菌种,液体菌种具有培养时间短、发菌快、菌龄整齐一致、接种方便等优点,利于食用菌自动化、工厂化、规模化生产。近年来,液体菌种被广泛地应用在工厂化食用菌生产如金针菇、杏鲍菇、海鲜菇等[3−5],与自动化接种设备相结合,推动了食用菌产业的快速发展。国内外食用菌研发机构和生产企业加大了对液体菌种的投入和研发力度[6]。因此,为提高双孢蘑菇制种自动化、工厂化生产水平,丰富双孢蘑菇菌种生产工艺,对双孢蘑菇液体菌种的研究具有重要意义。【前人研究进展】1948年,Humfeld[7]和Dijkstra等[8]对蘑菇开展了液体发酵培养的研究,并指出液体培养的菌丝体适宜作为蘑菇培养的菌种。目前双孢蘑菇液体菌种的研究,如液体培养基和培养条件的优化等[9−13],已较为清楚,但尚未全面系统地掌握双孢蘑菇液体培养过程中生理生化变化规律,进而液体菌种作为原种扩繁栽培种也仅限于实验室条件下的小规模使用。【本研究切入点】摇瓶菌种作为一级菌种,是发酵罐培养获得活力旺盛的二级液体菌种的关键。双孢蘑菇液体培养过程中的生理生化指标反映菌丝体物质代谢情况,根据生理生化指标,判断出菌丝体所处的生长阶段。通过分析双孢蘑菇摇瓶菌种的生理生化指标,掌握摇瓶液体发酵培养的液体种子生长规律,突破液体菌种在实验室条件下的瓶颈,为在工厂化条件下利用液体菌种大规模扩繁生产双孢蘑菇栽培种奠定基础。【拟解决的关键问题】本研究通过对双孢蘑菇W192液体种子摇瓶培养过程中的菌丝体生物量、菌丝球数量和直径、发酵液pH值、还原糖和氨基氮含量、胞外酶活性等主要生理指标进行测定分析,判断培养终点,以期获得菌丝体生物量大、菌丝球数量多、质量好、活力强的液体种子用于发酵罐深层发酵培养二级液体原种。
1 材料与方法
1.1 试验材料
1.1.1 供 试 菌 株 双 孢 蘑 菇(Agaricus bisporus)W 192,由福建省农业科学院食用菌研究所育种室提供。
1.1.2 液体种子培养基配方 葡萄糖5 g·L−1,小米粉7.5 g·L−1,蛋白胨2 g·L−1,黄豆粉5 g·L−1,MgSO4·7 H2O 0.75 g·L−1,KH2PO42 g·L−1。
1.1.3 主要仪器 奥林巴 斯显微 镜CX22LEDRFS1、奥豪斯pH计STARTER3100、紫外分光光度计UV-1300、电子分析天平FA1104、洁净工作台SW-CJ-2 F、恒温摇床BSD-YX2200、生化培养箱SPX-250B-Z。
1.1.4 试验试剂 无水葡萄糖、硫酸镁、磷酸二氢钾 等,分析纯,西陇化工股份有限公司生产。
1.2 试验方法
1.2.1 菌种活化 从保藏的试管菌种中切出0.2 cm×0.2 cm大小的菌块接种于PDA平皿,24 ℃恒温培养 20 d。
1.2.2 液体种子培养 250 mL三角瓶装液量100 mL,于121 ℃、0. 12 MPa 压力下灭菌30 min,冷却后将活化的PDA母种用打孔器打出直径1 cm大小的菌块,每瓶接2块菌块,在24 ℃、180 r·min−1的培养振荡器上旋转振荡培养,每隔2 d随机取3瓶检测各项指 标。
1.2.3 菌丝体生物量测定 取10 mL发酵液,在10 000 r·min−1下,离心10 min,弃上清液,菌丝体经蒸馏水洗涤3次后,将菌丝体在60 ℃烘干至恒重,电子分 析天平称重,重复3次,取平均数。
1.2.4 菌丝球数量测定 精密吸取1 mL培养液,用蒸馏水稀释10倍,再从中吸取1 mL悬浮液置于平皿中,皿下衬黑白相间方格纸计数,重复3次,取平 均数。
1.2.5 菌丝球直径测定 吸取0.1 mL稀释10倍的悬浮液置于载玻片上,用光学显微镜在低倍镜(4×10)下随机选取,测量菌丝球最长长度和最短长度,以菌丝球最长长度加最短长度的二分之一长度 即为菌丝球直径,重复3次,取平均数。
1.2.6 培养液pH值测定 用pH计直接置于培养液中 测量,重复3次,取平均数。
1.2.7 还原糖含量的测量 取不同培养时间的培养液,采用DNS法[14]测定还原糖含量,重复3次,取平 均数。
1.2.8 氨基氮含量的测量 取不同培养时间的培养液,采用茚三酮比色法[15]测定氨基氮含量,重复3 次,取平均数。
1 .2.9 培养液胞外酶活的测定
1.2.9.1 羧甲基纤维素酶(CMCase)活性测定 根据参考文献[16]羧甲基纤维素酶活力单位为: 以每毫升培养液中的酶量与底物作用30 min释放出1 mg葡萄 糖为1活力单位(U)。
1.2.9.2 淀粉酶活性测定 根据参考文献[16]淀粉酶活力单位定义为: 以每毫升培养液中的酶量与底物作用3 0 min 释放出1 mg葡萄糖为1活力单位(U)。
1.2.9.3 酸性蛋白酶活性测定 根据参考文献[17]酸性蛋白酶活力单位为:以每毫升培养液中的酶量与底物作用10 min 引起0.01个吸光值改变为1活力单位 (U)。
1.2.9.4 漆酶活性测定 根据参考文献[18]漆酶活力单位为:以每毫升培养酶液与底物作用30 min内改变0 .1个吸光值为1活力单位(U)。
2 结果与分析
2.1 不同培养时间菌丝体生物量的变化情况
培养基接种后,按照2、4、6、8、10、12 d培养时间,分别测量不同培养时间菌丝体干重生物量。结果表明培养初期,由于双孢蘑菇PDA母种菌丝块接入液体培养基,菌丝块沉没在培养液中体积变大,伴随回旋振荡释放菌丝片段,菌丝片段开始在培养液中萌发生长。从图1可以看出,培养时间0~4 d菌丝体生物量增长缓慢;培养至4~6 d,随着菌丝片段不断增多,菌丝球不断增大,菌丝体增长旺盛。培养至第8 d菌丝体生物量达到最高峰,达到9.7 mg·mL−1,与其他培养时间的菌丝生物量差异显著(P<0.05);随着发酵液中营养成分的减少、代谢产物的累积及菌丝活性的衰弱,导致部分菌丝体 发生自溶现象,菌丝体生物量逐渐下降。
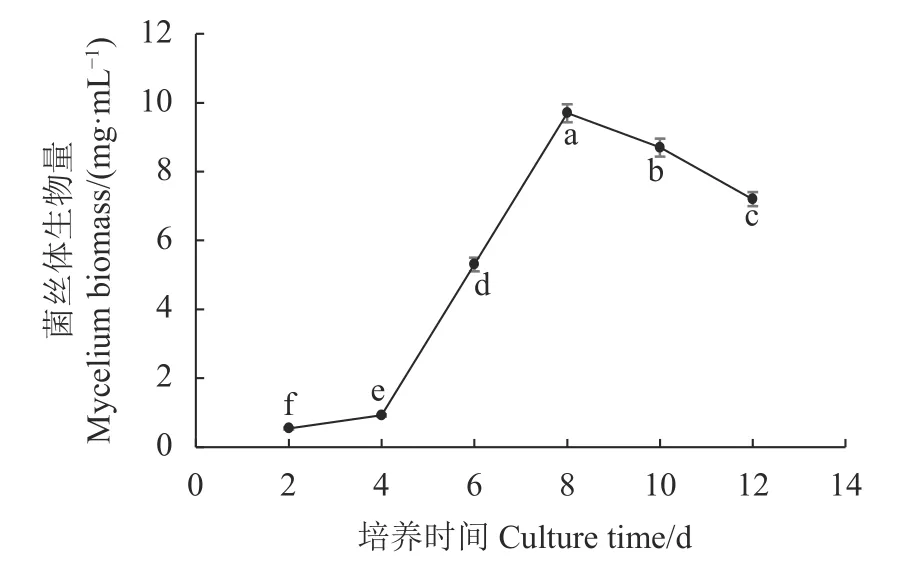
图 1 不同培养时间菌丝体生物量的变化Fig. 1 Changes on fungal biomass in flask culture
2.2 不同培养时间菌丝球数量的变化情况
作为液体种子,菌丝球的数量决定萌发点的数量,是液体菌种的重要生理指标。在2、4、6、8、10、12 d培养时间,分别统计不同培养时间的菌丝球数量,图2表明,培养时间0~4 d菌丝球数量增加缓慢;培养至4~6 d,随着从菌丝块断裂成菌丝片段增多,菌丝片段生长成菌丝球,菌丝球边缘菌丝再断裂在培养液中,每个菌丝片段变成生长点,繁殖形成新的菌丝球,此时培养液中的营养物质还很丰富,菌丝体的生长不受限制,表现为菌丝体生长旺盛期。到第8 d菌丝体数量达到最高峰,达880个·mL−1,与其他培养时间的菌丝球数量差异显著(P<0.05),之后随着培养液中营养成分的减少及菌丝活性的下降,部分菌丝体自溶,菌丝球数量逐渐下降。

图 2 不同培养时间菌丝球数量的变化Fig. 2 Changes on number of mycelium pellets in flask culture
2.3 不同培养时间菌丝球直径的变化情况
按照2、4、6、8、10、12 d培养时间,分别测量不同培养时间的菌丝球直径,图3显示,培养时间0~4 d菌丝球平均直径较小,主要是以菌丝片段出现,此时菌丝体生长处于迟滞期;培养时间4~6 d菌丝球平均直径逐渐增大,此时菌丝体处于对数生长期,表现为新生的菌丝团直径不断增大,且边缘形成绒毛状菌丝;培养时间6~8 d菌丝球平均直径趋于稳定,培养时间第8 d,菌丝球平均直径达0.809 mm,与其他培养时间的菌丝球平均直径差异显著(P<0.05),此时菌丝体生长处于平衡期,表现为菌丝球密集,边缘呈绒毛状突刺;随后菌丝球直径有所减小,此时处于衰退期,菌丝有自溶现象发生,菌丝体逐渐老化,菌球边缘变光滑。
2.4 不同培养时间培养液pH值的变化情况
pH值影响培养液营养成分及中间代谢物的解离、菌丝体细胞膜所带电荷和胞外酶酶活性,是双孢蘑菇液体培养的重要生化指标。按照培养时间,分别测定2、4、6、8、10、12 d的培养液pH值,根据测定结果,绘制双孢蘑菇W192液体种子生长过程中pH值的变化曲线图。图4显示,发酵液的pH值呈现先上升,后下降,再上升的变化规律。这可能是因为培养液初期由于菌丝对液体培养基质代谢产生碱性产物导致pH值略微上升,随后6~10 d培养时间,菌丝体对基质的分解生成部分有机酸,导致pH值略微下降;到培养末期,还原糖大量被消耗,同时菌丝球老化、自溶产生氨基氮等物质,从而使培养液的pH值有所升高。
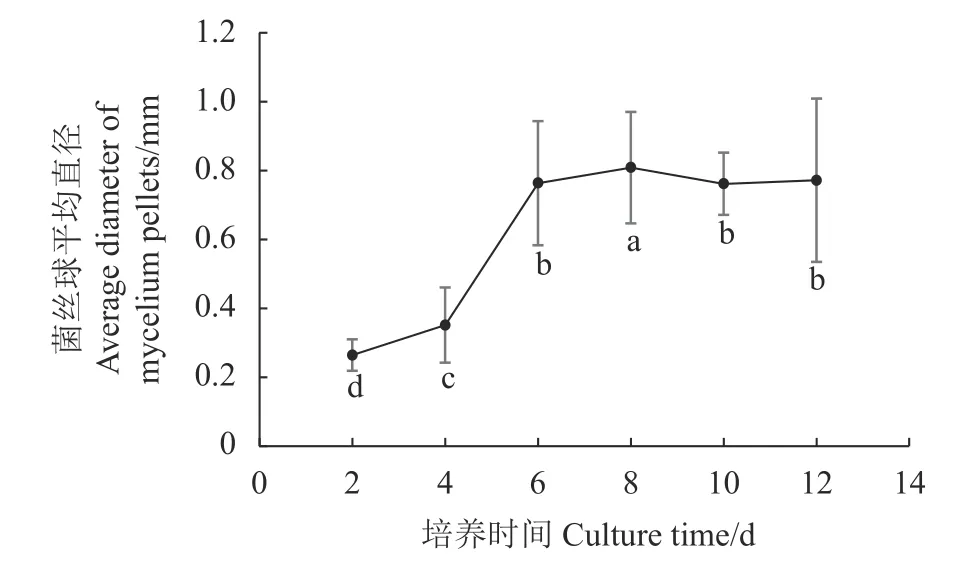
图 3 不同培养时间菌丝球直径的变化Fig. 3 Changes on mycelium pellet diameter in flask culture

图 4 不同培养时间培养液pH值的变化Fig. 4 Changes on medium p H in flask culture
2.5 不同培养时间还原糖含量变化情况
利用DNS法测定不同时间培养液还原糖含量,绘制培养液还原糖含量的变化曲线图。结果如图5所示,培养时间2~8 d,随着菌丝体生物量不断增加,菌丝体代谢生成的还原糖大于消耗的还原糖,表现为还原糖含量不断增加趋势;培养时间第8 d,培养液还原糖含量最高,与其他培养时间的培养液还原糖含量差异显著(P<0.05),培养时间8~12 d,随着菌丝体生物量到达最大,随后培养液中碳源物质不断被消耗,表现为还原糖含量不断下降趋势。
2.6 不同培养时间培养氨基氮含量变化情况
利用茚三酮法测定不同时间培养液氨基氮含量,绘制培养液氨基氮含量的变化曲线图。结果如图6所示,当培养至2 d,菌丝体生物量较少,分泌的胞外蛋白酶也较少,菌丝体主要利用培养液中的原始氨基氮,代谢消耗培养液中的原始氨基氮大于分解培养液中氮源物质生成的氨基氮,表现为氨基氮含量不断下降趋势;培养至6 d,培养液中氨基氮含量最低,随着菌丝体生物量不断增加,菌丝体分泌的胞外蛋白酶增多,为了满足菌丝体对氮源需求,代谢培养液中的氮源物质生成的氨基氮大于消耗的氨基氮,表现为氨基氮含量升高;培养至8 d,培养液中氨基氮含量最高,与其他培养时间的培养液氨基氮含量差异显著(P<0.05),培养时间8~12 d,随着菌丝体生物量到达最大,随后培养液中含氮物质不断被消耗,表现为氨基氮含量不断下降趋势。
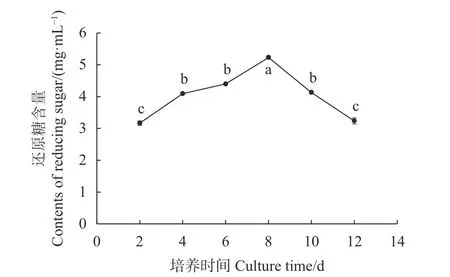
图 5 不同培养时间培养液还原糖含量的变化Fig. 5 Changes on reducing sugar in medium in flask culture
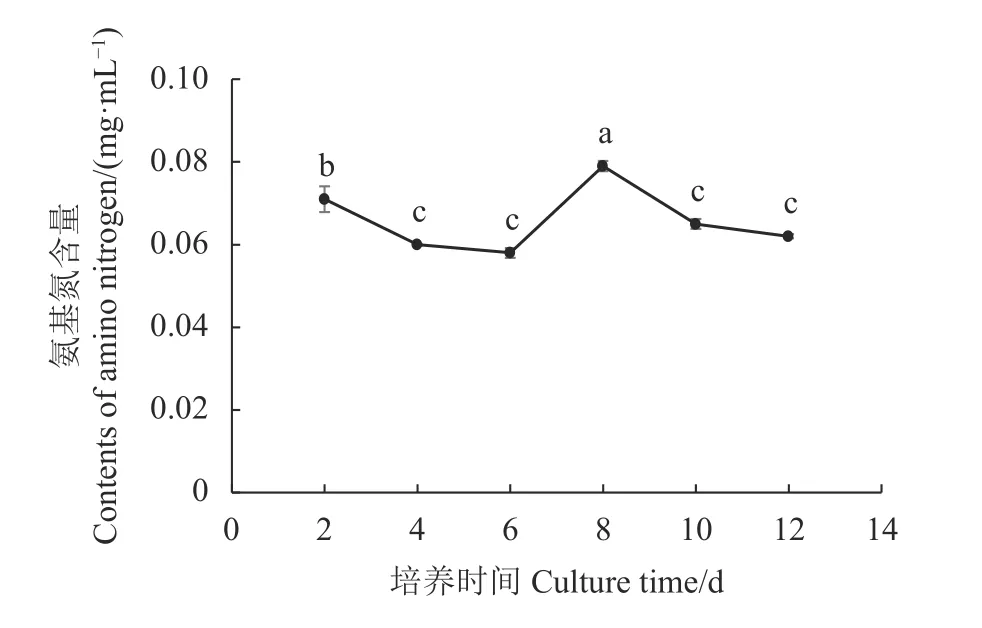
图 6 不同培养时间培养液氨基氮含量的变化Fig. 6 Changes on amino nitrogen in medium in flask culture
2.7 不同培养时间胞外酶酶活变化情况
按照2、4、6、8、10、12 d培养时间,分别测定培养液中羧甲基纤维素酶、淀粉酶、酸性蛋白酶和漆酶的酶活,根据测定结果,绘制双孢蘑菇W192液体种子生长过程中酶活性的变化曲线,如图7所示。结果表明,菌丝体分泌的羧甲基纤维素酶、淀粉酶和漆酶活性在8 d到达峰值,酸性蛋白酶在10 d到达峰值。在深层培养的2~4 d内,菌丝体处于萌发状态,对胞外酶的分泌处于调整期,胞外酶酶活的增长比较缓慢。在培养4~6 d内,菌丝体开始进入生长旺盛期,此时菌丝的分裂增殖速度加快,分泌大量的胞外酶以分解培养液中的营养物质,此时的胞外酶酶活开始增加,培养到第8 d,羧甲基纤维素酶、淀粉酶和漆酶活性达到峰值,此时羧甲基纤维素酶酶活为0.69 U,淀粉酶酶活为2.11 U,漆酶酶活为15.02 U,其中第8 d的漆酶活性与其他培养时间的漆酶活性差异显著(P<0.05)。第8 ~10 d,菌丝体处于生长的平衡时期,氮源成分被大量消耗,通常认为蛋白酶是在基质中可吸收氮源缺乏的情况下,为了获得蛋白质中的氮素而产生的[19]。因此,酸性蛋白酶被大量诱导出来,活性达到峰值,酶活为2.93 U,其他胞外酶活性逐渐减弱。随后菌丝体进入生长衰亡期,对胞外酶活的分泌也急速下降,此时菌丝球的活力逐渐减弱。

图 7 不同培养时间胞外酶酶活性的变化Fig. 7 Changes on extracellular enzyme activities in flask culture
2.8 液体种子活力验证
分别将2、4、6、8、10、12 d培养时间的液体种子转接至250 mL三角瓶装液量为100 mL的液体培养基中进行模拟发酵罐液体菌种培养,接种量1%,在24 ℃、180 r·min−1的培养振荡器上旋转振荡培养,培养6 d,计算菌丝球数量和菌丝体生物量,试验结果如图8、9所示,培养8 d的液体种子转接液体培养基获得的菌丝球数量最多,达115个·mL−1,与培养时间为2、4、6、10、12 d的液体种子对液体菌种菌丝球数的影响呈显著性差异(P<0.05);同时,培养8 d的液体种子转接液体培养基获得的菌丝体生物量最大,达7.56 mg·mL−1,虽与培养6 d的液体种子转接液体培养基获得的菌丝体生物量的差异不显著(P>0.05),但与培养时间为2、4、10、12 d的液体种子获得的菌丝体生物量的差异显著(P<0.05)。验证试验结果表明,培养8 d的液体种子活力最强,可作为发酵罐培养的种源扩繁液体原种。
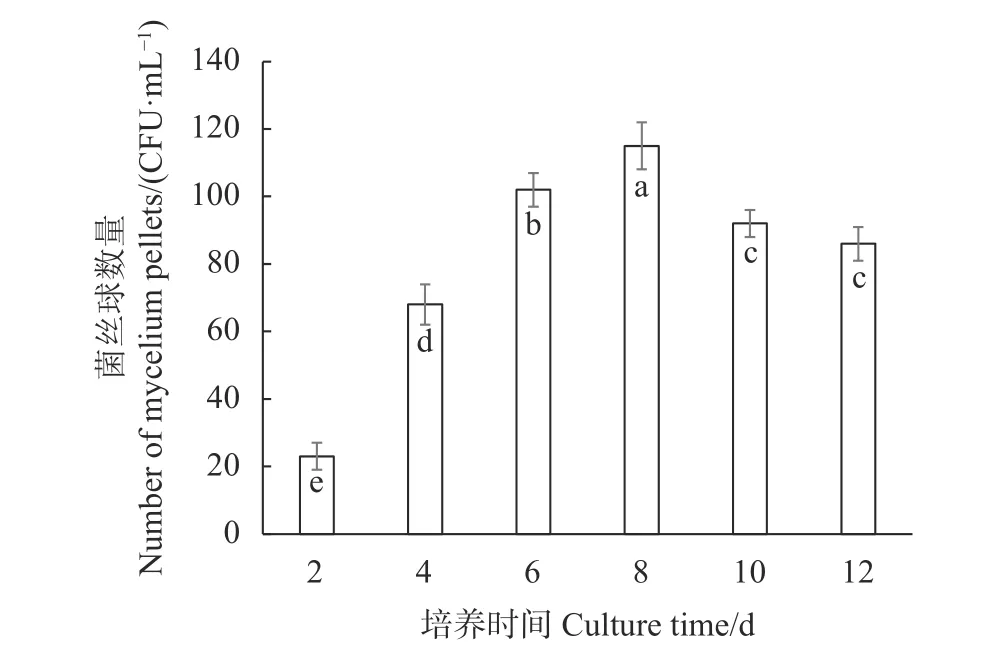
图 8 不同培养时间的液体种子对液 菌种菌丝球数量的影响Fig. 8 Effect of culture time on number of mycelium pellets
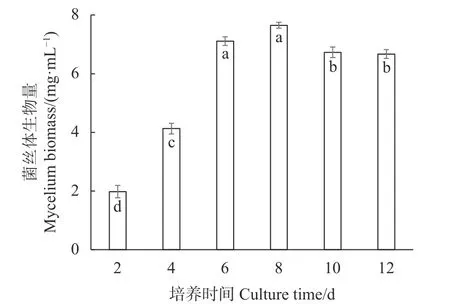
图 9 不同培养时间的液体种子对液体菌种菌丝生物量的影响Fig. 9 Effect of culture time on fungal biomass
3 讨论与结论
双孢蘑菇W192液体种子摇瓶培养过程中,菌丝体生物量、菌丝球数量、平均直径、还原糖和氨基氮含量等生理生化指标在第8 d均达到峰值,随后随着培养液中营养成分的减少以及菌丝活性的减弱,以上5种生理指标开始下降,到第12 d,菌丝体老化,并产生自溶现象,这符合双孢蘑菇液体培养的一般生长规律,也反映出第8 d的双孢蘑菇菌丝体活力最高,若继续培养则菌丝体活力下降。同时羧甲基纤维素酶、淀粉酶、酸性蛋白酶和漆酶的酶活性生化指标也具有相同的变化趋势,说明胞外酶的酶活变化规律与菌丝体生长趋势基本符合。在整个摇瓶培养过程中,甲基纤维素酶、淀粉酶和酸性蛋白酶活性的变化不明显,而漆酶活性变化明显。漆酶是降解木质素大分子物质的主要酚氧化酶,能加速木质素芳香族高分子化合物的分解,提供菌丝所需的营养,漆酶活性越高,菌株分解能力越强[19]。因此,漆酶活性可作为反映双孢蘑菇菌丝体活性的指标,也可作为有效可靠的检测指标。孙建华等[20]对丝状真菌发酵过程中的形态学研究指出:菌丝体
形态的变化影响其在液体培养环境下营养的消耗和摄氧率,进而影响菌丝体继续生长以及代谢产物的生成,因此后续研究有必要从生理形态学角度研究菌丝生长规律及形态变化和各生理指标的关系。综上所述,本试验结果为双孢蘑菇W192液体种子摇瓶培养过程的控制提供了比较可靠的技术参数,并确定培养终点为第8 d,可以获得菌丝活力旺盛、生物量大的液体种子用于扩繁发酵罐液体菌种。

