烟草花叶病毒P54基因的原核表达与蛋白纯化
李 聪,田培洁,张 宇,张德咏,,刘 勇,,张松柏, *
(1. 湖南大学研究生院隆平分院,湖南 长沙 410125;2. 湖南农业大学植物保护学院,湖南 长沙 410120;3. 湖南省农业科学院植物保护研究所,湖南 长沙 410125)
0 引言
【研究意义】烟草花叶病毒(Tobacco mosaic virus,TMV)属帚状病毒科(Vigaviridae)科烟草花叶病毒属 Tobamovirus病毒,可侵染36个科的400多种植物,每年给全世界农作物造成的经济损失估计1亿美元以上[1]。TMV的基因组为一条正义单链RNA,其基因组长度约6 400 bp,编码1个结构蛋白和2个非结构蛋白;其中TMV P183基因中,编码一个假定的P54基因[2],其功能目前还鲜见报道。【前人研究进展】TMV基因组第一个核苷酸连有一个7Gppp的帽子结构,紧接着是一个含有69个核苷酸的非翻译前导序列,编码TMV复制所需的专一性复制酶。从启动子到第一个终止密码子可翻译为P126蛋白,P126蛋白的C端有类似于螺旋酶和甲基转移酶的基本结构[3],其主要功能是参与TMV复制。然而仅有P126蛋白存在时,TMV不能完成复制,表明TMV还编码其他蛋白参与其基因组复制[2]。通读P126基因的终止密码子,可翻译为P183蛋白,P183蛋白具有RNA依赖的RNA聚合酶结构,在TMV侵染后20~30 min就能合成足量的该蛋白,参与TMV基因组RNA复制,而仅有P183蛋白存在时,TMV的复制效率非常低[2]。此外,在这个读通区域中有一个起始密码子和一个开放阅读框(ORF),编码了假定的P54蛋白,预测其功能与TMV的复制相关[4],然而,P54蛋白的功能,尚无研究证实。【本研究切入点】为研究P54蛋白的功能,需要对P54蛋白进行原核表达并分离纯化,获得大量的P54蛋白。【拟解决的关键问题】研究表明,植物病毒编码的基因,在E coli中原核表达,通常以包涵体形式存在,包涵体蛋白的复性纯化是获得有活性纯化蛋白的技术难题[5]。本研究对包涵体进行复性,脱盐后进行分离纯化,以期获得纯化的P54重组蛋白,为P54蛋白的功能研究奠定基础。
1 材料与方法
1.1 试验材料
TMV侵染三生烟(Nicotiana tabacum var. Samsun NN)叶片,本实验室保存;HiScript II One Step RT-PCR Kit(Dye Plus)购自南京诺唯赞生物科技公司;原核表达载体pEASY®-Blunt E1、大肠杆菌(Escherichia coli)BL21(DE3)感受态细胞购于全式金试剂销售有限公司(长沙);DNA凝胶纯化回收试剂盒购于OMEGA公司;蛋白纯化柱The Thermo Scientific™HisPur ™ Ni-NTA Spin Columns、一 抗6x-His Tag Monoclonal Antibody(HIS.H8)、二抗Goat anti-Mouse IgG(H+L)Cross-Adsorbed Secondary Antibody,HRP购自Thermo Fisher Scientific公司;BCA蛋白浓度测定试剂盒构于北京索莱宝生物公司。
1.2 RNA抽提及RT-PCR
三生烟叶片总RNA抽提采用TrazoL法[6]。TMV P54基因的特异性RT-PCR扩增引物以TMV基因组(Genbank登录号:HE818438.1)为模板设计,添加双酶切位点(下划线)和保护碱基(TMV/rdrp/sacI/F:5′>ACCGAGCTCATGCAGTTTTACTATGATAAGTG TC<3′,TMV/rdrp/xhoI/R:5′>CCCCTCGAGACAAC TAGAGCCATCTATAAACAA<3′,)。
以抽提的感染TMV三生烟总RNA为模板,P54基因特异性引物采用一步法进行RT-PCR[7],PCR产物于1%的琼脂糖凝胶电泳检测,PCR产物采用DNA凝胶纯化回收试剂盒(OMEGA公司)回收纯化。
1.3 重组原核表达载体构建
用PCR产物和pEASY®-Blunt E1,采用DNA凝胶纯化回收试剂盒(OMEGA公司)回收纯化PCR产物,将纯化回收后的PCR产物连接至pEASY®-Blunt E1中。将连接好的载体转化至E coli DH5α,以原核表达载体pEASY®- Blunt E1试剂盒自带T7引物进行PCR菌落鉴定,PCR产物委托北京擎科新业生物技术有限公司测序。
1.4 TMV P54基因的原核表达条件优化
将测序正确的重组质粒pEASY®-Blunt E1::P54转入E coli BL21(DE3)中,分别使用0.1、0.4、0.8和1.2 mmol·L−1异丙基硫代半乳糖苷(isopropyl β-Dthiogalactoside,IPTG)于28、37 ℃培养4 h进行蛋白的表达及条件优化。吸取2 mL培养物,用高速低温离心机12 000 g,4 ℃,离心10 min收集菌体提取总蛋白。
1.5 原核表达蛋白提取纯化
将 菌 体 收 集 悬 浮 于 裂 解 缓 冲 液(50 mmol·L−1Tris-HCl,50 mmol·L−1NaCl,pH 8.0)中,超声破碎细胞(功率400 W,工作4 s,间歇4 s,共30 min)。破碎后菌液用高速低温离心机12 000 g,4 ℃,离心10 min,取上清20 μL,沉淀用1×PBS悬浮后取20 uL;上清液和悬浮后沉淀用于SDS-PAGE鉴定。包涵体蛋白纯化参照The Thermo Scientific™ HisPur™Ni-NTA Spin Columns操作说明进行,并将收集到的液体装入透析袋,于8、6、4、2、0 mol·L−1尿素的梯度透析液(5%甘油、1% L-精氨酸、2% 甘氨酸、1×PBS,pH 8.0)中,于各个梯度透析液中4 ℃下透析复性12 h以上,收集液用高速低温离心机12 000 g,4 ℃,离心10 min,保留上清,去除沉淀,纯化后的重组蛋白进行SDS-PAGE鉴定。
1.6 Western blotting检测
将纯化后的蛋白样品经SDS-PAGE电泳后,转印到PVDF膜上,5%脱脂奶粉封闭,4 ℃一抗(6x-His Tag Monoclonal Antibody(HIS.H8)from Thermo Fisher Scientific)孵育过夜,清洗PVDF膜;于37 ℃进行二抗(Goat anti-Mouse IgG(H+L)Cross-Adsorbed Secondary Antibody, HRP from Thermo Fisher Scientific)孵育,清洗PVDF膜,用Thermo Scientific™ Pierce™ECL Plus Western Blotting Substrate显色试剂盒进行显色检测[8]。
2.1 原核表达载体的构建
以感染TMV三生烟的总RNA为模版,RT-PCR扩增TMV P54基因,1%琼脂糖凝胶电泳检测结果表明,PCR扩增得到1条大小约为1.5 kbp特异性条带(图1-A),纯化回收后测序结果表明,该条带大小为1 425 bp,与TMV P54基因的同源性高达100%。
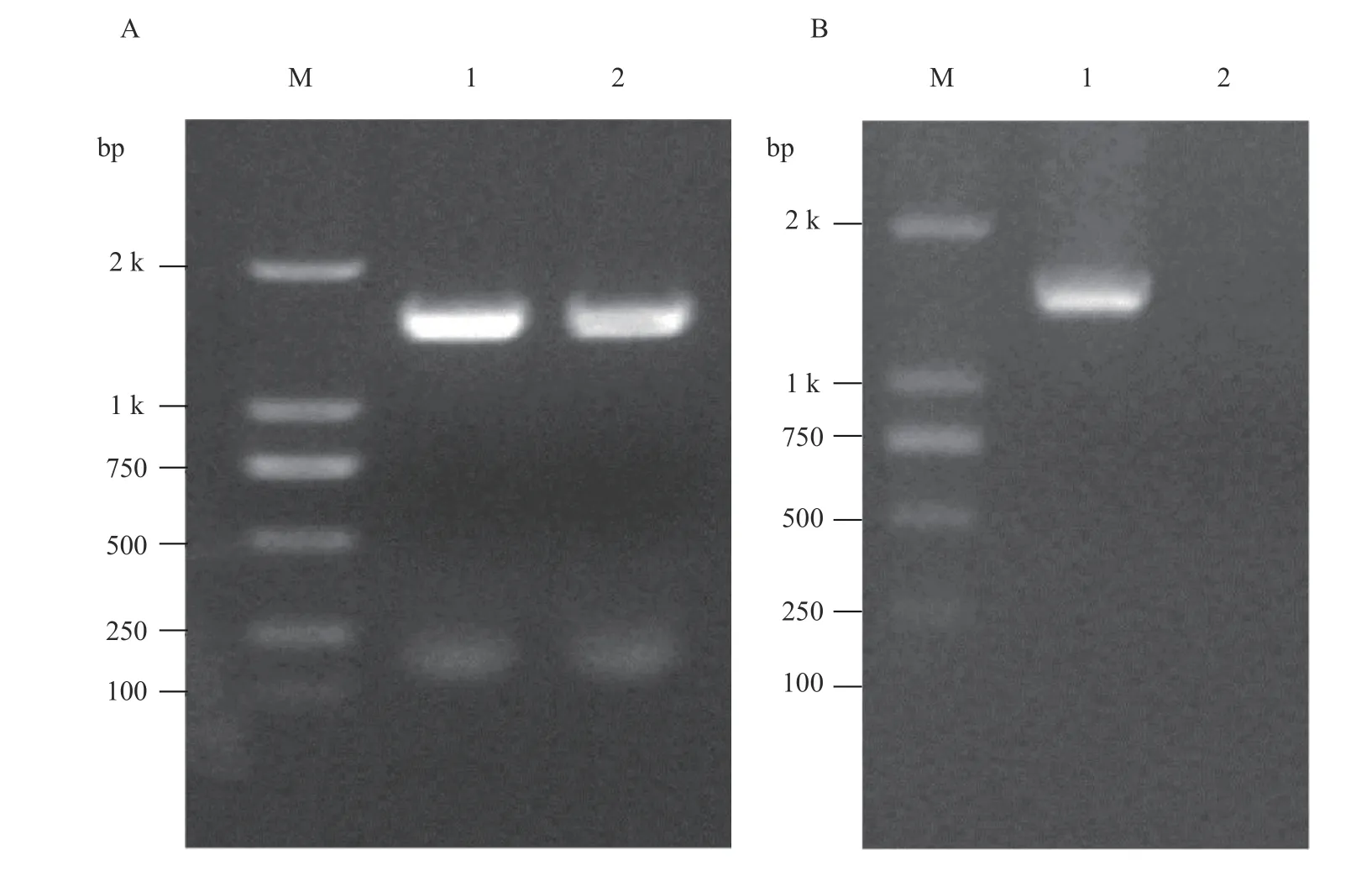
图 1 原核表达载体p EASY®- Blunt E1::P54凝胶电泳分析Fig. 1 Electrophoresis of recombinant prokaryotic expressing plasmid, pEASY-Blunt E1::P54
将P54基因条带双酶切后,插入双酶切的pEASY®-Blunt E1,转化E coli BL21(DE3)。菌落PCR扩增得到了与预期大小一致的特异性条带(图1-B),表 明原核表达载体pEASY®-Blunt E1::P54构建成功。
2.2 P54基因的原核表达及蛋白鉴定
将含重组质粒pEASY®-Blunt E1::P54的E coli BL21(DE3),在37 ℃,0.5 mmol·L−1IPTG诱导4 h,分别取上清与沉淀,SDS-PAGE 检测结果表明,37 ℃,0.5 mmol L−1IPTG诱导4 h,在55~70 kDa出现特异性目的条带(图2),即重组P54蛋白,并且重组E1-P54蛋 白大部分表达于包涵体中。
2.3 P54原核表达条件的优化
为了探究P54蛋白原核表达的最优条件,对诱导条件进行优化。分别利用0.1、0.4、0.8、1.2 mmol·L−1IPTG于28、37 ℃培养4 h。SDS-PAGE 电泳显示(图3),在28、37 ℃时,大肠杆菌的上清蛋白中均未发现目的条带(泳道1~4,9~12)。在大肠杆菌的沉淀蛋白中出现了目的条带(泳道5~8,13~16),且在37 ℃下诱导的蛋白表达量高于在28 ℃;IPTG浓度超过0.4 mmol·L−1后,目的条带无明显变化;表明P54蛋白的最佳诱导温度与最佳IPTG浓度分 别为37 ℃、0.4 mmol L−1。
2.4 重组蛋白P54的纯化与蛋白浓度测定
重组P54蛋白包涵体经过过柱纯化,透析复性,SDS-PAGE结果表明,纯化蛋白在55~70 kDa出现了1条与预测大小一致特异的蛋白条带(图4)。纯化后的蛋白浓度测定参照索莱宝BCA试剂盒进行,制作标准曲线(y=0.46x+0.06, R2=0.94),计算纯 化后蛋白含量为0.29 mg· mL−1。
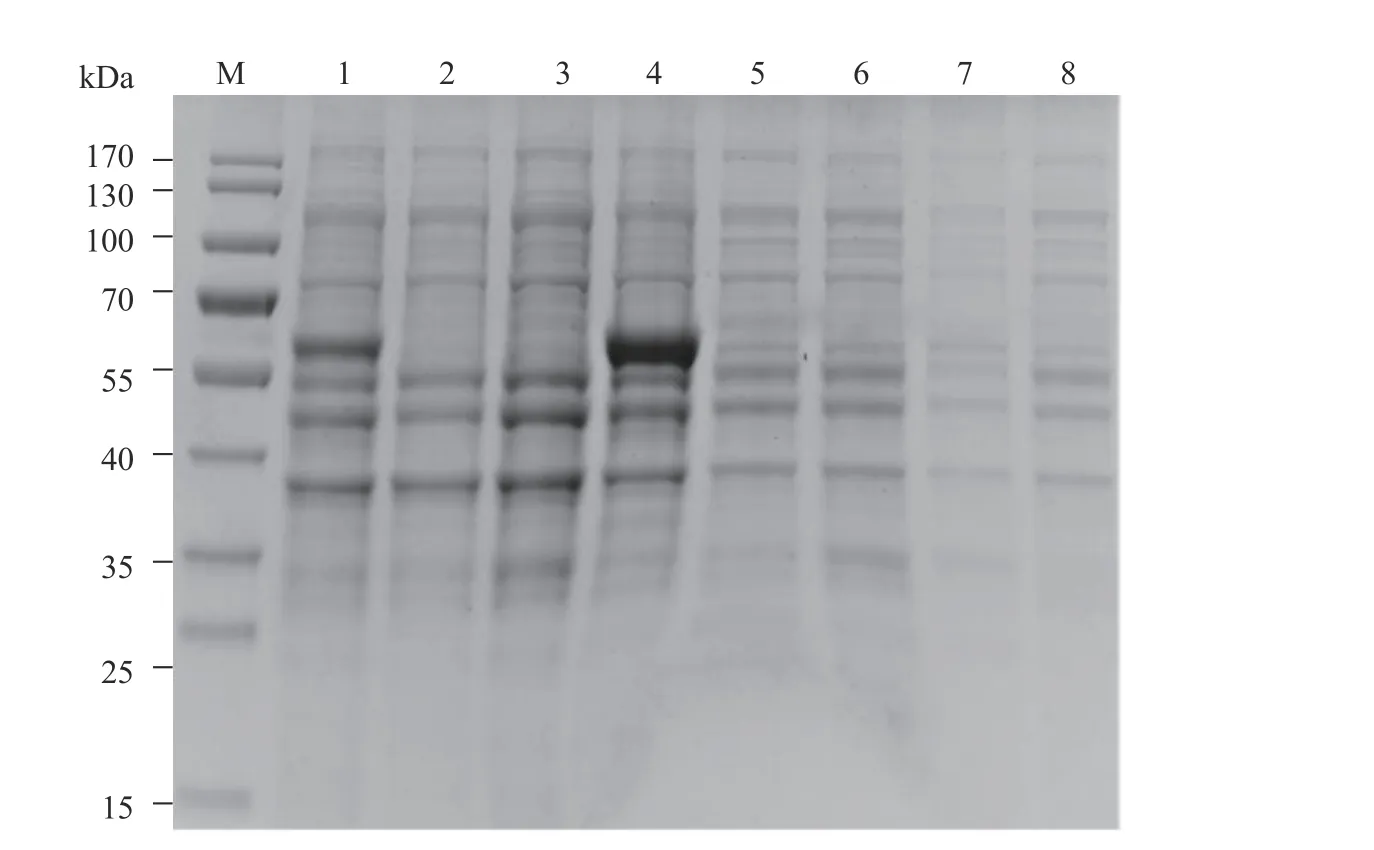
图 2 P54蛋白诱导表达产物SDS-PAGE分析Fig. 2 SDS-PAGE analysis on induced expression products of P54
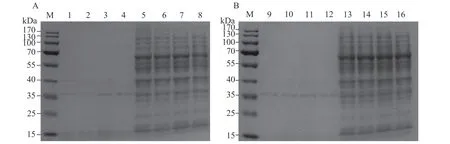
图 3 TMV P54基因表达条件优化(A:28 ℃,B:37 ℃)Fig. 3 SDS-PAGE analysis on prokaryotic expressing of TMV P54 (A: 28 ℃; B: 37 ℃)
2.5 P54重组蛋白的Western blot鉴定
纯化后的P54重组蛋白,采用6×His单克隆抗体进行Western blotting检测,结果表明,纯化后的重组P54蛋白,与6×His单克隆抗体与杂交条带,证 实纯化后的重组蛋白为P54重组蛋白(图5)。
3 讨论与结论
将TMV P54基因序列插入到原核表达载体pEASY-Blunt E1,在宿主菌E coli BL21(DE3)中进行诱导表达,TMV P54蛋白主要以包涵体形式存在。包涵体复性后,透析复性后采用Ni-NTA柱层析纯化,SDS-PAGE及Western-blotting证实纯化得到了分子量大小约为60 kDa的P54重组蛋白,为大量表达P54蛋白,研究其生物学特性打下了基础。

图 4 纯化TMV P54重组蛋白SDS-PAGE分析Fig. 4 SDS-PAGE analysis on purified TMV P54

图 5 纯化TMV P54重组蛋白Western blotting分析 Fig. 5 Western blot on purified TMV P54
TMV的基因组复制研究表明,TMV编码P183和P126蛋白,参与TMV的复制[9,10,11,12],此外,TMV还编码一个假定的P54蛋白,预测其功能与TMV的复制相关[4],但尚无相关研究证实。有研究表明受染植物细胞的多聚核糖体中,可以检测到P54基因的mRNA,却未检测到P54蛋白[13]。推测P54蛋白可能是一个特定时间表达蛋白,但目前尚无研究证实。因此,急需开展TMV编码P54蛋白功能研究,为研究明确TMV复制分子机制提供科学基础。
采用原核表达技术,纯化获得大量表达目标蛋白,是研究目标蛋白生物学功能的基础,影响外源蛋白原核表达水平及其生物活性的因素有多种,如目标蛋白自身编码基因、表达宿主菌以及诱导表达的条件等[14,15]。植物病毒编码蛋白的原核表达研究表明,原核表达的植物病毒编码蛋白,通常以包涵体形式存在[5],本研究结果得到类似结果,P54蛋白以包涵体形式存在。此外,温度会显著影响原核蛋白的表达,在高温诱导时,大肠杆菌的生长速度较快,蛋白表达的速度会随之增快,导致表达的蛋白不能正确折叠,易形成包涵体[16,17]。在28 ℃和37 ℃,原核表达的P54蛋白均以包涵体的形式存在,表明P54蛋白形成包涵体,可能与蛋白的不能正确折叠无关,而与蛋白本身特性有关。
原核表达的蛋白包涵体,可复性恢复生物学活性[18],本研究采用盐酸胍对P54重组蛋白进行复性,并透析浓缩去掉盐离子,获得了纯度和浓度均较高的重组蛋白,为后续深入研究烟草花叶病毒P54蛋白功能奠定基础。

