本氏烟中与番茄斑萎病毒N蛋白互作的寄主因子的筛选
苗淑月,高晓晓,郑立敏,陈建斌,赵星月,程菊娥,陈 莎,章松柏 ,刘 勇
(1. 长江大学农学院,湖北 荆州 434025;2. 湖南省农业科学院植物保护研究所,湖南 长沙 410125;3. 西南林业大学,云南 昆明 650032;4. 湖南工业大学生命科学与化学学院,湖南 株洲 412007)
0 引言
【研究意义】番茄斑萎病毒(Tomato spotted wilt virus, TSWV)是布尼亚病毒目(Bunyaviriales)、番茄斑萎病毒科(Tospoviridae),正番茄斑萎病毒属(Orthotospovirus)的成员[1]。该病毒是农业生产的重要病原物之一,其寄主范围十分广泛,包括番茄、辣椒等蔬菜作物以及花卉等经济作物[2]。TSWV已被列为全球十大植物病毒之一,每年造成的损失超过10亿美元[3−4]。目前,TSWV已经在荷兰、法国、英格兰、意大利以及西班牙等欧洲国家暴发,随后传播到南、北美洲等地。近年来,在伊朗、日本、韩国、中国等亚洲国家陆续发现该病毒[5−8]。自TSWV首次在我国发现以来,因其病害扩展迅速,目前在天津、北京、山东、海南、云南等多地均有报道。明确寄主蛋白调控N蛋白多聚体的形成过程及N蛋白介导的病毒致病机理,有助于了解寄主因子调控TSWV在烟草内侵染的分子机制,解析病毒侵染机理。【前人研究进展】番茄斑萎病毒的病毒粒体为球状体或多面体颗粒,病毒颗粒直径大约有80~120 nm[9]。其基因组为三分体RNA单链,根据其分子量命名为L RNA,M RNA和S RNA[10]。L RNA的互补链编码RdRp蛋白,M RNA编码Gn/Gc蛋白和非结构蛋白(NSm),S RNA编码核衣壳蛋白(N)和非结构蛋白(NSs)[11−12]。所有蛋白质以高度协调的方式在寄主细胞内发挥作用,有助于TSWV成功感染寄主植物。番茄斑萎病毒的核衣壳蛋白(N)可以自身结合形成多聚体并与核糖核蛋白(RNPs)的形成有关[13−14]。在植物体内病毒粒子的装配和成熟与N蛋白与Gn和Gc蛋白的互作有关[15]。此外,病毒通过胞间连丝的过程需要NSm和N之间的相互作用来完成[16]。近年来,对N的晶体结构进行研究,发现N具有一个由带正电荷的N-和C-端组成的结构域,并且有一个潜在的RNA结合位点。此外,N的结构域介导与相邻亚单位的同型蛋白之间的相互作用[12]。TSWV N在植物细胞内可以形成沿着内质网和微丝组成的网络高速运动的颗粒[17]。在TSWV侵染寄主植物时,发现N蛋白与诱导超敏感型辣椒的程序性细胞死亡(PCD)有关[18]。研究表明,含有绿色荧光蛋白(GFP)基因与TSWV的N基因融合片段的转基因植株表现GFP和N基因片段的转录后基因沉默,并且对TSWV具有抗性[19]。【本研究切入点】TSWV N蛋白在介导病毒侵染寄主过程中发挥着至关重要的作用。本试验以TSWV N蛋白作为诱饵蛋白,采用酵母双杂交(Yeast two-hybrid,Y2H)的方法筛选烟草内与TSWV N相互作用的寄主蛋白。【拟解决的关键问题】研究结果有助于了解寄主蛋白调控N蛋白多聚体的形成过程及N蛋白介导的病毒致病机理,以及寄主因子调控TSWV在烟草内侵染的分子机制和病毒侵染机理,解析病毒侵染机理,以期为后续更有效地防控该病毒病害提供依据。
1 材料与方法
1.1 材料与试剂
pGBKT7-N、pGBKT7-53、pGBKT7-Lam、pGADT7-T等重组质粒、烟草酵母文库,酵母菌株Y2H Gold、大肠杆菌菌株(Escherichia coli)DH5α由湖南省植物保护研究所实验室保存;酵母双杂交营养缺陷型培养基,X-α-gal、Aureobasidin A购自宝生物工程(大连)有限公司;酵母质粒提取试剂盒购自天根生化科技(北京)有限公司;一步法酵母活性蛋白提取试剂盒购自生工生物工程(上海)股份有限公司;cMyc的单克隆抗体购自Thermo Fisher Scientific。
1.2 试验方法
1.2.1 重组诱饵载体pGBKT7-N的自激活检测 采用醋酸锂转化法将诱饵表达载体质粒pGBKT7-N和pGADT7、阳性载体质粒pGBKT7-53和pGADT7-T、阴性载体质粒pGBKT7-Lam和pGADT7-T分别转化入Y2H Gold酵母感受态细胞,涂布于SD/-Trp/-Leu营养缺陷型培养基,并在30 ℃恒温倒置培养2-3 d,待克隆长出后挑取单克隆划线于SD/-Trp/-Leu/-His/-Ade和SD/-Trp/-Leu/-His/-Ade/X-α-gal营养缺陷型培养基,在30 ℃恒温倒置培养2-3 d,比较酵母菌落的生长状态 和颜色变化,判断N蛋白是否有自激活活性。
1.2.2 重组诱饵载体pGBKT7-N的毒性检测 采用醋酸锂转化法将诱饵表达载体质粒pGBKT7-N转入Y2H Gold酵母感受态细胞,同时转化pGBKT7空载体做对照,将转化好的酵母菌分别稀释10倍、100倍、1 000倍,然后取100 μL涂板于SD/-Trp营养缺陷型培养基。30 ℃恒温倒置培养2~3 d,直至长出克隆。比较单克隆的大小和数量,判断N蛋白对酵母 细胞是否有毒性。
1.2.3 Western blotting检测TSWV N蛋白在酵母细胞内的表达 在30 ℃ 250 r·min−1条件下,用SD/-Trp液体培养基培养1.2.2获得的pGBKT7-N单克隆酵母菌至OD600大于1.0,1 000 g离心10 min收集菌体,提取酵母总蛋白,用cMyc的单克隆抗体来检测N蛋白 是否在酵母Y2H Gold细胞内表达。
1.2.4 重组诱饵载体pGBKT7-N筛选烟草文库 在转有诱饵表达载体pGBKT7-N的SD/-Trp固体培养基上挑取单克隆于50 mL SD/-Trp液体培养基中。在30 ℃250 r·min−1条件下,振荡培养直到OD值为0.8左右。然后将其离心后与转有烟草cDNA文库的菌株Y187进行融合培养,培养20 h左右取出培养液,在显微镜下观察到有接合体出现时继续培养4 h,离心并洗脱后涂布于15 cm SD/-Trp/-Leu/-His营养缺陷型培养基上,挑取单克隆,转移至SD/-Trp/-Leu/-His/-Ade、SD/-Trp/-Leu/-His/-Ade/Aba、SD/-Trp/-Leu/-His/-A de/Aba/X-ɑ-gal营养缺陷型培养基上进行显色反应。
1.2.5 酵母质粒提取及PCR鉴定测序分析 SD/-Trp/-Leu/-His/-Ade液体培养基在30 ℃ 250 r·min−1条件下震荡培养从SD/-Trp/-Leu/-His/-Ade营养缺陷型培养基上挑取的长势良好的酵母菌2 d后提取酵母质粒,用pGADT7载体的通用引物对质粒进行PCR扩增鉴定。PCR反应体系:酵母质粒1 μL,10 μmol·L−1上下游引物各0.5 μL,反应缓冲液2.5 μL,dNTPs(2.5 mmol·L−1)2 μL,TransStart®Top Taq DNA聚合酶(2.5 U·μL−1)0.5 μL,去离子水18 μL。PCR反应程序:94 ℃预变性5 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸120 s,共30个循环后,72 ℃延伸7 min。并将提取到的质粒转化至E. coli DH5ɑ内,以3′AD为引物进行菌落PCR扩增鉴定,提取捕获质粒并进行测序。分析筛选到的互作基因名称、基因 简介、读码框完整性和一致性等信息。
2 结果与分析
2.1 酵母诱饵表达载体自激活检测
分别将诱饵载体pGBKT7-N和空载体pGBKT7、阳性载体pGBKT7-53和pGADT7-T、阴性载体pGBKT7-Lam和pGADT7-T转入酵母菌株Y2H Gold中,比较其在SD/-Trp/-Leu、SD/-Trp/-Leu/-His/-Ade和SD/-Trp/-Leu/-His/-Ade/X-ɑ-gal营养缺陷型培养基上的生长情况,发现三组质粒在SD/-Trp/-Leu营养缺陷型培养基上均能生长(图1-a)。只有pGBKT7-53和pGADT7-T在SD/-Trp/-Leu/-His/-Ade营养缺陷型培养基上生长(图1-b)并在SD/-Trp/-Leu/-His/-Ade/X-ɑ-gal营养缺陷型上显蓝色(图1-c),试验结果证明诱饵载体pGBKT7-N不能单独激活报告基因表达 ,没有自激活现象。
2.2 酵母诱饵表达载体的毒性检测
将诱饵载体pGBKT7-N和空载体pGBKT7转入酵母菌株Y2H Gold中,比较其在SD/-Trp营养缺陷型培养基上的生长情况,发现两组菌落大小均随着稀释倍数的增加而变大,数量均随着稀释倍数的增加而变少,且两组菌落大小均匀一致,表明N蛋白表达对Y2H Gold酵母菌无毒性。
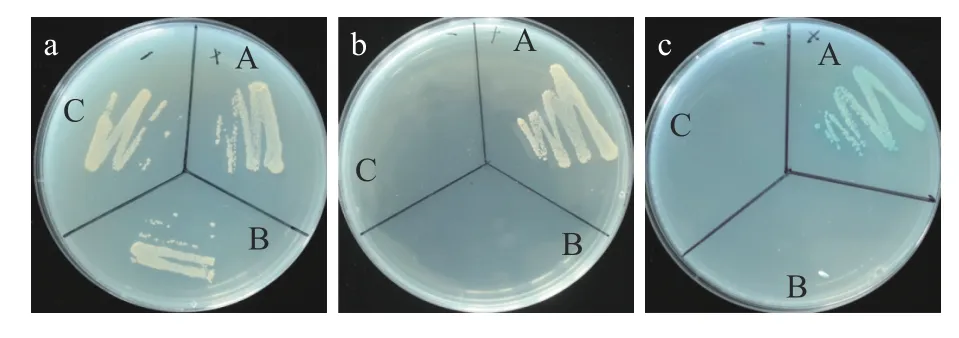
图 1 N蛋白在酵母细胞中的自激活验证Fig. 1 Verification of self-activation of N protein in yeast cells
2.3 诱饵表达载体在酵母细胞内的表达
以含pGBKT7空载体的菌落作为阴性对照,用SD/-Trp液体培养基震荡培养含有诱饵表达载体pGBKT7-N的单菌落,利用一步法酵母活性蛋白提取试剂盒提取酵母总蛋白。由于载体上的标签cMyc与诱饵可形成融合蛋白,因此本试验以cMyc的单克隆抗体进行Western-blotting检测,结果表明N蛋白能够在酵母细胞中表达,N与cMyc的融合蛋白大小为39 kDa( 图2)。
2.4 筛选与TSWV N蛋白互作的寄主蛋白
将转入诱饵质粒pGBKT7-N的菌株Y2H Gold过夜培养至OD值为0.8左右,然后将其离心后与转有烟草cDNA文库的菌株Y187进行融合培养,20 h后取出培养液,在显微镜下观察到有形状像米奇头像或三叶草形状的接合体出现(图3),继续培养4 h后离心并洗脱,涂布于15 cm SD/-Trp/-Leu/-His营养缺陷型培养基上,挑取单克隆,转移至SD/-Trp/-Leu/-His/-Ade、SD/-Trp/-Leu/-His/-Ade /Aba、SD/-Trp/-Leu/-His/-Ade/Aba/X-ɑ-gal营养缺陷型培养基上,并在3~5 d后发现有114菌落生长并发生显色反应(图4)。
2.5 鉴定与TSWV N蛋白互作的寄主蛋白
挑取114个菌落,经SD/-Trp/-Leu/-His/-Ade液体培养基培养2 d,提取酵母质粒,并进行质粒PCR检测(图5),选取条带大于500 bp的质粒转化E.coliDH5ɑ,以氨苄青霉素为抗生素进行阳性筛选,挑取阳性克隆送公司测序,分析后共发现15种蛋白,将序列在NCBI比对发现这15个蛋白分别为叶绿素ab结合蛋白16(chlorophyll a-b binding protein 16, CabBP16)、叶绿素a-b结合蛋白(chlorophyll a-b binding protein, Ca-bBP)、叶绿素a-b结合蛋白50(chlorophyll a-b binding protein 50, Ca-bBP50)、叶绿素a-b结合蛋白CP 26(chlorophyll a-b binding protein CP 26, Ca-bBp CP 26)、1,5二磷酸核酮糖羧化加氧酶小链(ribulose-1,5-bisphosphate carboxylase oxygenase small chain Rubisco,1,5-BCOSC)、叶绿素a-b结合蛋白21(chlorophyll a-b binding protein 21, Ca-Bbp 21)、30S核糖体蛋白S6(30S ribosomal protein S6 alpha,30SRPS6A)、光系统I反应中心亚基II(photosystem I reaction center subunit II, PIRCSII)、酰基辅酶A结合蛋白(acyl-coa-binding protein, ACBP)、脂质转移蛋白(lipid transfer protein, LTP)、非特异性脂转移蛋 白 2(non-specific lipid-transfer protein 2-like,NSLTP2L)、多蛋白桥接因子1b(multiprotein-bridging factor 1b-like, MBF1BL)、衰减核糖体生物发生蛋白BRX1同源物(ribosome biogenesis protein BRX1 homolog, RBPBRX1H)、细胞分裂周期蛋白48同源物(cell division cycle protein 48 homolog, CDCP48H)、硫胺噻唑合酶(thiamine thiazole synthase, TTSCL)(表1)。
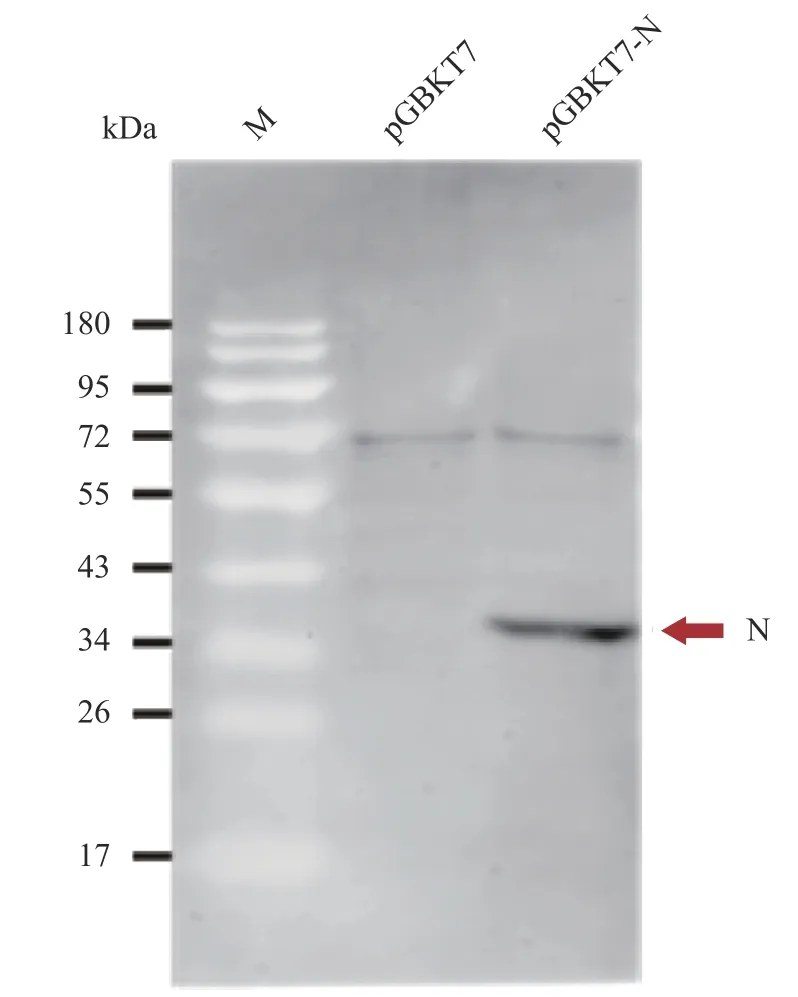
图 2 Western blot检测N蛋白在酵母内的表达情况Fig. 2 Expression of N protein in yeast as detected by Western blot
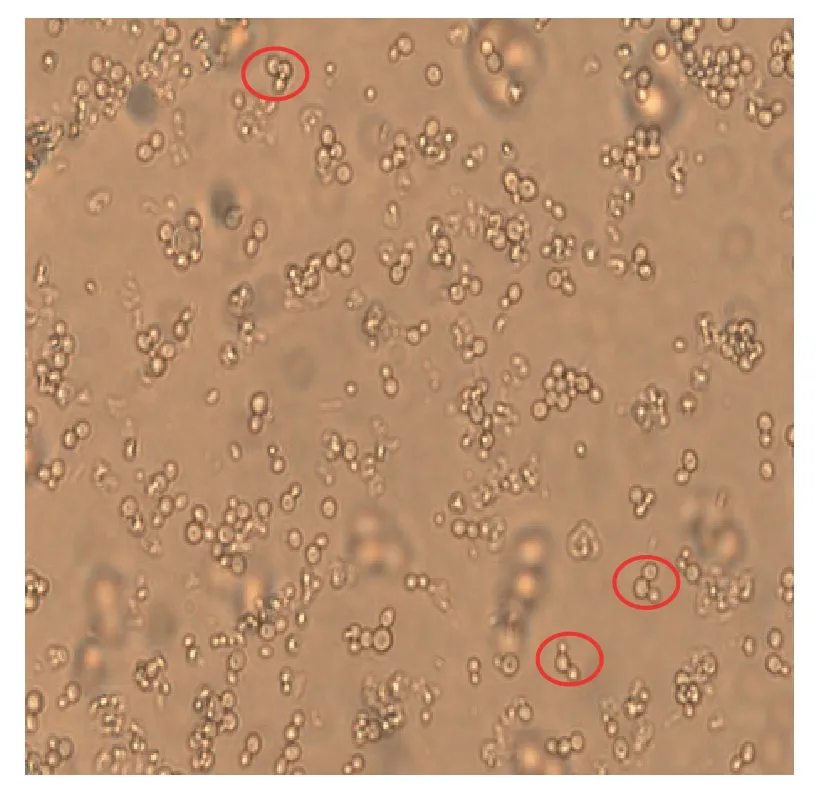
图 3 酵母结合体Fig. 3 Yeast complexes
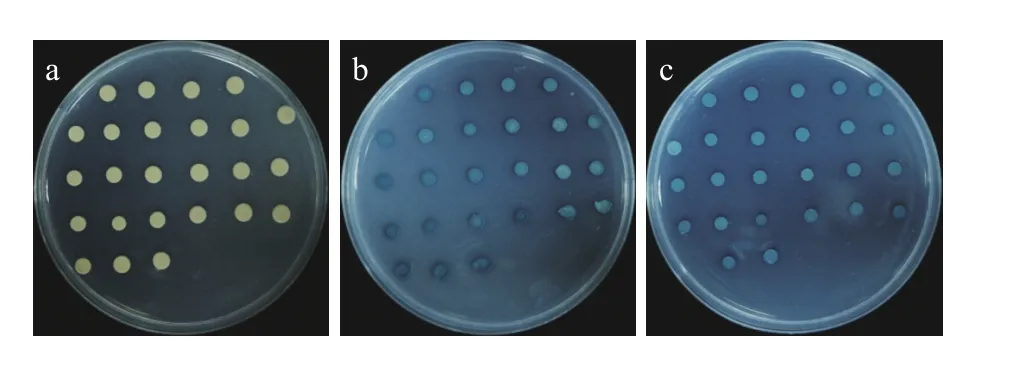
图 4 酵母菌在四缺培养基上的生长情况Fig. 4 Growth of yeast on 4 nutrient-deficient culture media

图 5 阳性克隆的PCR检测Fig. 5 PCR detection of positive clones

表 1 与TSWV N蛋白互作的15个候选蛋白Table 1 Fifteen candidate proteins that interacted with N protein of TSWV
3 讨论
目前,尚未有治疗TSWV的有效手段。随着科研工作者对TSWV的深入研究,对该病害的病状、发病规律的了解越来越多。然而,对于TSWV与寄主植物的互作关系了解的相对较少。尽管培育抗TSWV的植物是防治TSWV的必由之路,过去几十年的研究让我们对TSWV致病性以及番茄对该病毒的抵抗力的理解有了质的飞跃,但是,这种抗性是特异性的,并且很快被病毒所克服,因此不能成功地用于育种工作。而研究TSWV与寄主的互作关系也同样可以指导番茄等作物的生产,并可以为TSWV防控提供有效理论依据。N蛋白在植物寄主的主要作用也与病毒的增殖密切相关。因此,为了更好地研究寄主和TSWV的相互作用,尤其是了解寄主蛋白参与调控病毒的增殖过程,使植物成功获毒,本试验以N蛋白为诱饵蛋白筛选烟草酵母文库,为更好开展TSWV与寄主的互作研究奠定基础,为找到阻断病毒在植物体内增殖寻找理想靶标,为防治病毒提供新的思路和方向。
本研究在对酵母菌诱饵载体进行表达后发现其融合蛋白大小为39 kDa,较目标融合蛋白偏小,可能是当cMyc标签蛋白存在时,诱饵蛋白的mRNA转录量减少所导致的[20]。另外,本研究共筛选到15个寄主蛋白与TSWV N互作。分别为Ca-bBP、Ca-bBP 16、Ca-Bbp 21、Ca-bBP 50、Ca-bBp CP 26、1,5-BCOSC、30SRPS6A、PIRCSII、ACBP、LTP、NSLTP2L、MBF1BL、RBPBRX1H、CDCP48H、TTSCL蛋白(表1)。其中Ca-bBP、Ca-bBP 16、Ca-Bbp 21、Ca-bBP 50是叶绿体结合相关蛋白,可能参与色素的生物合成或类囊体膜的组装[21]。Ca-bBp CP 26是叶绿体结合相关蛋白,属于Lhc蛋白家族,在CP 26中,3个叶绿素结合位点对Chl-a有选择性,第一个是色素蛋白复合物折叠所必需的;第二个是蛋白质折叠所必需的,并可以与叶黄素特异性结合;第三个具有较低的选择性,可以与类囊体中存在的任何叶黄素物种结合[22]。1,5-BCOS与核酮糖二磷酸羧化酶相关,是自然界中含量最丰富的蛋白质,可能会对催化蔬菜核酮糖二磷酸羧化酶的迟滞性、时间依赖性的活性降低产生不同的影响[23]。核酮糖二磷酸羧化酶在植物中含量丰富,大约占总叶绿蛋白的一半。叶绿素含量的高低往往能客观反映植物抗病性的强弱[24]。叶绿体作为植物特有的光合作用的细胞器,通过将信息传递至细胞核来调节抗病基因表达,从而激活防御来抵御入侵者。N蛋白可能“模仿”植物自身的蛋白质行为,到达叶绿体,通过损害叶绿体与细胞核之间的通讯来阻碍植物防御反应的激活,促进自身的生存和繁殖。本研究中N蛋白与叶绿体相关蛋白互作的研究为设计植物保护策略与开发新的抗病品种提供了新思路。30SRPS6A是参与翻译调控的辅助蛋白[25]。RBPBRX1H参与核糖体生物发生的过程,核糖体成熟过程中核糖体蛋白的rRNA加工和组装涉及许多核糖体生物发生因子,与核糖体的成熟相关[26]。寄主细胞的核糖体蛋为病毒基因组复制和蛋白翻译所需的各种蛋白组分。推测其可能通过与TSWV N发生相互作用而促进病毒蛋白在植物体内的翻译。PIRCSII以体内亚基II的前体作为PSI复合物的一部分被插入和嵌入到类囊体中,然后通过基质肽酶的作用被加工成成熟的形式[27]。ACBP在脂质代谢和细胞功能调节中发挥重要作用[28]。可能被N结合和运输,从而提高植物的抗逆性。LTP是致病性相关蛋白(PR-14)家族的成员,参与植物防御反应[29]。NSLTP2L在植物发育和对非生物胁迫的反应中发挥着重要作用[30]。脂质转移蛋白可能通过与N的相互作用来参与植物的生理功能,进一步促进植物细胞壁的延伸,增强植物自身对细菌和真菌病原体的防御活性。MBF1BL可以增强拟南芥的耐盐性和对ABA不敏感性。在盐和ABA条件下,胁迫响应基因的转录水平显著提高。多蛋白桥接因子1(MBF1)是一种转录辅助激活因子,通过连接序列特异性激活因子样蛋白和TATA-box结合蛋白(TBP)介导转录激活[31]。MBF1BL在植物种可能通过与N的相互作用增强病毒对植株的侵染。CDCP48H与泛素蛋白酶体系统降解相关,可能介导肿瘤细胞增殖调控的机制基础[32]。可能通过调节细胞生理周期来降低病毒蛋白的表达。TTSCL硫胺素在所有生物体的几种酶反应中是一个必要的辅助因子[33]。
4 结论
本研究成功筛选到了15个与TSWV N蛋白相互作用的寄主蛋白,它们具有丰富多样的生物功能,因此,我们推断N蛋白的功能同样具有多样性,尤其在病毒装配和成熟,病毒反防御寄主植物免疫系统等过程中发挥重要作用。

