锌离子诱导的一维手性螺旋配位聚合物的合成及晶体结构
凌 青, 郭 彬, 李 响, 张玉杰, 王 鹏
(山东科技大学 化学与生物工程学院,山东 青岛 266590)
随着固态有序晶态材料合成和性质研究的深入,化学家们利用配体与金属的配位作用合成了大量的功能性金属-有机框架材料(Metal-Organic Frameworks, MOFs),通过对这些MOFs材料进行固态下的磁性[1]、小分子气体吸附[2]、催化[3]、选择性分离[4]等方面的研究,人们发现长程有序的晶态材料具备其他材料所不具备的可调控结构及特殊性质[5-7]。以苯甲酸为代表的羧酸类配体属于刚性、强配位能力的配体,能够与金属形成稳定的配位聚合物,在催化、分离以及荧光检测等领域发挥了重要的作用[8-10]。
偶氮化合物具有顺、反两种几何异构体,一般以反式异构体为主,但在强紫外光照射下可以转换为顺式异构体,并在停止光照后再转换为反式结构[11-12]。基于偶氮苯的刚性羧酸类配体能够在此过程中呈现“光开关”的作用,很多研究组针对此类结构设计和开发了具有基于偶氮结构的光开关性质的化合物[13]。利用偶氮和苯乙酸的结构受外界影响的特点,通过精心选择反应条件,人们就能够构建光调控、热调控的一维到三维的各种配位化合物[14-18],进而获得具备良好光学或催化性质的晶态材料。
一维手性螺旋具有特定的螺旋方向,在DNA结构中呈现的螺旋手性引起科学家的重视,是生物分子学领域遗传信息传递的基础[19]。在此,以半刚性的配体(E)-3-(3-羧基苯)-4-烯丙氧基偶氮苯乙酸(H2L)与醋酸锌在室温下通过扩散反应能够获得单一螺旋结构(C2手性空间群,Flack因子0.03)的手性单晶,通过X-射线单晶衍射分析可以证明其构型为Λ-构型(图 1)。单晶研磨后的固态圆二色(CD)谱的测试可以证明其手性的存在,将晶体溶解在乙醇中后的液态CD谱图显示其手性消失,说明手性源于晶态下的长程有序的手性螺旋结构。

图 1 配位聚合物1
1 实验部分
1.1 仪器与试剂
Nicolet IS50型傅立叶变换红外光谱仪;Bruker Avance 300 MHz型核磁共振仪(TMS为内标);Perkin-Elemental 2400型元素分析仪;Bruker Smart APEX CCD 型单晶衍射仪;MOS-500型圆二色光谱仪;HITACHI F-4600型荧光光谱仪。
3-(3-甲氧羰基苯)偶氮-4-羟基苯乙酸甲酯参照文献[20]方法合成;其余所用试剂均为分析纯。
1.2 配体H2L的合成
依次称取3-(3-甲氧羰基苯)偶氮-4-羟基苯乙酸甲酯3.28 g(10 mmol)、碳酸钾6.1 g(45 mmol)和碘化钾1 g(6 mmol),溶解于60 mL丙酮中,搅拌均匀后加入烯丙基氯1.2 g(13.4 mmol),升温至回流(TLC检测)。减压除去溶剂,水洗,甲醇重结晶得黄色粉末状固体3-(3-甲氧羰基苯)偶氮-4-烯丙氧基苯乙酸甲酯3.4 g。将其加入到三口烧瓶中,加入10%的KOH水溶液(30 mL),搅拌过夜至澄清透明后加稀盐酸调节pH=5,抽滤,水洗,干燥得橙色固体(E)-3-(3-羧基苯)-4-烯丙氧基偶氮苯乙酸(H2L)2.98 g,收率87%;1H NMR(DMSO, 300 MHz)δ: 3.59(s, 2H), 5.31(d, 1H), 5.46(d, 1H), 6.12(m, 1H), 7.24(d, 1H), 7.42(t, 1H), 7.51(d, 1H), 7.72(t, 1H), 8.09(d, 2H), 8.34(s, 1H), 12.79(s, 2H); Anal. Calcd for C18H16N2O5: C 64.81, H 5.16, N 7.14, found C 63.53, H 4.74, N 8.23; IRν:3420, 1707, 1607, 1436, 745, 830 cm-1。
1.3 配位化合物1的合成
取配体H2L200 mg(0.59 mmol)及醋酸锌300 mg(1.6 mmol)分别溶解在20 mL甲醇和20 mL水中,将醋酸锌溶液滴入10支5 mL的试管中,中间加入2 mL纯甲醇作为缓冲层,沿壁将配体H2L的甲醇溶液缓慢加入试管中,封口静置反应7 d得橙黄色固体(1) 73.3 mg, 收率72%;Anal. Calcd for C18H18N2O7Zn: C 51.01, H 4.96, N 6.02, found C 49.17, H 4.13, N 6.37; IRν:3446, 3354, 2964, 2198, 1607, 1462(s), 1388, 1052, 814, 614 cm-1。
1.4 配体H2L和1晶体结构
选取合适尺寸的单晶,以φ-ω扫描方式收集衍射点,数据经过经验吸收校正后使用Shelxtl软件包,采用直接法解出晶体结构,全部非氢原子坐标及各向异性热参数用全矩阵最小二乘法修正。非水分子上的氢原子的坐标由理论加氢方法得到,水分子上的氢原子坐标通过Fourier Syntheses方法确定,晶体的结构解析及精修通过Shelxtl-2014软件包完成。晶体学数据列于表1中,配位聚合物1的主要键长和键角列于表2,配位聚合物1的氢键列于表3。
2 结果与讨论
2.1 配体的晶体结构
X-射线单晶结构的解析表明,配体H2L结晶于单斜晶系,P21/c空间群,其不对称结构单元为一个完整的配体分子,结构如图2所示。从图中可以看出,晶态下配体分子呈现出良好的平面结构,意味着配体的羧基、两个苯环和偶氮结构处于强的共轭体系内。

表1 H2L和配合物1单晶体的晶体学数据
2.2 配位聚合物1的晶体结构
X-射线单晶结构的解析表明,配位聚合物1结晶于单斜晶系,手性的C2空间群。如图3所示,不对称结构单元由两个占有率50%的Zn2+、一个负二价的配体L2-和两个配位水分子组成,晶体中没有游离的溶剂水或者乙醇分子。两个Zn2+均处于{ZnO6}的六配位变形八面体环境中,其中Zn1与来自两个配体的苯甲酸上的氧原子(O1、 O2、 O1i和O2i)和两个配位水上的氧原子(O7和O7i)成键,Zn2与来自两个配体的苯乙酸上的氧原子(O3、 O4、 O3ii和O4ii)和两个配位水上的氧原子(O6和O6ii)成键。Zn—O键长在0.198~0.231 nm内,与常见的锌离子构建的MOFs化合物的键长一致。

表 2 配位聚合物1的部分键长(nm)与键角(°)

表3 配位化合物1的氢键键长和键角

图 2配体H2L的不对称结构单元(椭球率50%)
2.3 影响配位化合物1手性螺旋的因素
配体H2L与醋酸锌的反应是配体羧基与锌离子的配位反应,在乙醇/水体系中自组装形成配位化合物,配合物结晶后溶解度最小的结构进行结晶析出,研究影响配位化合物手性的因素能够促进化学家理解手性产生的原因。
通过将配体H2L与醋酸锌直接在乙醇溶液中直接搅拌,获得了粉末状的黄色小晶粒,通过对比,这些小晶粒与单晶的XRD完全一致,如图5所示,但其固态下的手性CD谱图显示其并无手性。相反,将试管溶剂扩散法合成的单晶颗粒收集后进行固态手性CD谱图测试,显示其手性的存在。将单晶颗粒或粉末微晶溶解在DMSO或分散在乙醇中,则液态和固态手性CD谱图均无明显的信号。
2.4 配体和配位化合物1的紫外发射性质
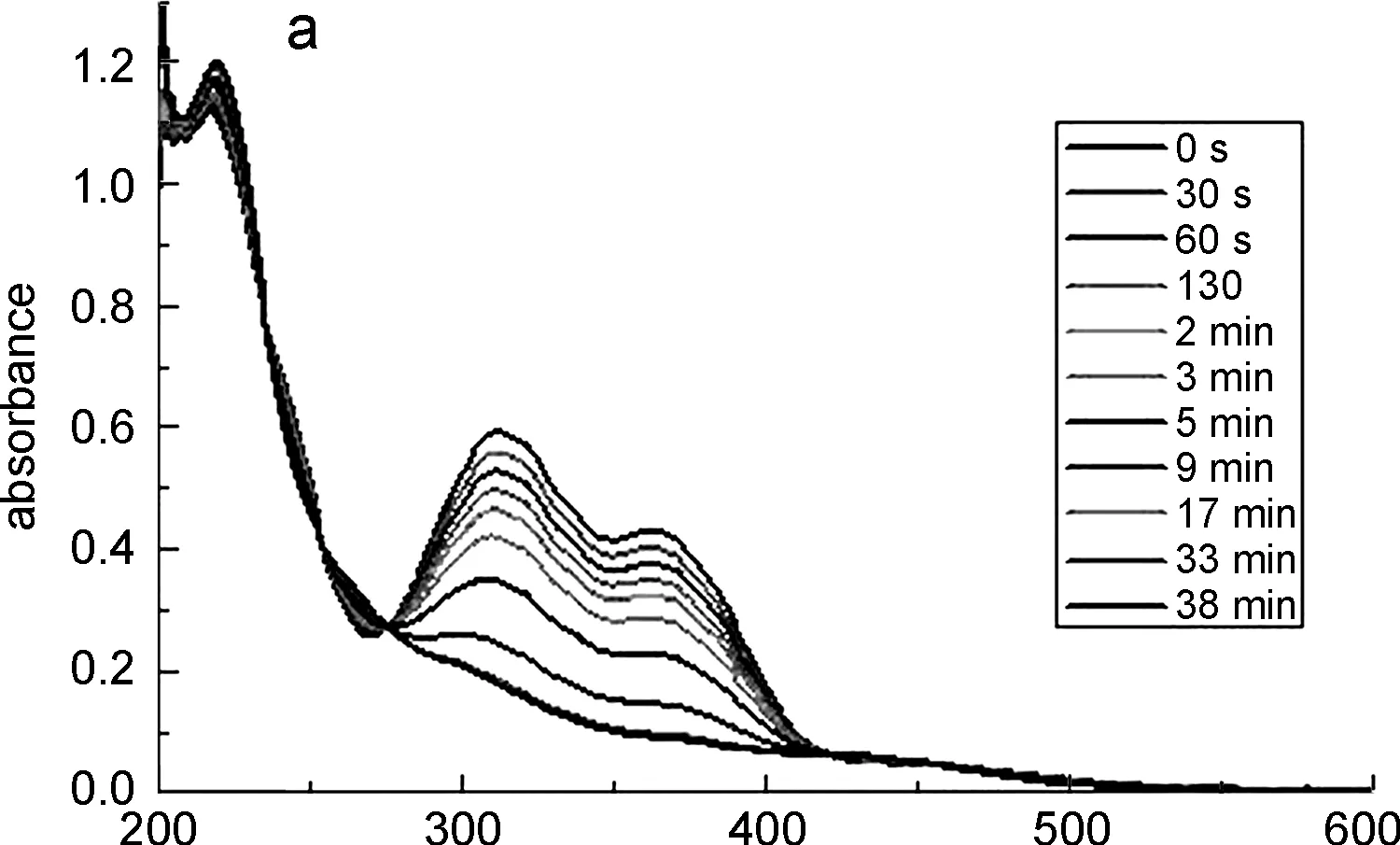
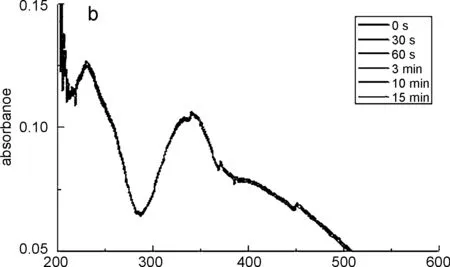
配体H2L与配位化合物1在分散在乙醇中后,使用紫外光进行照射,取不同照射时间的分散液测试荧光发射,结果显示出明显的差异,如图6(a)所示。配体H2L溶解于乙醇后,自由运动的分子能够不断地进行构象翻转,使得其吸光度逐渐减弱,最终达到新的平衡。而配位化合物1的紫外吸收曲线随着紫外光照时间的增加虽然有所变化,但从图6(b)中可以看出吸光度曲线的变化并不大。这可能是因为配合物1在乙醇中虽然以碎片状存在但仍为配合状态,这限制了配体分子的自由运动,在紫外光照射后无法进行反式与顺式结构的相互转化,因此使得每次紫外光照射后所测得的紫外吸收曲线差异都很小。



(a)(b)

图 4化合物1中Λ-构型的一维螺旋结构

2θ/(°)

λ/nm
λ/nm
λ/nm
通过合成刚性平面结构的偶氮苯类羧酸配体,利用偶氮结构带来的刚性平面与苯乙酸的弯曲方向,在不引入手性助剂的条件下,获得了一例单一手性螺旋化合物的结晶。通过缓慢结晶与迅速混合的对比,确认该化合物1的手性螺旋只能通过缓慢结晶产生,这给出了利用配位作用的驱动力,通过设计合理的配体,通过金属离子的配位选择诱导以及结晶过程的控制获得自发拆分的单一手性螺旋结构晶体的新思路。

