噬琼胶菌产新琼二糖热稳定琼胶酶的酶学性质及酶解产物的抗氧化活性
刘雪,陈艳红,2,姜泽东,2,倪辉,2,李清彪,2,朱艳冰,2
(1.集美大学食品与生物工程学院,福建厦门 361021)(2.福建省食品微生物与酶工程重点实验室,厦门市食品生物工程技术研究中心,福建厦门 361021)
琼胶主要由红藻细胞壁中提取出来的一种胶体物质[1]。琼胶的胶凝性和稳定性好,常被用于凝固剂、增稠剂和乳化剂,广泛应用于食品行业。琼胶可视为主要由琼脂糖和琼脂果胶构成的混合物。琼脂糖是一种由D-半乳糖和3,6-内醚-α-L-半乳糖经α(1→3)和β(1→4)糖苷键交替连接而成的链状中性多糖,是形成凝胶的主要组分[2]。琼脂果胶是由一系列复杂的多聚糖链组成,它包括β-D-半乳糖、3,6-脱水-α-L-半乳糖以及丙酮酸、硫酸基和甲基等[3]。琼胶的降解产物分子量小,粘度低,水溶性好,易被人体吸收,并且具有多种生物学功能,包括抑菌、抗氧化、美白、保湿、抗病毒等[4],在食品、化妆品、医药等领域具有应用潜力。
酶法是制备琼胶寡糖高效环保的技术手段。琼胶酶可以通过酶解作用将琼胶降解为琼胶寡糖。根据催化糖苷键的类型,可将琼胶酶分为两类:α-琼胶酶和β-琼胶酶[5]。α-琼胶酶产物是以3,6-内醚-α-L-半乳糖为还原性末端的琼寡糖(Agaro-oligosaccharides,AOs);β-琼胶酶产物是以D-半乳糖为还原性末端的新琼寡糖(Neoagaro-oligosaccharides,NAOs)[5]。琼胶酶应用广泛,例如制备琼胶寡糖,从琼脂糖凝胶中回收脱氧核糖核酸,制备海藻原生质体,从海藻中提取生物活性物质[5]。
琼胶酶来源于海洋微生物、海洋软体动物,贝类和土壤等中。产琼胶酶的微生物来源包括交替单胞菌属(Alteromonassp.)[6]、弧菌属(Vibriosp.)[7]、泡囊假单胞菌(Pseudomonas vesicularis)[8]、微泡菌属(Microbulbifersp.)[9]、假交替单胞菌属(Pseudoalteromonassp.)[10]、嗜盐球菌属(Halococcussp.)[11]、嗜麦芽单胞菌属(Stenotrophomonassp.)[12]、交替单胞菌属(Saccharophagus degradans)[13]、火色杆菌属(Flammevirgasp.)[14]等。
一般热琼脂溶液在40 ℃以下时会凝固形成凝胶,粘度也会增大,因此在利用琼胶酶降解琼胶过程中,为提高酶解效率,要求琼胶酶具备一定的热稳定性。因此开发具有良好热稳定性的琼胶酶意义重大。本文中,我们将来自噬琼胶菌AL1(Agarivoranssp.AL1)的热稳定琼胶酶基因进行克隆和表达,研究琼胶酶的酶学性质,以及其酶解产物的抗氧化活性,为该热稳定琼胶酶的应用奠定理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
噬琼胶菌AL1、大肠杆菌BL21(DE3),由本实验室保藏。
1.1.2 主要试剂
TaqDNA聚合酶、T4DNA连接酶、dNTPs、BamHI、SalI和卡那霉素为TaKaRa公司产品;质粒DNA小量纯化试剂盒购买自天根生化科技有限公司;琼脂糖为海川生物科技有限公司产品;其余均为国产分析纯产品。
1.2 主要仪器与设备
双层全温度恒温摇床,上海智城分析仪器制造有限公司;高速离心机,德国Coeppendorf AG Co;超声波细胞粉碎机,宁波新艺超声设备有限公司;冷冻干燥仪,美国Thermo Fisher公司;UltiMate 3000高校液相色谱质谱联用仪,美国赛默飞世尔科技有限公司。
1.3 琼胶酶重组表达质粒的构建
设计噬琼胶菌琼胶酶基因的正向引物序列:5"-CGCGGATCCCTG-CTACCTTAGTCACCTC-3"(划线部分为BamHI酶切位点),反向引物序列:5"-ACGCGTCGACTTACACTTTACGACGTCTTAG-3"(划线部分为SalI酶切位点)。以噬琼胶菌AL1的基因组DNA为模板,进行琼胶酶基因的PCR,反应程序:95 ℃预变性5 min,94 ℃变性45 s,55 ℃退火45 s,72 ℃延伸90 s,以上循环30次;最后在72 ℃延伸10 min。利用1.00%(质量分数)琼脂糖凝胶电泳对PCR产物的大小进行测定,并利用DNA回收试剂盒进行纯化回收。利用BamHI和SalI对目的基因和表达载体pET-28a分别进行双酶切反应,目的基因和表达载体用试剂盒分别回收,它们的连接产物转化至E.coli BL21中。转化细胞涂布至含50 μg/mL卡那霉素的LB固体培养基上,37 ℃过夜培养。经菌落PCR验证后,进行插入序列的测序分析,获得含有琼胶酶基因的重组表达质粒PET-28a-aga。
1.4 重组琼胶酶的诱导表达及纯化
挑取单克隆,接种于含50 μg/mL卡那霉素的LB液体培养基中,在37 ℃、180 r/min培养12 h。把活化好的菌液按1.00%的比例转接于200 mL LB培养基(含卡那霉素50 μg/mL)中,37 ℃、180 r/min摇动培养至OD600值达0.60~0.80。加入异丙基-β-D-吡喃半乳糖苷(IPTG)至终浓度为0.5 mmol/L,在16 ℃低温诱导表达20 h后,将诱导表达的菌液在4 ℃下离心(5000 r/min,20 min)收集菌体。参照Qiagen公司的Ni-NTA使用说明书纯化重组蛋白。收集纯化样品,利用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分析目的蛋白的纯度及其分子量大小。
1.5 琼胶酶活力测定
使用3,5-二硝基水杨酸(DNS)法测定琼胶酶活力。取5 μL酶液(2.00 mg/mL),加入195 μL 0.20%(质量分数)琼脂糖溶液(以50 mmol/L NaH2PO4-Na2HPO4,pH 7.00配制),混合物在50 ℃反应15 min后,加入200 μL DNS溶液终止反应,煮沸10 min。于520 nm处测量还原糖的吸光度。琼胶酶活性定义为:在上述条件下,每min生成1 μmoL还原糖所需的酶量为1个酶活力单位(U)。
1.6 重组琼胶酶的酶学性质研究
1.6.1 琼胶酶的底物特异性分析
以0.20%(质量分数)的琼脂糖、κ-卡拉胶、海藻酸钠、岩藻多糖、羧甲基纤维素钠为底物溶液来检测琼胶酶的活力,研究酶的底物特异性。将5 μL酶液分别与195 μL上述不同底物溶液混合,50 ℃反应15 min,反应完成后用DNS法进行酶活的测定以及计算。此外,将500 μL 50 mmol/L NaH2PO4-Na2HPO4缓冲液(pH 7.0)与200 μL 4 mg/mL人工显色底物(对硝基苯-α-D-吡喃半乳糖苷或对硝基苯-β-D-吡喃半乳糖苷)溶液,置于45 ℃温育5 min。加入500 μL重组酶,45 ℃反应30 min后,加入500 μL 1 mol/L Na2CO3终止反应,在420 nm下测定样品的吸光度值,测定酶的活力,研究酶的底物特异性。
1.6.2 温度对琼胶酶活性和稳定性的影响
以琼脂糖为底物,按照1.5的酶活力测定方法,测定在不同温度(30~70 ℃)下重组酶的活力,并以最高酶活力为100%,研究温度对琼胶酶活性的影响,将琼胶酶置于不同的温度(30~70 ℃)中孵育1 h后,测定酶的残余活力,进行酶的温度稳定性分析,以未经处理的酶活力为100%。
1.6.3 pH对琼胶酶活性和稳定性的影响
配制不同pH的缓冲液:pH 3.00~5.00(柠檬酸-磷酸氢二钠缓冲液)、pH 5.00~7.00(磷酸钠缓冲液)、pH 7.00~9.00(Tris-HCl缓冲液)、pH 9.00~11.00(甘氨酸-NaOH缓冲液),在不同的pH条件下测定酶的活力,从而研究重组酶的最适反应pH。将酶在不同pH缓冲液中于37 ℃孵育1 h后,测定酶的残余活力,以未经处理的酶活力为100%,测定重组酶的pH稳定性。
1.6.4 金属离子对琼胶酶活性的影响
将用蒸馏水透析过的酶液与不同金属离子溶液混合,使其终浓度为1 mmol/L或10 mmol/L,37 ℃放置1 h后,加入0.20%的琼脂糖底物,于50 ℃反应15 min,测定琼胶酶的活力,以未添加金属离子的酶活力为100%。
1.6.5 抑制剂、还原剂、去垢剂和变性剂对琼胶酶活性的影响
将终浓度为1 mmol/L或10 mmol/L抑制剂EDTA或还原剂(DTT和β-巯基乙醇)、0.10%或1%(体积分数或质量分数)去垢剂(tween 20、tween 80、triton X-100和SDS)、1 mol/L或5 mol/L变性剂尿素添加到重组酶中,37 ℃温育1 h后,测定酶的活力。其中,以未添加检测试剂的酶活力为100%。
1.6.6 重组琼胶酶的动力学参数测定
用50 mmol/L磷酸钠缓冲液(pH 7.00)配制浓度为0.50~4.50 mg/mL的琼脂糖溶液,将重组琼胶酶分别与不同浓度的琼脂糖溶液反应,测定琼胶酶的活力。采用Lineweaver-Burk双倒数作图法,计算琼胶酶米氏方程的最大反应速率(Vmax)与底物亲和常数(Km)。
1.6.7 重组琼胶酶的酶解产物分析
将50 U重组琼脂酶和100 mL 0.50%(质量分数)琼脂糖溶液混合后,在50 ℃温育。分别在0~24 h内的不同酶解时间点取样,将样品在硅胶板上点样,展开剂为正丁醇-冰醋酸-水溶液(体积比2:1:1),显色剂使用含10%(体积分数)H2SO4的乙醇溶液,分析不同反应时间的酶解产物。酶解24 h后,煮沸5 min,离心取上清液,上清液加入100 mL乙醇,静置过夜,待不溶物析出后,将上清液用0.22 μm滤膜过滤去除杂质,然后将上清液经旋转蒸发仪除去乙醇并浓缩样品,最后将样品冷冻干燥至粉末状,获得酶解产物。取适量样品粉末,溶于超纯水中,用液相色谱-质谱联用仪(LC-MS)进行分析,液相分析条件为:采用AC-QUITY BEH C18柱,以流动相A(纯乙腈)和流动相B(超纯水)进行梯度洗脱,流速为0.30 mL/min。
1.6.8 酶解产物的抗氧化活性研究
取适量冷冻至粉末状的样品溶于超纯水中,按照Zhu等[15]的方法并稍作修改,进行抗氧化活性的测定。
1.6.9 蛋白序列和结构分析
采用DNAMAN软件对琼胶酶的基因序列进行分析;利用信号肽预测工具SignalP v4.10对琼胶酶的信号肽区域进行预测;在Carbohydrate-Active Enzyme(CAZy)数据库中寻找不同家族来源的特征琼胶酶的蛋白质序列,采用MEGA7.00构建琼胶酶的系统发育树;利用ExPAsy中的ProtParam Tool对琼胶酶的理化性质进行预测分析;采用SMART工具预测琼胶酶的蛋白质结构域;将琼胶酶的蛋白序列提交到SWISS-MODEL网站,经同源比对搜索模板,利用Modeller 9.16软件构建三维模型,并利用Verify-3D对模型进行评分。
1.6.10 数据处理
为了保证实验的准确性和数据的可靠性,上述每组实验重复三次,实验结果用Micro Soft Office 2016进行处理分析,p<0.05代表差异显著。
2 结果与讨论
2.1 噬琼胶菌AL1琼胶酶基因及其编码蛋白质的生物信息学分析

图1 Agarivorans sp.AL1琼胶酶的系统发育进化树Fig.1 Unrooted neighbor-joining phylogenetic tree of Agarivorans sp.AL1 agarase

图2 噬琼胶菌AL1琼胶酶的三维建模Fig.2 3D structure modeling of agarase from Agarivorans sp.AL1
利用DNAMAN进行分析,结果显示,噬琼胶菌AL1琼胶酶基因大小为2988 bp,预测编码995个氨基酸。对琼胶酶的信号肽区域进行预测,结果显示基因编码蛋白质的前27个氨基酸被预测为信号肽,27-28号氨基酸之间为剪切位点。将目的蛋白序列与NCBI蛋白数据库进行比对,结果表明,它与来源于Agarivoranssp.QM38菌株的β-琼胶酶(ABK51379.1)有 99%的相似性,与来源于Agarivoranssp.Alg241-V36菌株的β-琼胶酶(WP_163131938.1)有68%的相似性,与来源于Vibriosp.EJY3菌株的β-琼胶酶(WP_014232191.1)有52%的相似性。系统发育进化分析显示,噬琼胶菌AL1琼胶酶与来自Agarivoranssp.HZ105(ADY17918.1)的琼胶酶在同一分支(图1),后者是GH50家族的代表成员,这些结果表明,噬琼胶菌AL1琼胶酶归属于GH50家族。结构域分析显示,噬琼胶菌AL1琼胶酶包含一个碳水化合物结合模块,位于250~388位氨基酸残基。将该琼胶酶进行三维模建,模板为来源于交替单胞菌(Saccharophagus degradans)的β-琼胶酶晶体结构(PDB登入号:4BQ4),氨基酸残基的范围为207~920位氨基酸残基,覆盖率为69.00%,噬琼胶菌AL1琼胶酶与模板的序列相似性为36.80%。模型利用Verify-3D评分为89.20%,通过评价。构建的噬琼胶菌AL1琼胶酶的部分三维(207~920位氨基酸残基)结构显示,该琼胶酶采用了杂合折叠,该折叠在琼胶酶的N端包含一个β-三明治结构域,并与C端精致的(α/β)8桶融合(图2a)。将噬琼胶菌AL1β-琼胶酶(蓝色)与模板(绿色)进行结构叠合(图2b),模板的催化活性位点Glu534、Glu695(黄色棍状)和噬琼胶菌AL1β-琼胶酶的Glu653、Glu822(红色棍状)高度重合,说明Glu653和Glu822组成可能的噬琼胶菌AL1β-琼胶酶的催化活性位点。
2.2 噬琼胶菌AL1琼胶酶的体外表达和纯化

图3 噬琼胶菌AL1琼胶酶在大肠杆菌中的表达Fig.3 Expression of agarase from Agarivorans sp.AL1 in E.coli
含有琼胶酶基因的E.coliBL21(DE3)经IPTG诱导表达和纯化后,利用SDS-PAGE分析,结果显示,重组蛋白的相对分子质量约为105 ku(图3)。
2.3 重组琼胶酶的酶学性质
2.3.1 酶的底物特异性
分别以琼脂糖、κ-卡拉胶、海藻酸钠、岩藻聚糖、羧甲基纤维素钠作为底物,研究酶的底物特异性,结果显示,重组琼胶酶可以降解琼脂糖,降解其他底物的活性很低(图4),说明该重组酶为琼胶酶。另外,该重组琼胶酶可以特异性地降解对硝基苯-β-D-吡喃半乳糖苷(OD420=0.427),而不降解对硝基苯-α-D-吡喃半乳糖苷(OD420=0.008),表明它可以特异性识别β-糖苷键,不能识别α-糖苷键。上述结果表明,该重组酶属于β-琼胶酶,与来自噬琼胶菌属(Agarivoranssp.JA-1)β-琼胶酶[16]的底物选择性一致。

图4 重组琼胶酶的底物特异性Fig.4 Substrate specificity of the recombinant enzyme
2.3.2 温度和pH对酶活性及稳定性的影响
研究温度对酶活性的影响,结果显示,酶的最适反应温度是 50 ℃,与假交替单胞菌属(Pseudoalteromonassp.Aga3463)[10]和火色杆菌属(Flammeovirgasp.OC4)[14]来源的琼胶酶的最适反应温度相同。重组酶酶在30 ℃和70 ℃时分别具有40.67%和50.12%的酶活力(图5a)。酶的热稳定性分析结果(图5b)显示,重组酶在40 ℃和50 ℃处理1 h后,酶分别具有81.12%和77.71%的残余活力;在60 ℃处理1 h后,仍具有35.31%的酶活力,红球菌属(Rhodococcussp.Q5)琼胶酶[17]在60 ℃温育30 min,具有 20%的残余活性;嗜麦芽单胞菌属(Stenotrophomonassp.NTa)琼胶酶[12]在50 ℃下温育1 h,残余酶活力为46%;噬琼胶卵链菌属(CatenovulumAgarivoransYM01T)琼胶酶[18]分别在50 ℃和60 ℃下温育1 h,残余酶活力分别约为45%和25%。这些结果说明,本文报道的噬琼胶菌AL1来源β-琼胶酶表现出良好的热稳定性。
在不同的pH缓冲溶液中测定酶的最适反应pH,研究pH对酶活性的影响。结果如图5c所示,重组琼胶酶在pH为7.00时活力最高,与交替单胞菌属(Alteromonassp.GNUM-1)[6]、噬琼胶卵链菌属(CatenovulumAgarivoransYM01T)[18]最适作用pH值一致,高于噬琼胶菌属(AgarivoransgilvusWH0801)[19](最适 pH 为 6.00)和假交替单胞菌属(Pseudoalteromonassp.Q30F)[20](最适pH为6.50)来源的琼胶酶。重组琼胶酶在pH 5.00~11.00范围内具有55%以上的酶活力。酶的pH稳定性分析结果如图5d所示,在pH 6.00~7.00保持了较高的pH稳定性,在pH 5.00~11.00的范围内,重组酶具有高于50%的残余活力,说明重组琼胶酶具有宽的pH稳定性,这与嗜麦芽单胞菌属(Stenotrophomonassp.NTa)[12]琼胶酶具有相似性,高于微泡菌属(Microbulbifersp.BH-1)[21]琼胶酶的pH稳定性(pH为10.00时温育30 min,残余酶活性为40%左右)。综上所述,噬琼胶菌AL1琼胶酶具有良好的热稳定性和pH稳定性,使其在食品、化妆品和医疗工业应用中成为非常有吸引力的酶。

图5 温度对重组琼胶酶活性(a)及稳定性(b)的影响和pH对重组琼胶酶活性(c)及稳定性(d)的影响Fig.5 Effects of temperature on activity (a) and thermostability(b) and effects of pH on activity (c) and stability (d) of the recombinant agarase
2.3.3 金属离子对酶活性的影响
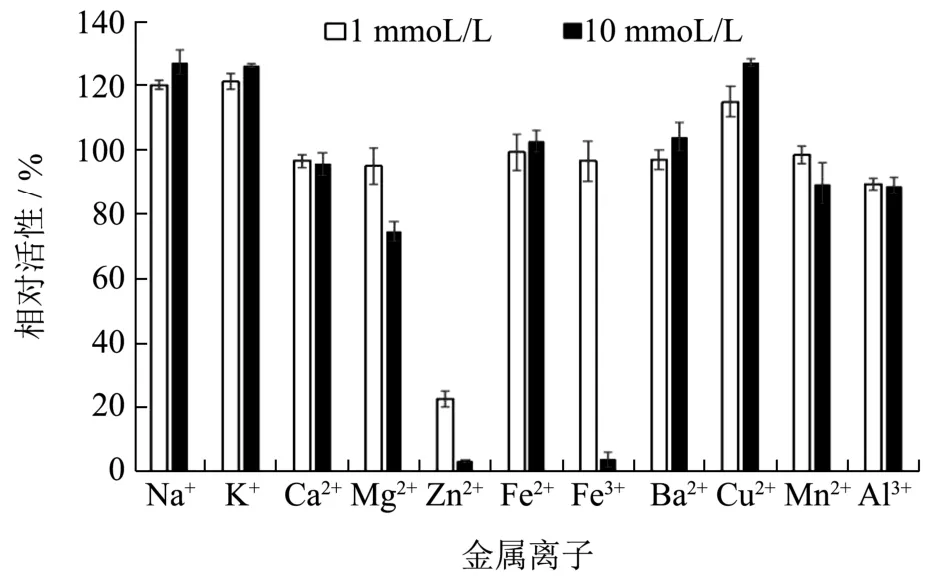
图6 金属离子对重组琼胶酶活性的影响Fig.6 Effects of metal ions on the activity of the recombinant agarase
研究不同金属离子对重组琼胶酶活性的影响,如图6所示,1 mmoL/L或10 mmoL/L的K+、Na+和Cu2+对重组酶活性具有促进作用;1 mmoL/L或10 mmoL/L的Ca2+、Fe2+和Ba2+对重组酶的活性几乎没有影响;10 mmoL/L Mg2+、Zn2+、Fe3+、Mn2+和Al3+对重组酶活性有不同程度的抑制作用,其中Zn2+和Fe3+几乎完全抑制了重组酶的活性。
2.3.4 抑制剂、还原剂、去垢剂和变性剂对酶活性的影响

表1 抑制剂、还原剂、去垢剂和变性剂对重组琼胶酶活性的影响Table 1 Effects of inhibitors, reducing regents, detergents and denaturant on the activity of the recombinant agarase
抑制剂EDTA对琼胶酶活性明显不大(表1),这与Li等[10]的研究结果一致,而An等[18]研究结果表明,EDTA严重抑制噬琼胶卵链菌属(Catenovulum AgarivoransYM01T)琼胶酶的活性。EDTA是一种螯合剂,可以清除二价阳离子并使金属离子依赖性酶失活,这些结果表明,本文中的琼胶酶不是金属离子依赖性酶。本研究中,硫醇还原剂(如DTT和β-巯基乙醇)对重组β-琼胶酶没有明显影响,表明二硫键对其催化活性不是必不可少的,这与Hou等[22]的研究结果一致。重组琼胶酶对去垢剂triton X-100、tween 80、tween 20和SDS具有良好的抗性,处理条件下,仍保持高于65%的残余活力(表1)。此外,重组琼胶酶对变性剂尿素也有较好的抗性,5 mol/L尿素处理后,仍具有74.60%的残余活力(表1)。
2.3.5 重组琼胶酶的动力学参数
以琼脂糖溶液为底物,研究重组琼胶酶的动力学参数。当琼胶酶与不同浓度的琼脂糖进行反应后,通过绘制双倒数曲线,计算出琼胶酶的Km和Vmax分别为13.93 mg/mL和4.37 U/mg。
2.4 琼脂糖酶解产物的鉴定

图7 琼脂糖酶解产物的TLC(a)和MS分析(b)Fig.7 The enzymatic hydrolysis products of agarose determined by TLC (a) and MS analysis (b)
由重组琼胶酶、产生的水解产物通过薄层色谱(TLC)进行鉴定。如图7a所示,在反应初始阶段产生了一系列不同聚合度的新琼寡糖。随着反应时间的延长,高聚合度的寡糖明显减少,反应2 h时TLC出现1个明显的斑点,延长反应时间未见寡糖组成明显变化。将24 h的酶解产物进行MS分析,如图7b所示,在m/z347(M+Na)+有明显的峰,经分析为新琼二糖产物。综上所述,重组琼胶酶为以新琼二糖为最终酶解产物的β-琼胶酶。
2.5 琼脂糖酶解产物的抗氧化活性

图8 重组琼胶酶酶解产物的·OH自由基的清除作用Fig.8 The scavenging effect of ·OH radicals from the hydrolysates of recombinant agarase
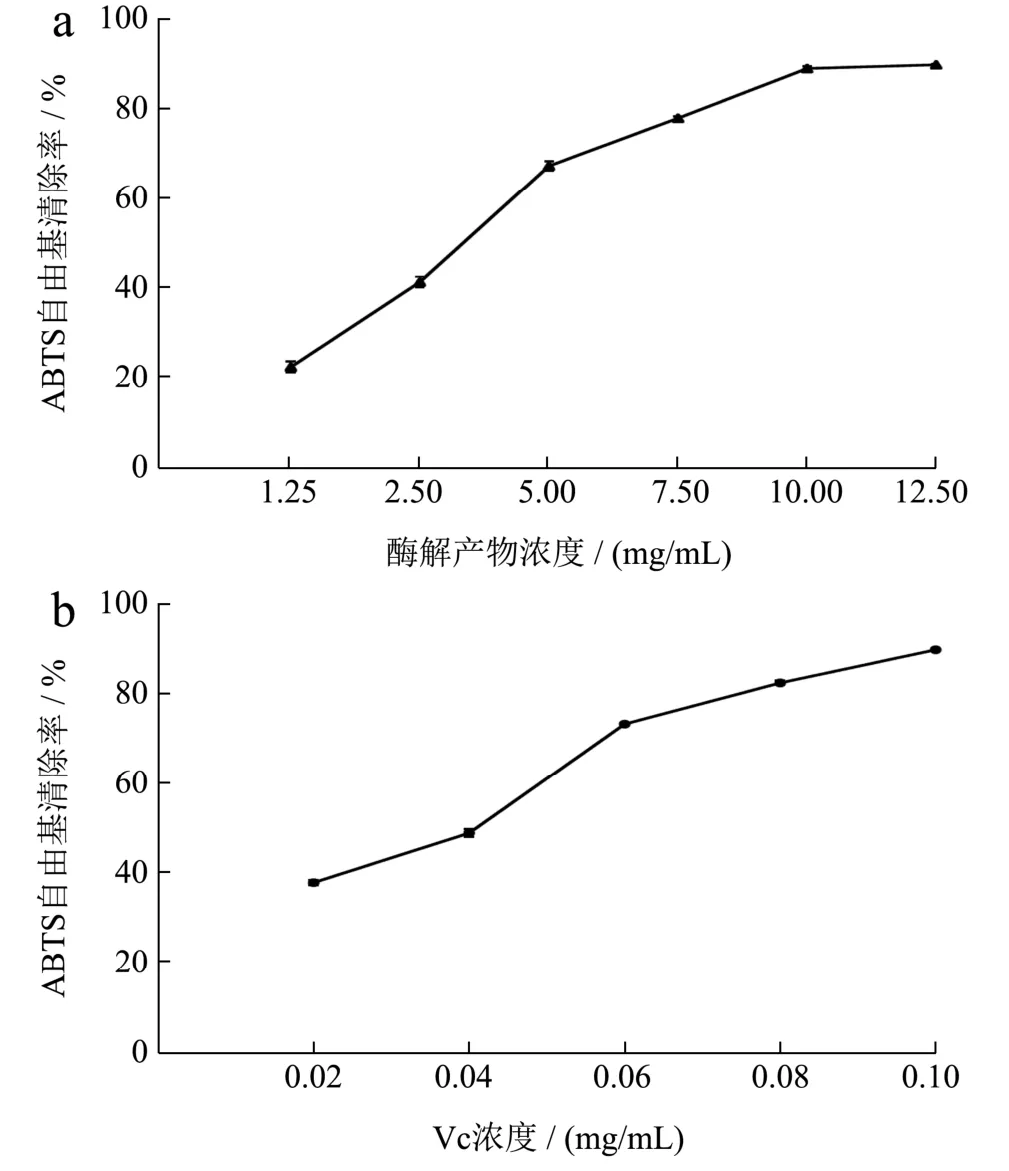
图9 重组琼胶酶酶解产物的ABTS自由基的清除作用Fig.9 The scavenging effect of ABTS free radicals from the digestion products of recombinant agarase

图10 重组琼胶酶酶解产物的DPPH自由基的清除作用Fig.10 The scavenging effect of DPPH free radicals from the digestion products of recombinant agarase
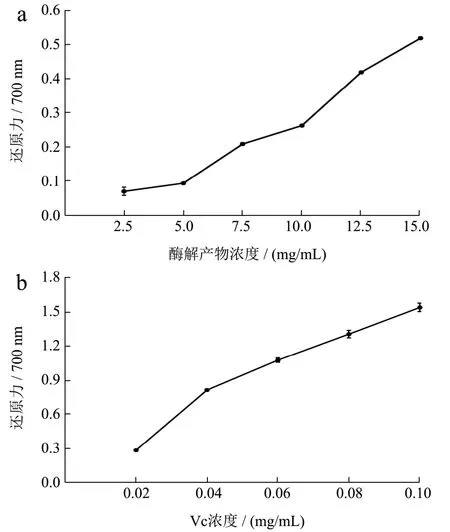
图11 重组琼胶酶酶解产物的还原能力Fig.11 Reducing power of the recombinant agarase digestion products
琼脂糖酶解产物的抗氧化活性通过测定其清除自由基的能力进行研究。如图8a和9a所示,酶解产物对·OH自由基和ABTS自由基的清除能力随着酶解产物质量浓度的增加而增强,当酶解产物质量浓度为10.00 mg/mL时,对·OH自由基和ABTS自由基的清除率分别为91.00%和89.00%,酶解产物对·OH自由基和ABTS自由基的半数抑制剂量IC50分别为 1.28 mg/mL和3.46 mg/mL。由图10a可知,酶解产物的质量浓度为2.50~12.50 mg/mL时,DPPH自由基清除率的增长速率快;当酶解产物的质量浓度为12.50 mg/mL时,产物对DPPH自由基清除率为55.60%,此后清除作用基本不变,酶解产物对DPPH自由基的半数抑制剂量IC50为9.87 mg/mL。如图11a所示,酶解产物对铁离子的还原能力随着浓度的增高而增强,酶解产物的质量浓度为15.00 mg/mL时,还原力(OD700)增加到0.56。上述结果表明,利用噬琼胶菌β-琼胶酶水解琼脂糖的酶解产物具有良好的抗氧化活性。
3 结论
通过对来源于噬琼胶菌AL1的琼胶酶进行体外表达和纯化、酶学性质研究、酶解产物鉴定及抗氧化活性分析。结果表明,来自噬琼胶菌AL1的重组琼胶酶分子质量为105 ku,琼胶酶的最适温度和pH是50 ℃、7.0,在60 ℃处理1 h后,仍具有35.31%的酶活力,在5.00~11.00的宽pH范围内处理1 h,仍具有55%以上的残余酶活力,说明该重组酶具有良好的热稳定性和pH稳定性。该重组酶对去垢剂(triton X-100,tween 20、tween 80和SDS)和变性剂尿素表现出良好的耐受性,有利于该重组琼胶酶的工业应用。利用噬琼胶菌AL1琼胶酶水解琼脂糖的终产物为新琼二糖,产物经分析具有良好的抗氧化活性。新琼二糖具有良好的美白和保湿双重功效,同时也具有一些抗氧化活性防止机体损伤[23],可广泛应用于食品、化妆品和医疗领域。

