嵌合犬瘟热病毒rHBF-vacH株的构建及鉴定
卜研,冯楚楚,闫喜军,薛向红
(中国农业科学院特产研究所,吉林 长春 130112)
犬瘟热(Canine Distemper,CD)是由犬瘟热病毒(Canine Distemper Virus,CDV)感染多种肉食动物而引起的一种急性热性、高度接触性传染病[1]。犬瘟热病毒对不同宿主的易感性和致病性不同,死亡率为50%~100%。半个多世纪以来,犬瘟热防控主要依赖于疫苗免疫,犬瘟热弱毒活疫苗已经在世界范围内被广泛应用,且防控效果不错。然而,近年来,世界各地出现了多起野生动物和家养动物感染犬瘟热发生死亡的报道[2-5],其发生机制尚不清楚。犬瘟热病毒弱毒疫苗株是通过连续鸡胚和细胞系传代致弱获得的,其基因型属于美洲I型[3]。我国犬瘟热病毒流行毒株主要是亚洲I型,并呈现多基因型流行的特征[6]。
犬瘟热病毒属于副黏病毒科麻疹病毒属成员,其基因组是单股负链非分节段的RNA,从3'到5'端依次编码核蛋白(N)、磷蛋白(P)、基质蛋白(M)、融合蛋白(F)、血凝素蛋白(H)和大聚合酶蛋白(L)6个结构蛋白,以及V和C两个非结构蛋白[7]。其中,F和H蛋白暴露于病毒囊膜表面,决定着犬瘟热病毒的细胞嗜性和致病性,同时也是关键的保护性抗原[8,9]。反向遗传技术的发展和成熟,为我们系统性地研究病毒结构与功能、感染与免疫机制提供了强有力的支撑。Veronika von Messling等[10]将犬瘟热病毒疫苗株Onderstepoort的H基因替换为强毒CDV5804株的H基因,比较了其与亲本毒株形成的合胞体大小、F和H蛋白表达量以及病毒生长动力。结果显示,H蛋白决定了病毒感染细胞的趋向性和致病性。2010年Bevan Sawatsky和Veronika von Messling[10]构建了将强毒株CDV5804的H基因替换为onderstepoort H基因的重组病毒5804P-HOL,发现此重组病毒虽然与亲本强毒CDV5804保持了基本一致的生长特性,但却对雪貂完全减毒或无毒。
因此,本研究为了明确我国流行分离的犬瘟热病毒强毒HBF-1的毒力决定基因及其致病机制,利用此前已建立的犬瘟热病毒强毒HBF-1株的反向遗传操作系统,将CDV强毒HBF-1的H基因替换为疫苗毒Onderstepoort的H基因,拯救获得了表达疫苗毒H基因的嵌合病毒rHBF-vacH,该病毒可在Vero-dSlam中稳定传代,且病毒滴度稳定达到107.0 TCID50/mL,超过亲本毒株rHBF-1 105.0 TCID50/mL的滴度。
1 材料与方法
1.1 病毒、细胞、质粒
犬瘟热病毒强毒rHBF-1和疫苗毒Onderstepoort,表达犬源Slam受体的非洲绿猴肾细胞(Vero-dSlam)和仓鼠肾细胞(BSR),质粒pcCDV3.2-HBF-1、pcCDV3.1-N、pcCDV3.1-P和pcCDV3.1-L,均由中国农业科学院特产研究所动物传染病防控创新团队保存。
1.2 主要试剂与仪器
胎牛血清和DMEM培养基购自Gibco;转染试剂X-treme GENE HP DNA Transfection Reagent购自Roche公司;DL 15 000 DNA Marker、DL 2 000 DNA Marker购自TaKaRa;DNA凝胶回收试剂盒、质粒小量提取试剂盒均购自Axygen;总RNA提取试剂盒RNeasy mini kit购自QIAGEN;高保真酶Trans start Fast Pfu DNA polymerase、载体pEASY-Blunt cloning kit和2 Trans StartFast Pfu PCR Super Mix均购自北京全式金生物技术有限公司;各种限制性内切酶和T4 DNA连接酶均购自Thermo公司;CDV N单克隆抗体(MAB)购自VMRD;绿色荧光(FITC)标记的羊抗鼠的二抗购自Proteintech公司;AF6000荧光显微镜购自Leica公司。
1.3 引物的设计与合成
以GenBank公布的犬瘟热病毒疫苗毒Onderstepoort(AF378705)的H基因序列为参考,利用Primer Premier 6.0设计特异性引物见表1,用于扩增疫苗毒Onderstepoort的H基因,引物送上海生工生物工程股份有限公司合成。
表1 Onderstepoort株基因的扩增引物Table 1 Primers of thegene of Onderstepoort strain for a full-length cDNA clone construction

表1 Onderstepoort株基因的扩增引物Table 1 Primers of thegene of Onderstepoort strain for a full-length cDNA clone construction
注:下划线部分为Pme I酶切位点,加粗部分为Pac I酶切位点。Note:The underlined are Pme I site,and the bold are Pac I site.
?
1.4 替换疫苗毒H基因的全长重组质粒的构建
根据QIAGEN总RNA试剂盒的说明,提取病毒Onderstepoort细胞培养悬液的总RNA,对总RNA进行反转录,获得cDNA。使用引物HBF-ORF3-F/R(表1),以Onderstepoort的反转录产物cDNA为模板,用高保真DNA聚合酶进行扩增,PCR产物经1%琼脂糖凝胶电泳鉴定,大小正确后凝胶回收。将回收纯化的H基因目的片段连接至pEASY-Blunt载体上,获得重组质粒pEASY-Blunt-HBF-ORF3;酶切鉴定正确的质粒,送上海生工生物工程技术股份有限公司测序。测序正确的质粒pEASY-Blunt-HBF-ORF3和全长质粒pcCD V3.2-HBF-1分别用限制性内切酶Pme I和Pac I双酶切,之后分别回收纯化目的片段与载体片段,并使用T4连接酶将二者连接,获得的重组连接子用Pme I和Pac I双酶切鉴定,鉴定正确的阳性连接子送至上海生工生物工程技术股分有限公司测序。将测序正确的全长重组质粒命名为pcCDV3.2-HBF-vacH(图1)。

图1 嵌合病毒rHBF-vacH的全长质粒示意图Fig.1 The schematic of a full-length cDNA recombinant plasmid with a replaced H gene of Onderstepoort strain
1.5 嵌合病毒的拯救
转染前1d,于6孔板中接种2 105个BSR细胞/孔,第2天当细胞生长密度达60%以上时开始转染,将全长重组质粒pcCDV3.2-HBF-vacH与辅助质粒pcCD V3.1-N、pcCDV3.1-P和pcCDV3.1-L分别按5g、1g、0.8g和0.5g的比例进行共转染,使用X-treme GENE HP DNA转染试剂22L,具体转染方法参照说明操作,共转染3 h,更换为含10%FBS的DMEM细胞培养液,37℃、5%CO2条件下培养48 h后,取细胞悬液大约300L添加至密度约为80%的Vero-dSlam细胞上,35℃、5%CO2培养5~10 d,观察CDV引起的典型合胞体病变(CPE)。待出现CPE后,冻融收集细胞及上清液,并继续接种Vero-dSlam细胞进行传代,将获得的重组病毒命名为rHBF-vacH。
1.6 rHBF-vacH的RT-PCR鉴定
利用RNA提取试剂盒,分别提取wtHBF-1、rHBF-1和rHBF-vacH病毒悬液的总RNA,反转录合成cDNA,根据普通PCR试剂盒2 Trans StartFast Pfu PCR SuperMix的说明操作,利用引物F3-F:TTCCTTCAAAAGCGTTTAAACTGCAACAAATAGTGGCG和F3-R:GGATTAATTAACACGGTCATCATCCCTCAGTTCAATTGA扩增wtHBF-1和rHBF-1的H基因,用引物HBF-ORF3-F/R扩增rHBF-vacH的H基因,PCR反应总体系50L,其中2 Trans StartFast Pfu PCR Super Mix 25L,上游引物1L,下游引物1L,病毒cDNA 2L,ddH2O补齐至50L;PCR程序为95℃2 min,95℃20 s,59℃20 s,72℃30 s,40个循环;72℃7 min,将3个PCR产物分别回收纯化后,用限制酶Cpo I酶切。Onderstepoort H基因中有Cpo I酶切位点,而wtHBF-1、rHBF-1的H基因中无此识别位点,同时,对从rHBF-vacH扩增获得的H基因片段进行序列测定,确定其来源于Onderstepoort毒株。
1.7 rHBF-vacH的免疫荧光鉴定
将收获的rHBF-vacH病毒悬液接种于Vero-dSlam细胞,待细胞出现CPE后,以多聚甲醛固定,一抗用抗CDV N蛋白单克隆抗体孵育1 h,二抗用FITC标记羊抗鼠IgG染色,最后在荧光显微镜的蓝紫光下观察绿色荧光。
1.8 rHBF-vacH的传代特性
为确定嵌合病毒rHBF-vacH在体外是否稳定遗传,我们将rHBF-vacH在Vero-dSlam细胞上传代9次,取每一代病毒液300L,测定其TCID50,使用软件GrapPad Prism 6.0绘制病毒传代图谱。
2 结果
2.1 嵌合病毒rHBF-vacH的RT-PCR鉴定结果
用1%琼脂糖凝胶电泳,鉴定扩增后酶切产物的条带大小,结果显示,wtHBF-1、rHBF-1的H基因PCR产物不能被限制酶Cpo I切开,酶切产物仍然为2000 bp大小条带,而因为Onderstepoort疫苗株的H基因含有Cpo I酶切位点,因此,嵌合病毒rHBF-vacH的H基因扩增产物被切为两个条带,分别是1 400 bp和600 bp(如图2)。
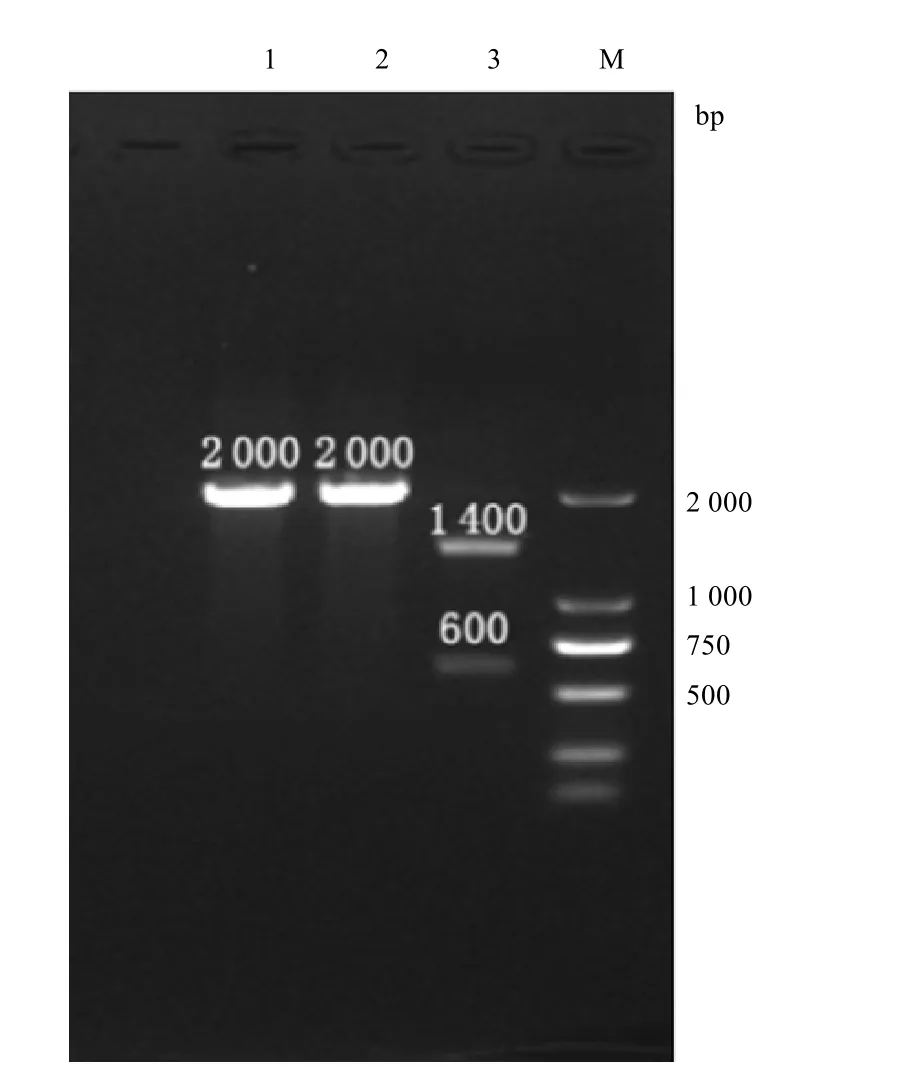
图2 rHBF-vacH的RT-PCR鉴定Fig.2 Digestion identifications of gene of rHBF-vacH
2.2 嵌合病毒rHBF-vacH的免疫荧光鉴定结果
将嵌合病毒rHBF-vacH感染Vero-dSlam细胞,观察到典型细胞病变情况(图3 A),同时空白对照细胞无病变(图3 B),用犬瘟热N蛋白单克隆抗体为一抗、FITC标记的羊抗鼠IgG为二抗,进行间接免疫荧光检测,结果显示,发生病变的细胞能与CDV N蛋白单克隆抗体发生特异性结合,发出绿色荧光,呈阳性信号(图3 C),而空白对照细胞无荧光,为阴性(图3 D)。
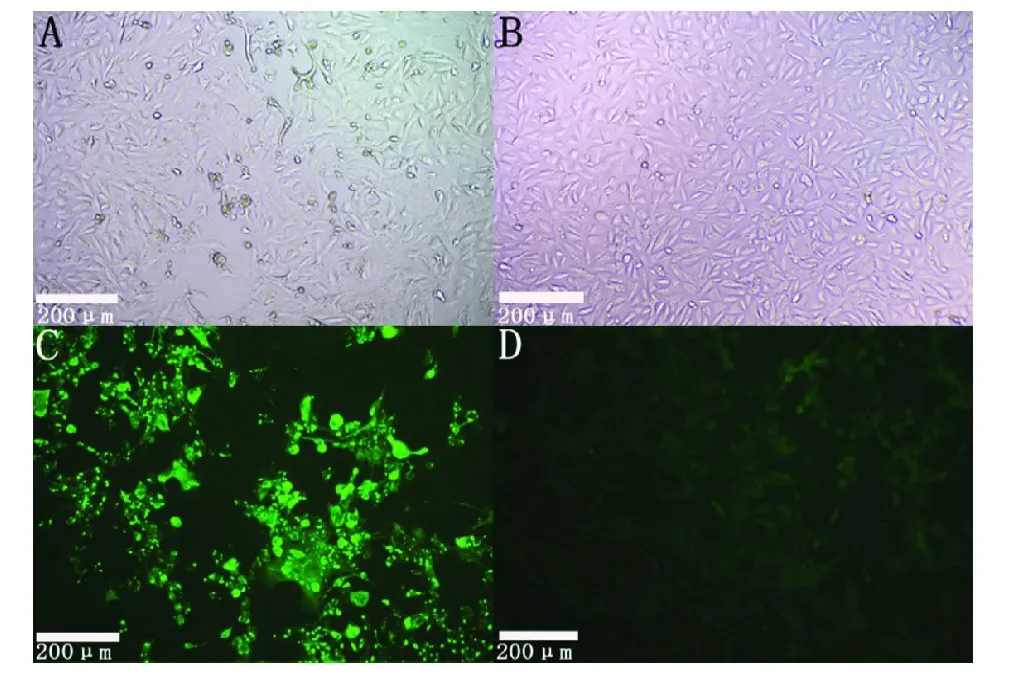
图3 rHBF-vacH的免疫荧光鉴定Fig.3 Immunofluorescence identifications of the rHBF-vacH in Vero-dSlam cells
2.3 rHBF-vacH的形态鉴定
重组病毒rHBF-vacH的细胞感染悬液通过复染,在电子显微镜下观察,结果可见,一个视野下,有直径约为150 nm左右的多个病毒粒子,病毒粒子表面有一层囊膜包裹,因此,可认为是副黏病毒(图4)。

图4 rHBF-vacH粒子的电镜形态Fig.4 The morphology of rHBF-vacHin the electron microscope
2.4 rHBF-vacH在Vero-dSlam细胞上的稳定传代
rHBF-vacH重组病毒可在Vero-dSlam细胞上稳定传代,重组病毒在第2代时有明显病毒滴度的增高。目前,传到第9代时,病毒滴度最高可稳定达到107.0 TCID50/mL(图5),而亲本毒株rHBF-1和野生毒株wtHBF-1的病毒滴度稳定在105.0 TCID50/mL。

图5 rHBF-vacH在Vero-dSlam细胞的传代Fig.5 The virus titers of rHBF-vacH in Vero-dSlam over passages.
3 讨论
近年来,在世界范围内,犬瘟热病毒不断进化,频繁地跨宿主传播,而且致病性呈增长趋势[3]。犬瘟热病毒的H蛋白是各个结构蛋白和两个非结构蛋白中遗传变异能力最大的,不同毒株H基因的核苷酸变异率达到11%[11]。从死亡的恒河猴分离的CDV Monkey-BJ01-DV株,是由犬科动物传播的,CDV H蛋白特定的氨基酸突变导致病毒适于在猴子体内增殖感染[2]。有研究表明,犬瘟热病毒在动物体内的选择压力下,使CDV H蛋白与Slam受体相互作用的附近位点发生有意义突变,因此认为犬瘟热病毒流行毒株H基因的变异可能是导致疫苗免疫失败的原因[12]。在CDV H蛋白上发现了大多数的中和表位,研究证明,CDV H蛋白上的抗原决定部位,在麻疹病毒属中的其他病毒中也被证明是免疫优势表位[13]。H蛋白作为病毒的囊膜蛋白,是诱导保护性中和抗体的关键抗原[14],常被作为开发疫苗的靶标。Yanping Jiang等[15]开发了一种表达CDV H蛋白重组益生菌疫苗,用于鼻内接种,诱发黏膜免疫,动物体内的评价效果较好。Lina Yan等[16]以非复制完全型腺病毒为载体,构建了表达犬瘟热病毒H蛋白和狂犬病毒G蛋白的重组腺病毒rAd5-GH,其在小鼠和狐狸体内激发了稳定持久的保护性免疫应答。H蛋白还是CDV重要的毒力因子,有研究将CDV强毒5804P的H基因替换为疫苗毒株的H基因,获得的重组病毒维持了CDV强毒5804P的生长动力,但却对雪貂完全不致死。该减毒重组病毒在感染初期仍然具有轻微的免疫抑制,与疫苗株相比,减毒重组病毒产生的抗体水平较低[10]。
因此,本研究利用已建立的犬瘟热病毒强毒HBF-1的反向遗传系统,将强毒HBF-1的H基因替换为疫苗毒Onderstepoort的H基因,通过病毒拯救,获得了一株嵌合病毒rHBF-vacH。实验结果表明,嵌合病毒rHBF-vacH的基因组中携带着疫苗毒Onderstepoort的H基因,嵌合病毒rHBF-vacH可以很快适应VerodSlam细胞,从第2代开始,病毒滴度显著提高,之后在Vero-dSlam细胞传代培养,嵌合病毒rHBF-vacH的病毒滴度一直非常稳定,可稳定达到107.0 TCID50/mL。而亲本毒株rHBF-1和wtHBF-1在Vero-dSlam细胞上的病毒滴度稳定维持在105.0 TCID50/mL左右。犬瘟热病毒借助其表面的H蛋白与宿主细胞Slam受体相结合,促进病毒囊膜与细胞膜融合,使犬瘟热病毒的核衣壳侵入细胞[17]。嵌合病毒比亲本病毒的滴度高,其原因可能是疫苗毒的H蛋白与Slam受体亲和力较高,促使携带疫苗毒H基因的嵌合病毒rHBF-vacH更容易在Vero-dSlam间传播增殖。未来,我们将在体内评价比较分离株wtHBF-1和嵌合病毒rHBF-vacH的致病性,为后续犬瘟热疫苗的精准设计提供参考。
——一道江苏高考题的奥秘解读和拓展

