嵌合抗原受体T细胞治疗血液肿瘤所致凝血障碍及相关因素分析*
许倩文 薛磊 汪敏 强萍 王丽 徐慧 张旭晗 许汉英 刘欣 朱薇波 蔡晓燕 刘会兰 孙自敏 杨林 王兴兵
B细胞血液系统恶性肿瘤是常见的血液系统恶性肿瘤,尽管多数患者对目前的一线治疗有反应,但复发率高、预后差,仍然是难治的恶性肿瘤之一[1,2]。CAR-T细胞治疗,即嵌合抗原受体T细胞(chimeric antigen receptor T cells, CAR-T cells)治疗技术是目前最具应用前景的治疗肿瘤的新型靶向细胞治疗技术之一[3],然而,作为一种免疫治疗技术,免疫相关毒副反应是 CAR-T细胞治疗肿瘤临床试验的难点,对其预防、控制及随访监测均存在较多问题有待解决。其中, 细胞因子释放综合征(cytokine release syndrome,CRS)是CAR-T细胞治疗后最常见的并发症,可表现为一般性全身反应如发热、肌痛、关节痛、头痛等,也可以影响到各个器官系统,严重者可危及生命[4]。其中,凝血功能异常是临床上常见的表现之一。目前,针对CAR-T细胞治疗后所致凝血功能异常的研究较少[5,6],本文旨在报道46例接受靶向CD19 CAR-T细胞治疗的B细胞血液系统恶性肿瘤患者出现的凝血功能变化情况及其相关因素分析,以进一步提高对CAR-T细胞治疗安全性的认识。
资料与方法
1 病例资料 收集2016年10月~2020年1月于中国科学技术大学附属第一医院(安徽医科大学附属省立医院)血液内科接受靶向CD19 CAR-T细胞治疗的患者临床资料,排除标准:(1)输注前即有凝血功能异常:包括PT(prothrombin time,PT)延长超过正常值3 s、APTT(activated partial thromboplastin time,APTT)延长超过正常值10 s或Fg(fibrinogen,Fg)<1.5 g/L);(2)治疗前使用抗凝药物;(3)有明确的感染征象或其他可引起凝血功能异常的合并症。最终共46例患者纳入本研究。本研究经本院医学伦理委员会批准(ClinicalTrials.gov临床试验注册号:NCT02851589;伦理批件号:2016伦审第101号)。所有患者或其法定监护人均已签署临床试验知情同意书。
2 CAR-T细胞制备和输注 本研究中CAR-T细胞由博生吉安科细胞技术有限公司制备,其结构包括抗CD19 scFv、CD28共刺激分子和CD3ζ信号域。通过Ficoll-PaqueTM(GE医疗集团)方法采集所纳入患者的外周血单核细胞,使用CD4磁珠(Miltenyi Biotec GmbH)和CD8磁珠(Miltenyi Biotec GmbH)分选富集T细胞。接着通过慢病毒包被、T细胞转染、CAR-T细胞培养等过程完成CAR-T细胞的制备。回输前2周内所有患者均接受FC方案(氟达拉滨,30 mg/m2/天 ×3天;环磷酰胺,300 mg/m2/天×3天)预处理化疗。29例患者为单次回输,17例患者为逐步递增分次回输。4例患者接受人源化CAR-T细胞输注,42例患者接受鼠源化CAR-T细胞输注。
3 资料收集 通过本院电子病历系统收集患者基线信息包括年龄、性别、疾病类型及基因突变、染色体异常、既往治疗情况和输注前肿瘤负荷等。将骨髓原始细胞比例≥5%或存在髓外浸润定义为高肿瘤负荷,将骨髓原始细胞比例<5%但微小残留病变(minimal residual disease, MRD)阳性定义为低肿瘤负荷。分别在预处理化疗前、输注前1天以及CAR-T细胞输注后28天内收集患者外周血,分析全血细胞计数、D-二聚体(D-dimer,D-D)、PT、APTT、凝血酶时间(thrombin time,TT)、Fg和纤维蛋白原降解产物(fibrinogen degradation products,FDP)等水平。D-D、PT、APTT、TT、Fg、FDP的正常范围分别为(0~0.5) mg/L、(10~14) s、(20~40)s、(1.7~4.0) g/L和(0.01~5.00) mg/L。
4 分级与分度 根据ASBMT分级标准[7]对CRS进行分级,根据常见不良反应事件评价标准CTCAE v4.0.3[8]、DIC诊断专家共识[9]及D-D相关研究[10]对凝血指标进行分级。本研究中将D-D>5 mg/L、PT延长>正常值3 s、APTT延长>正常值10 s、TT延长超过正常值、FDP>20 mg/L、Fg<1.5 g/L定义为凝血功能异常。
5 统计学处理 采用描述性统计方法描述患者特征,分类变量用计数(百分比)表示。在相关因素单因素分析中,二分类变量之间的比较采用Fisher精确概率法;两组间服用正态分布的连续性资料采用正态分布的独立样本t检验,用均值±标准差表示;两组间非正态分布的连续性资料采用非参数秩和检验,用中位数(上四分位数~下四分位数)表示。相关因素为连续型变量时采用皮尔逊相关分析;采用K-M曲线分析生存情况,采用Cox回归分析凝血功能异常与长期生存之间的关系。双侧P值<0.05被认为有统计学意义。所有的统计分析均通过SPSS 26.0软件进行。
结 果
1 患者临床特征 共46例接受靶向CD19 CAR-T细胞治疗的复发难治B细胞血液系统恶性肿瘤患者入组,其中男21例,女25例,中位年龄31(6~66)岁。疾病类型包括急性B淋巴细胞白血病40例、B细胞淋巴瘤5例和慢性淋巴细胞白血病1例。治疗前有移植病史者10例。
2 CRS分级及凝血功能异常的发生与处理情况 所有患者均发生CRS反应,各级CRS发生率分别为1级12例(26.1%)、2级14例(30.4%)、3级15例(32.6%)、4级4例(8.7%)、5级1例(2.2%)。回输后1月内出现凝血功能异常的患者为37例(80.4%),D-D、PT、APTT、TT、FDP最大值分别为8.66(0.31~80.00) mg/L、14.35(10.10~29.20) s、51.20(29.00~94.90) s、19.80(14.50~80.60) s、23.38(1.60~120.00) mg/L,Fg最小值为1.565(0.320~5.120) g/L。31例(67.4%)患者出现D-D升高(>5 mg/L),D-D升高的达峰时间为7(3~17)天;7例(15.2%)患者出现PT延长(>正常值3 s),达峰时间为7(6~9)天;25例(54.3%)患者出现APTT延长(>正常值10 s),达峰时间为7(1~14)天;19例(41.3%)患者出现TT延长,达峰时间为9(6~15)天;部分患者因本院DIC全套检测项目更改,未监测FDP水平,18例监测FDP水平的患者中,12例患者(66.7%,n=18)出现FDP升高,达峰时间为6(3~13)天;22例(47.8%)患者出现Fg下降(<1.5 g/L),达谷底时间为9(9~20)天。根据2017年弥散性血管内凝血(disseminated intravascular coagulation, DIC)诊断与治疗专家共识,纳入的患者中有13例患者CDSS评分≥6分,诊断为DIC。4例出现DIC的患者同时出现肾功能损害,但因未进行外周异常红细胞、Coombs试验、血清补体、肾活检等检测,无法明确诊断为血栓性微血管病(thrombotic microangiopathy,TMA)。所有凝血异常均在输注后1个月内恢复。无患者出现危及生命的出血。针对凝血异常的处理方法包括输注血浆、冷沉淀或纤维蛋白原。其中,18例患者接受了纤维蛋白原替代治疗,5例患者接受了冷沉淀输注,28例患者接受了新鲜冰冻血浆的输注。
3 凝血功能异常的相关因素分析 分类变量与凝血指标相关性分析结果见表1。患者性别、肿瘤类型、是否有移植病史、肿瘤负荷和回输的CAR-T细胞种类与各项凝血指标的变化均无显著相关性。单次回输的患者较逐步递增分次回输的患者PT延长更明显(P=0.040),见图1。连续型变量与凝血指标相关性分析结果见表2,年龄以及输注时血细胞水平与各项凝血指标的变化无显著相关。输注后的炎症指标水平与凝血指标的变化有相关性。其中,输注后CRP的水平与APTT、FDP相关;SF的升高水平与D-D、TT、Fg相关;白介素(interleukin, IL)-6升高与TT延长相关;IL-10升高与D-D升高、FDP升高密切相关;IL-2、干扰素(interferon, IFN)γ、肿瘤坏死因子(tumour necrosis factor,TNF)α及Granzyme B的水平与各项凝血指标均无明显相关。进一步分析显示,CRS等级与所有指标均有相关性,见图2,CRS等级越高,D-D升高、PT、APTT、TT延长、FDP升高更明显,Fg下降更明显,其中相关性程度FDP>D-D>APTT>TT>Fg>PT。

图1 CAR-T细胞输注后PT最大值在单次回输组和逐步递增分次回输组中具有统计学差异,逐步递增多次回输的患者PT延长较轻
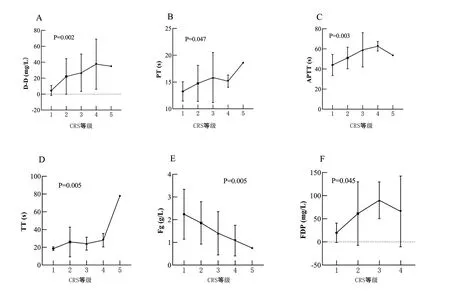
图2 CAR-T细胞输注后出现CRS等级与各凝血指标最大值之间均有显著相关性,CRS等级越高,D-D升高、PT延长、APTT延长、TT延长、Fg下降、FDP升高越明显
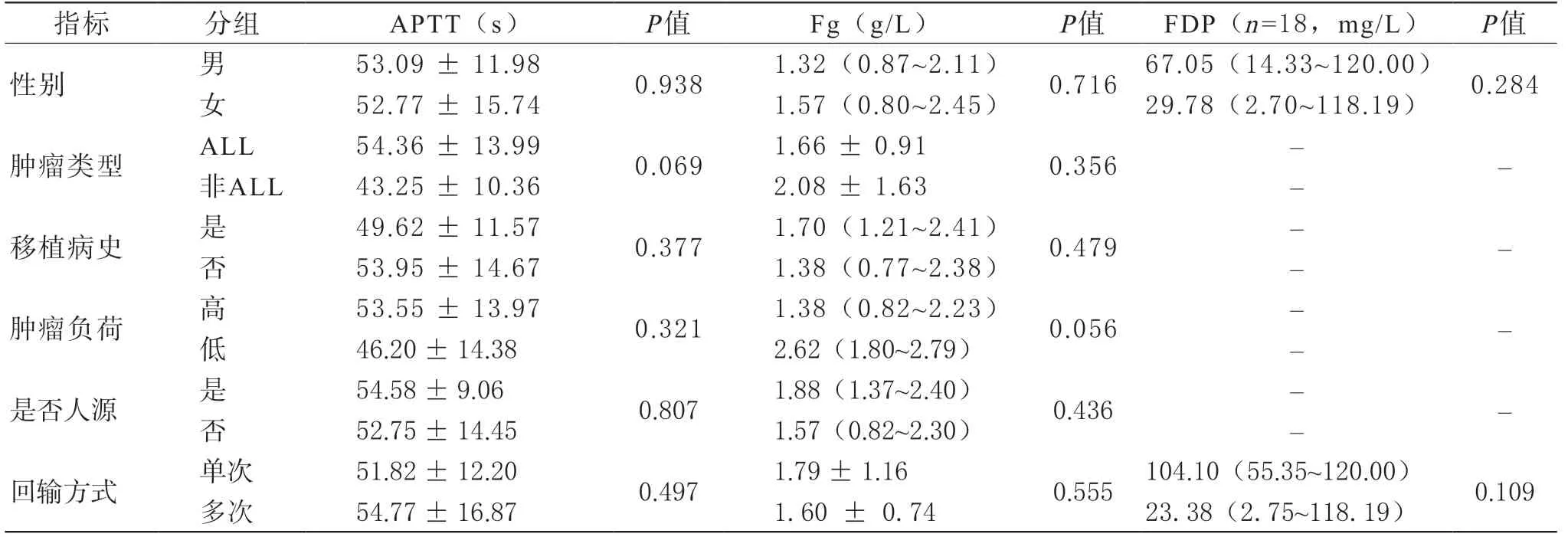
表1 (续) 分类变量与凝血指标的相关因素分析
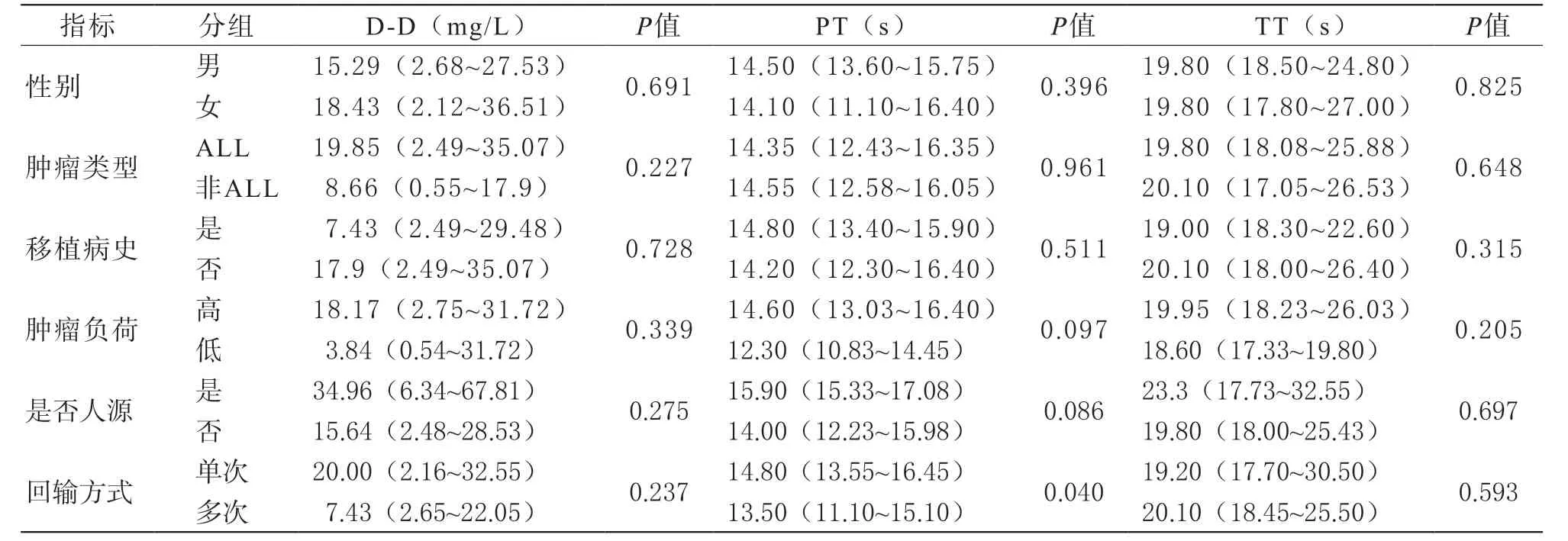
表1 分类变量与凝血指标的相关因素分析

表2 连续型变量与凝血指标的相关因素分析
我们进一步分析了DIC的发生与CRS严重程度的相关性。因ASBMT分级标准未将凝血功能异常纳入,我们根据Penn分级系统对CRS进行分级,将≥3级CRS定义为重度,<3级CRS定义为轻度。结果显示DIC的发生与严重CRS具有显著相关性(表3,P<0.001)。

表3 DIC与CRS严重程度相关因素分析
4 凝血功能异常与长期生存的相关因素分析 纳入的46名患者中,3例治疗无效,1例因不良反应较重,治疗后2周内去世,无法评估疗效,总CR率为91.3%(42/46)。ALL患者CR率为92.5%(37/40),获得CR的患者在11.4个月的中位随访时间内(范围:1.2~41.1个月),中位EFS和OS分别为10和20.4个月,1年EFS率和OS率分别为40.6%和62.2%;对总患者进行长期生存的相关因素分析(表4),结果提示治疗后D-D的峰值(P=0.014)、FDP峰值(P=0.022)、Fg谷值(P=0.024)与EFS有显著相关性,各项凝血指标与OS均无显著相关性。 进一步分析提示DIC的发生与否与EFS(P=0.872)和OS(P=0.263)均无显著相关性。

表4 凝血指标与EFS及OS相关因素分析
讨 论
在目前的临床试验中,CAR-T细胞治疗血液系统恶性肿瘤后凝血功能异常的发生率较高[6,11-13],我们的研究中,37例(80.4%)患者出现凝血指标异常。诱发凝血功能异常的常见病因包括严重感染、外伤、恶性肿瘤等[9]。相关研究显示,炎症反应与凝血功能之间也存在密切联系[14]。炎症诱导凝血激活的主要介质是促炎细胞因子,例如,IL-6、TNF-α和IL-1在凝血机制中起了重要作用[15-17]。CAR-T细胞治疗后会引起广泛性免疫激活以及血清炎症标志物如C反应蛋白(C-reactive protein,CRP)、血清铁蛋白(serum ferritin,SF)及炎症因子如IFN-γ、IL-6、IL-8、IL-10等水平显著升高[18],从而影响各器官系统功能。血小板内皮细胞粘附分子(platelet endothelial cell adhesion molecule,PECAM-1)是一种在内皮细胞间连接处高度表达并维持血管内皮完整性的分子[19],大量释放的炎性因子会破坏血管内皮细胞及内皮屏障的完整性,导致细胞表面PECAM-1减少,血浆可溶性PECAM-1升高[20]。并且内皮损伤会导致组织因子(tissue factor,TF)过度表达,激活外源性凝血途径[21]。研究显示发生严重凝血功能障碍患者血浆的TF和PECAM-1浓度同步升高[21],这证实大量细胞因子释放可导致血管内皮细胞功能障碍,破坏内皮屏障的完整性,从而出现凝血功能障碍[22]。我们的研究发现,输注后的炎症标志物如CRP、SF及炎症因子包括IL-6、IL-10水平与凝血指标的变化具有明显相关性,其他类似的研究同样提示CRP、SF、IL-6与凝血指标的变化有关[6,23]。进一步分析提示CRS的严重程度与凝血指标的变化有明显相关性,CRS等级越高,D-D升高、PT延长、APTT延长、TT延长、Fg下降、FDP升高则越明显,且严重CRS与DIC的发生有着明显的相关性。在本研究中,我们观察到细胞因子和炎症标志物的升高与凝血功能紊乱的严重程度相关,另一方面,IL-6、CRP和SF在出现严重CRS的患者血清中明显升高,尤其是IL-6似乎在CRS的病理生理过程中起着关键作用[24,25]。这些结果进一步证实了CAR-T细胞治疗后的CRS、炎症因子升高以及凝血功能异常之间的密切联系。
值得一提的是,我们还发现剂量递增分次回输CAR-T细胞可以减轻细胞输注后的PT延长。患者首先接受低剂量的CAR-T细胞,如果没有观察到明显的不良反应,再予以更高的剂量输注。这种回输方式或许可以通过减轻肿瘤负荷来减轻输注后的炎症反应,从而减轻凝血功能异常。由于CAR-T细胞治疗的药代动力学和毒性反应有显著的个体差异性,剂量递增分次回输也许是一种可以减轻不良反应的回输方式[26],但仍需更多的样本量来进一步证实。
本研究中,凝血功能异常主要发生在细胞输注后1月以内,经对症处理均可恢复正常。WANG等人报道凝血障碍主要发生在CAR-T细胞输注后第6~20天[6],MEI等人报道D-D、FDP和APTT水平在输注后第8天和第9天达到峰值[5],我们观察到的凝血参数的变化与他们的相似。因此,临床上应警惕接受CAR-T细胞后的患者出现凝血功能障碍,特别是在输注后1~3周之间。
本研究纳入的患者中,共18名患者接受了纤维蛋白原输注,多为出现3级及以上CRS且Fg<1.5 g/L,或有明显的出血症状的患者;部分患者同时接受了冷沉淀的输注。对于PT、APTT明显延长的患者予以输注新鲜冰冻血浆。根据最新的文献报道[27],低纤维蛋白原是CRS相关性凝血障碍的一个敏感的指标,建议在3级或4级CRS期间和之后加强监测,并且对纤维蛋白原<1.5 g/L的患者予以纤维蛋白原替代治疗。对于出血风险高或者已出现较严重出血症状的患者接受纤维蛋白原输注也是可以的,可以降低出血风险。根据治疗CRS相关性凝血障碍和低纤维蛋白原血症的临床指南,也可以用冷沉淀或纤维蛋白原浓缩物替代纤维蛋白原[27]。本研究中,尽管未发现DIC的发生与长期生存之间的相关性,但D-D、Fg、FDP的异常水平能一定程度上影响EFS,所以对于CAR-T细胞治疗的患者,尤其是术后出现较重CRS、明显的凝血功能异常或DIC的患者,建议加强监测纤维蛋白原、PT、APTT、血小板水平和临床出血情况,及时进行干预,以防止在严重血小板减少和凝血障碍的情况下增加出血风险,影响患者的长期预后情况。
总的来说,我们的研究表明CAR-T细胞输注后的凝血功能障碍较常见,且与CRS严重程度及输注后的细胞因子水平密切相关,选择逐步递增分次回输的方式可以减轻输注后的凝血功能异常。早期识别和有效及时的处理对于控制凝血功能障碍引起的更严重并发症是至关重要的。
利益冲突所有作者均声明不存在利益冲突

