党参多糖对溃疡性结肠炎大鼠结肠上皮NF-κB 信号通路的影响
刘雪枫乔 婧高建德 陈正君刘 雄*
(1.甘肃中医药大学药学院,甘肃 兰州 730000;2.甘肃省中藏药化学与质量研究省级重点实验室,甘肃兰州 730000;3.甘肃省中药质量与标准研究重点实验室,甘肃 兰州 730000)
溃疡性结肠炎(ulcerative colitis,UC)是一种多因素导致的原因不明的慢性炎性肠病之一,以腹泻、腹痛、血便为主要临床症状,近年来发病率明显升高、发病人群趋于年轻化[1-2],是世界卫生组织公认的难治性疾病之一,易反复发作[3]。目前常用治疗药物包括水杨酸类、皮质激素类、免疫抑制剂等,但均不能根治UC 的发作,且不良反应较多。近年来,中药以多靶点、多组分的特点,已成为UC 的重要治疗药物。
党参为桔梗科党参 Codonopsis pilosula(Franeh.)Nannf.、素花党参 Codonopsis pilosula Nannf.Var.modesta(Nannf.)L.T.Shen 或川党参Codonopsis tangshen Oliv.的干燥根,主要有效成分为党参皂苷、党参多糖等,具有补中益气、健脾益肺的功效,临床上常用于治疗脾肺气虚、咳嗽虚喘、内热消渴等症[4],相关方剂广泛应用于发作期、缓解期溃疡性结肠炎的治疗[5]。研究表明,党参多糖具有明显的抗氧化、免疫调节作用[6]。本实验探讨党参多糖对溃疡性结肠炎大鼠的保护作用,并通过NF-κB 信号通路探讨其可能作用机制,为该成分利用提供一定理论依据。
1 材料
1.1 动物 SPF 级雄性Wistar 大鼠50 只,体质量(220±10)g,由甘肃中医药大学动物实验中心提供,动物合格证号NO.62001000000208,使用许可证号SYXK(甘)2015-0005,在温度22~24 ℃、相对湿度40%~60%下以普通饲料喂养。
1.2 试剂与药物 党参购于兰州复兴厚中药饮片有限公司,批号20180319,经甘肃中医药大学王明伟副教授鉴定为桔梗科植物党参Codonopsis pilosula(Franch.)Nannf.的根。柳氮磺胺吡啶(SASP,上海信谊天平制药厂,批号180625);2,4,6-三硝基苯磺酸(TNBS,天津大茂化学试剂厂,批号180402);超氧化物歧化酶(SOD)、丙二醛(MDA)检测试剂盒(南京建成生物工程研究所,批号分别为20180514、20180522);白介素-6(IL-6)、白介素-10(IL-10)、肿瘤坏死因子(TNF-α)酶联免疫法(ELISA)检测试剂盒(江苏酶免生物科技公司,批号分别为0190R2、0195R2、0180R2);RNA 提取试剂盒、cDNA 反转录试剂盒、实时荧光定量PCR 检测试剂盒(德国Qiagen 公司,批号分别为157042224、160017598、157056248);小鼠SP试剂盒、兔SP试剂盒、DAB 显色试剂盒(北京中杉金桥科技有限公司,批号分别为SP-9002、SP-9001、ZLI-9018);NFκB 一抗(美国Genetex 公司,批号GTX107678);IL-6、IL-10、TNF-α 引物序列均由上海生工生物公司合成,见表1。水合氯醛(郑州市德众化学试剂厂,批号181204505);多聚甲醛、中性树胶、伊红、苏木素(北京索莱宝科技有限公司,批号分别为G7301、G8590、G070、G080)。

表1 引物序列Tab.1 Primer sequences
1.3 仪器 Primo 高速离心机(德国Heraeus 公司);5424R 高速冷冻离心机(德国Eppendorf 公司);KD-BM 包埋机(浙江省金华市科迪仪器有限公司);切片机(德国徕卡公司);iMark 酶标仪(美国Bio-Rad 公司);NanoDrop 核酸浓度测量仪(美国Thermo 公司);DM7500 实时定量PCR 仪(美国Agilent 公司);ImageQuant 400 凝胶成像系统(英国GE Healthcare 公司);RX50 显微镜(宁波舜宇仪器有限公司);AE-240 电子天平[梅特勒-托利多仪器(上海)有限公司]。
2 方法
2.1 药物制备 取粉碎药材500 g,加3 倍体积石油醚回流脱脂2 次,加入3 倍体积95%乙醇,回流提取6 h,弃去提取液,重复3 次,滤渣60 ℃恒温干燥,加入蒸馏水,以固液比1∶10 提取3 次,每次1 h,合并提取液,并加入无水乙醇使其含醇量达到80%,低温静置24 h,沉淀真空干燥,即得党参多糖,得率为16.39%。经Savage 法脱蛋白后,以苯酚-硫酸法测得多糖质量分数为90.21%。
2.2 分组、建模及给药 50 只大鼠适应性喂养后,按体质量随机分为5 组,每组10 只,分别为正常组,模型组,SASP 阳性对照组(0.3 g/kg)及党参多糖高、低剂量组(9、3 g/kg,按生药量计算,为成人临床剂量的30、10 倍),正常组和模型组灌胃等体积蒸馏水,其余各组给予相应药物灌胃,每天1 次,连续5 d。大鼠禁食36 h,水合氯醛麻醉,正常组以生理盐水灌肠,其余各组均以TNBS/乙醇溶液灌肠,具体方法参考文献[7]。造模后,连续3 d 监测疾病活动指数(DAI),DAI>0.5 表明造模成功,继续给药21 d。
2.3 一般行为及DAI 评分 给药期间,观察大鼠精神状态、进食情况、毛色光泽、腹泻、黏液便、血便等一般情况,进行DAI 评分,见表2,计算公式为DAI=(体质量下降评分+粪便性状评分+大便隐血评分)/3。

表2 DAI 评分Tab.2 DAI scores
2.4 结肠黏膜损伤指数(CMDI)评分 末次给药30 min 后,大鼠禁食不禁水36 h,水合氯醛麻醉后解剖,取从肛门向上至8 cm 处的结肠组织,纵向剖开,生理盐水洗净,平铺固定观察结肠黏膜大体形态改变:0 分,无损伤;1 分,轻度充血,水肿,表面光滑,无糜烂或溃疡;2 分,充血水肿,黏膜粗糙呈颗粒状,有糜烂或肠粘连;3 分,高度充血水肿,黏膜表面有坏死及溃疡形成,溃疡最大纵径小于1.0 cm,肠壁增厚或表面有坏死及炎症;4 分,在3 分基础上溃疡最大纵径大于1.0 cm或大鼠死亡。
2.5 苏木精-伊红(HE)染色 将1 cm 大鼠结肠组织,PBS 漂洗干净后4%多聚甲醛固定,梯度酒精脱水,常规石蜡包埋切片,HE 染色,光镜下观察组织病理学形态变化。
2.6 结肠组织中生化指标检测 取适量大鼠结肠组织,生理盐水制成10% 匀浆,离心取上清后,按照试剂盒方法检测SOD 活性和MDA 水平。
2.7 ELISA 法检测UC 大鼠结肠组织中IL-6、IL-10、TNF-α 水平 取适量大鼠结肠组织,加入生理盐水制成10%匀浆,离心取上清,按照ELISA 试剂盒使用书测定IL-6、IL-10、TNF-α 水平。
2.8 实时荧光定量-聚合酶链式反应(RT-PCR)法测定IL-6、IL-10、TNF-α mRNA 表达 取适量大鼠结肠组织,加入液氮研磨,按照RNA 提取试剂盒说明书提取RNA,采用多功能酶标仪测定样品浓度。在PCR 扩增仪上将RNA 逆转录为cDNA,之后进行RT-PCR 反应,反应条件为95 ℃预变性10 min,95 ℃变性15 s,60 ℃退火60 s,72 ℃延伸5 min,共40 个循环。应用2-ΔΔCT方法计算各基因相对表达,重复3 次。
2.9 免疫组化法观察结肠组织中NF-κB 表达 切取3 mm 大鼠结肠组织,石蜡包埋后切制成5 μm切片,常规脱蜡,梯度70% 乙醇水化,柠檬酸钠热修复2 次,3% 过氧化氢封闭内源性过氧化物酶,山羊血清封闭液封闭30 min,每张切片滴加一抗NF-κB(1∶200),4 ℃冰箱过夜,PBS 冲洗后滴加聚合HRP 标记抗兔IgG,37 ℃孵育30 min,PBS冲洗后DAB 显色10 min 左右,室温下苏木素复染90 s,自来水冲洗,梯度乙醇脱水,二甲苯Ⅰ、Ⅱ各反应25 min,中性树胶封片。显微镜观察结肠组织中NF-κB 表达情况,Image J 软件统计蛋白表达量。
2.10 蛋白免疫印迹法(Western blot)测定结肠组织中NF-κB 蛋白表达 取适量大鼠结肠组织,加入适量蛋白裂解液匀浆,3 500 r/min 离心15 min,取上清,BCA 法检测蛋白浓度,并将其调整为4 μg/μL,加热变性后-80 ℃保存。在制胶、上样10 μL、电泳、湿转法转膜、5% 脱脂奶粉封闭、一抗4 ℃过夜、二抗孵育1 h 后,加入ECL 化学发光液,立即进行蛋白化学发光并获取图像,以β-actin 为内参,Image J 软件计算灰度值。
2.11 统计学分析 通过SPSS 19.0 软件进行处理,数据以()表示,组间比较采用单因素方差分析(One-way ANOVA),方差齐者用LSD 法,不齐者用Games-Howell 法检验。 P<0.05 表示差异具有统计学意义。
3 结果
3.1 党参多糖对UC 大鼠一般行为及DAI 评分的影响 造模后,除正常组外,其余大鼠均出现体质量下降、懒动、竖毛、厌食症状,有明显腹泻,甚至出现便血,DAI 评分升高(P<0.01)。给药后,正常组大鼠一般情况良好,自主活动正常,饮食正常,毛色有光泽,无腹泻便血发生;模型组大鼠出现懒动,竖毛,厌食症状,有腹泻发生,甚至出现便血,体质量降低;党参多糖高、低剂量组大鼠一般情况较模型组好,毛色有光泽,自主活动增加,腹泻发生率低于模型组,同时各给药组DAI 评分下降(P<0.05,P<0.01),见表3。
3.2 党参多糖对UC 大鼠CMDI 评分的影响 正常组大鼠结肠颜色淡红,表面光滑,肠壁厚薄适中,黏膜皱襞清晰完整;模型组大鼠肠壁红肿充血,溃疡明显,溃疡面积较对照组扩大(P<0.01);党参多糖组大鼠亦可见结肠水肿、充血或黏膜粗糙,但较模型组有明显改善(P<0.05,P<0.01)。CMDI评分见表3。
表3 UC 大鼠DAI、CMDI 评分(,n=10)Tab.3 DAI and CMDI scores for UC rats(,n=10)

表3 UC 大鼠DAI、CMDI 评分(,n=10)Tab.3 DAI and CMDI scores for UC rats(,n=10)
注:与正常组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
3.3 党参多糖对UC 大鼠结肠组织形态学的影响图1 显示,正常组大鼠染色均匀,细胞核形态正常,肠黏膜及基层清晰可见;与正常组比较,模型组大鼠有大量炎性细胞浸润,黏膜层损伤严重,基层分界线消失;与模型组比较,SASP 组大鼠炎性细胞浸润减少,黏膜损伤较轻;与模型组比较,党参多糖组大鼠炎性细胞减少,黏膜层损伤较轻,基层较清晰。
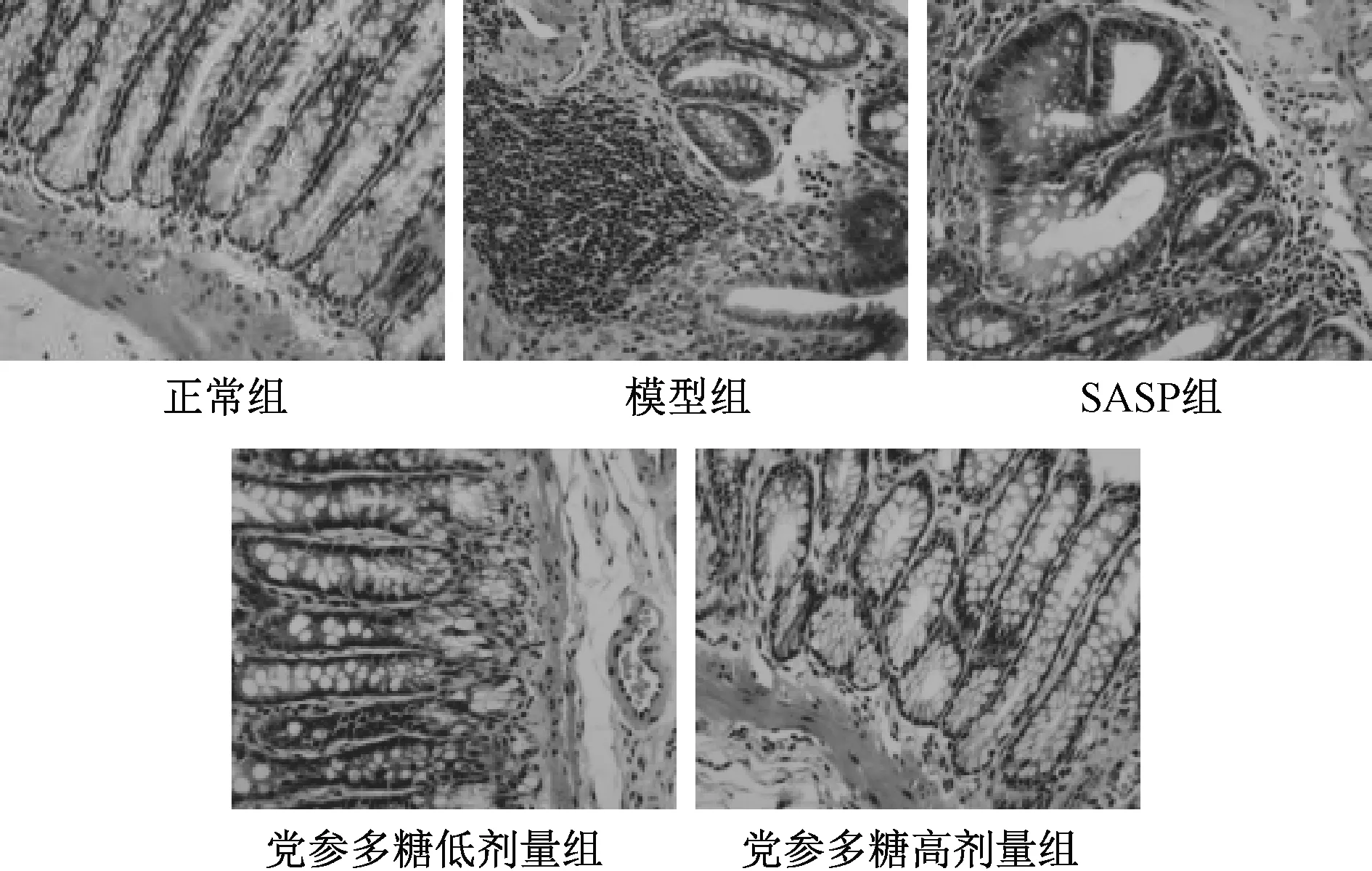
图1 党参多糖对UC 大鼠结肠组织形态学的影响(HE,×200)Fig.1 Effect of CPPs on the colonic histomorphology of UC rats(HE,×200)
3.4 党参多糖对UC 大鼠结肠组织中SOD 活性和MDA 水平的影响 如表4 所示,与正常组比较,模型组大鼠结肠黏膜组织SOD 活性降低(P <0.01),MDA 水平升高(P <0.01);与模型组比较,SASP 组大鼠结肠黏膜组织SOD 活性升高,MDA 水平下降,差异有统计学意义(P <0.01);与模型组比较,党参多糖组可提高大鼠结肠黏膜中SOD 活性(P<0.01),降低MDA 水平(P<0.01),高剂量组效果略优于SASP 组,但差异无统计学意义(P>0.05)。
表4 党参多糖对UC 大鼠结肠组织中SOD 活性、MDA水平的影响(,n=10)Tab.4 Effects of CPPs on colonic SOD activity and MDAlevel of UC rats(,n=10)
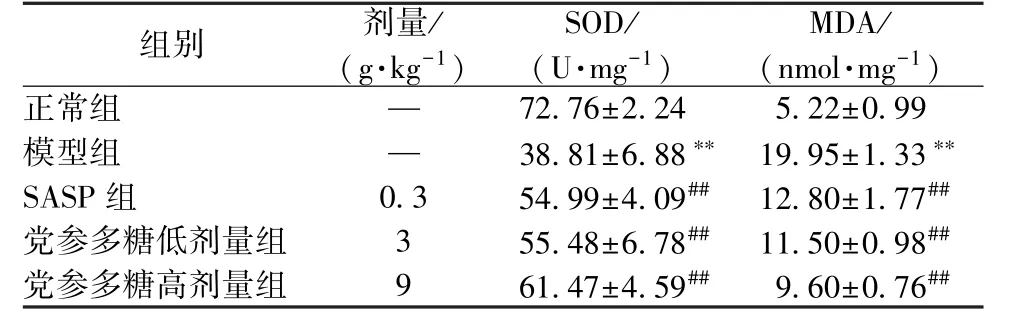
表4 党参多糖对UC 大鼠结肠组织中SOD 活性、MDA水平的影响(,n=10)Tab.4 Effects of CPPs on colonic SOD activity and MDAlevel of UC rats(,n=10)
注:与正常组比较,**P<0.01;与模型组比较,##P<0.01。
3.5 党参多糖对UC 大鼠结肠组织中IL-6、IL-10、TNF-α 水平的影响如表5 所示,与正常组比较,模型组大鼠结肠组织中IL-6、TNF-α 水平升高(P<0.01),IL-10 水平降低(P<0.01);与模型组比较,SASP 组和党参多糖高、低剂量组大鼠结肠组织中IL-6、TNF-α 水平降低(P <0.05,P <0.01),IL-10 水平升高(P<0.01),高剂量组效果优于SASP 组和党参多糖低剂量组,但差异无统计学意义(P>0.05)。
表5 党参多糖对UC 大鼠结肠组织中IL-6、IL-10、TNFα 水平的影响(,n=10)Tab.5 Effects of CPPs on the levels of IL-6,IL-10 and TNF-α in colon tissue of UC rats(,n=10)

表5 党参多糖对UC 大鼠结肠组织中IL-6、IL-10、TNFα 水平的影响(,n=10)Tab.5 Effects of CPPs on the levels of IL-6,IL-10 and TNF-α in colon tissue of UC rats(,n=10)
注:与正常组比较,** P <0.01;与模型组比较,# P <0.05,##P<0.01。
3.6 党参多糖对UC 大鼠结肠组织中IL-6、IL-10、TNF-α mRNA 表达的影响如表6所示,与正常组比较,模型组大鼠结肠组织IL-6、TNF-α mRNA 表达升高(P <0.01),IL-10 mRNA 表达降低(P <0.01);SASP 组较模型组抑制 了IL-6、TNF-α mRNA 表达,提高了IL-10 mRNA 表达(P<0.05);给予党参多糖高、低剂量组干预后,IL-6、TNF-α mRNA 表达较模型组降低(P<0.01),IL-10 mRNA表达升高(P<0.01)。
表6 党参多糖对UC 大鼠结肠组织中IL-6、 IL-10、 TNFα mRNA 表达的影响(,n=10)Tab.6 Effects of CPPs on the mRNA expressions of IL-6,IL-10 and TNF-α in the colon tissue of UC rats(,n=10)

表6 党参多糖对UC 大鼠结肠组织中IL-6、 IL-10、 TNFα mRNA 表达的影响(,n=10)Tab.6 Effects of CPPs on the mRNA expressions of IL-6,IL-10 and TNF-α in the colon tissue of UC rats(,n=10)
注:与正常组比较,** P <0.01;与模型组比较,# P <0.05,##P<0.01。
3.7 党参多糖对UC 大鼠结肠组织中NF-κB 表达的影响 如图2、表7 所示,与正常组比较,模型组大鼠结肠黏膜中NF-кB 表达升高(P <0.01),SASP 组较模型组减少(P<0.05);与模型组比较,党参多糖高、低剂量组均能减少NF-кB 表达(P<0.01),并与给药剂量呈正相关;党参多糖高剂量组作用比SASP 组更显著(P <0.01)。如图3 所示,与正常组比较,模型组大鼠结肠组织中NF-кB p65 蛋白表达升高(P<0.01);SASP 组NF-кB p65蛋白表达降低(P<0.05),党参多糖高、剂量组抑制了NF-кB p65 蛋白表达,差异均具有统计学意义(P<0.01),与免疫组化结果一致。
表7 党参多糖对UC 大鼠结肠组织中NF-κB 蛋白表达的影响(,n=3)Tab.7 Effect of CPPs on the expression of NF-κB protein in the colon tissue of UC rats(,n=3)

表7 党参多糖对UC 大鼠结肠组织中NF-κB 蛋白表达的影响(,n=3)Tab.7 Effect of CPPs on the expression of NF-κB protein in the colon tissue of UC rats(,n=3)
注:与正常组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与SASP 组比较,△P<0.05,△△P<0.01。

图2 各组大鼠结肠组织中NF-κB 蛋白表达(×200)Fig.2 NF-κB protein expressions in rat colon tissue in various groups(×200)

图3 各组大鼠结肠组织中NF-κB p65 蛋白表达Fig.3 NF-κB p65 protein expressions in rat colon tissue in various groups
4 讨论
UC 发病机制是多因素的,包括遗传易感性、上皮屏障缺陷、免疫反应失调、环境等[1],其病程发展可导致纤维化的形成,甚至出现癌变,因此,寻找UC 的有效治疗药物愈来愈受到关注。中药因其作用靶点多、安全性高等特点,在临床治疗UC 中体现出了独特的优势,裴银奇等[7]对治疗溃疡性结肠炎的处方进行统计后发现,党参出现频次在100 次以上。党参是传统的补益中药,也是甘肃省道地药材,具有健脾益肺、养血生津之效[8],党参多糖是采用水提醇沉法从党参中提取出的有效部位,可调整微生态失调,促进肠道有益菌的生长增殖并抑制肠道潜在致病菌[9-10],能显著缓解葡聚糖硫酸钠(DSS)诱导的结肠炎,且效果明显优于复方四君子汤[11]。
人类溃疡性结肠炎结肠黏膜中氧化应激失衡,产生的大量自由基损伤机体自身组织或激活炎症介质,可使结肠炎症的损伤加剧[12-13]。MDA 是由自由基引起脂质过氧化反应的终产物,其量与自由基含有量和脂质过氧化程度成正比[14];SOD 是体内消除超氧阴离子的抗氧化酶系,具有清除自由基、抑制脂质过氧化反应的作用,同时能修复受损细胞[14]。当多种危险因素刺激肠道黏膜时,造成肠道功能失调、机体氧化应激失衡,产生的大量自由基引起脂质过氧化反应,导致机体内MDA 水平的升高,SOD的耗竭;同时大量自由基的产生又会导致炎症介质的释放,从而进一步造成结肠组织损伤而发生UC。本实验发现,党参多糖能显著降低UC 大鼠结肠组织中MDA 水平,提高SOD 活性,说明它能抑制脂质过氧化反应的发生,改善结肠黏膜损伤。
肠道炎性细胞因子异常表达是UC 的重要机制之一[15],而UC 炎症因子的产生又与TLRs/NF-κB通路有密切关系[16]。核因子κB(NF-κB)是炎症反应期间被激活的主要转录因子之一,当炎症或免疫反应发生时,NF-κB 从细胞质进入细胞核内,调控炎性细胞因子的表达,包括IL-1β、IL-6、IL-8、TNF-α 等[17-18]。IL-6 是由单核细胞、巨噬细胞及T细胞分泌的一种辅助型T 细胞(Th)Ⅰ型细胞因子,能够诱导中性粒细胞的分泌和增殖,是具有广泛生物活性的促炎细胞因子,能直接介入急性期炎症损伤过程,在UC 的发病过程中扮演重要角色[19]。TNF-α 是一类由单核巨噬细胞产生的一种肽类物质,能刺激中性粒细胞和单核巨噬细胞等合成IL-1、IL-6、IL-8 等细胞因子,在IL-6 的参与下,还可激活磷脂酶,继而生成白三烯和氧自由基等[20]。IL-10 又名细胞因子合成抑制因子,能抑制中性粒细胞和自然杀伤细胞产生促炎性细胞因子和趋化因子,抑制IL-6、TNF-α 等的产生[19]。本研究结果显示,用TNBS 联合乙醇造模后,模型组大鼠结肠组织中NF-κB 蛋白表达显著升高,IL-6、TNF-α 水平及mRNA 表达升高,IL-10 水平 及mRNA 表达降低;给予党参多糖后,NF-κB 蛋白表达明显降低,IL-6、TNF-α 水平及mRNA 表达下降,而IL-10 水平及mRNA 表达升高。说明党参多糖能抑制NF-κB 信号通路,减少促炎因子IL-6、TNF-α 的释放,增加抑炎因子IL-10 的释放。
综上所述,党参多糖对溃疡性结肠炎大鼠肠黏膜具有保护作用,其机制可能抑制NF-κB 信号通路的活化,减少IL-6 和TNF-α 等炎性因子的释放,并增强IL-10 的抗炎作用有关。

