晚期尿路上皮癌患者一线应用PD-1单抗联合化疗与单纯化疗临床疗效及安全性比较
韩馥馨,吴朝真,李晓燕,张素洁,胡 毅
1 解放军总医院研究生院/解放军医学院,北京 100853;2 解放军总医院第一医学中心 肿瘤内科,全军肿瘤学重点实验室,肿瘤靶向治疗和抗体药物教育部重点实验室,北京 100853;3 首都医科大学附属北京胸科医院 肿瘤二科,北京 101149
尿路上皮癌(urothelial carcinoma,UC)是泌尿系统最常见的恶性肿瘤之一。2018年全球癌症统计报告中,膀胱癌是全球第十大常见癌症,2018年新发病例54.9万,死亡病例20万,在男性新发病例中排名第6位,在死亡病例中排名第9位[1]。转移性尿路上皮癌预后差,5年生存率仅为5%,中位总生存期(overall survival,OS)仅14个月左右,中位无进展生存期(progression-free survival,PFS)仅7个月左右[2]。近年来,多项研究表明免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)对非小细胞肺癌、黑色素瘤和肾细胞癌等多种恶性肿瘤表现出了强大的抗肿瘤活性[3-5]。多项临床研究表明免疫治疗在尿路上皮癌治疗中也显示出了良好的疗效和安全性,美国食品药品监督管理局(Food and Drug Administration,FDA)于2016年起先后批准了5种ICIs用于二线治疗含铂化疗失败的晚期UC[6-13],并在2017年5月批准了阿特珠单抗和帕博利珠单抗用于一线治疗不能耐受含铂化疗方案的UC患者[14-15]。IMvigor130研究是一项针对晚期UC患者一线免疫联合化疗的Ⅲ期临床试验,其结果显示免疫联合化疗较单纯化疗显著延长了PFS(8.2个月vs 6.3个月),但目前OS仅进行了期中分析[16]。因此,免疫治疗联合化疗对一般状况良好的晚期UC患者的一线治疗效果及安全性尚缺乏有力证据。在患者充分知情同意的情况下,解放军总医院第一医学中心自2017年起在晚期UC患者中开始一线免疫治疗的尝试。本研究系统回顾了30例一线接受免疫联合化疗及51例同期接受一线化疗的晚期UC患者的疗效及安全性,旨在通过临床数据为晚期尿路上皮癌的一线治疗提供更多的临床参考。
资料与方法
1 资料 收集解放军总医院第一医学中心肿瘤内科2017年3月- 2020年4月住院接受一线治疗的晚期UC患者资料。纳入标准:1)病理明确诊断为尿路上皮癌,并依据美国癌症联合委员会(American Joint Committee on Cancer,AJCC) 膀胱癌TNM分期标准(第8版)和相关影像学检查,分期为ⅢB ~ Ⅳ期不可手术或术后发生复发转移的晚期UC患者;2)有可供影像学测量和评价的病灶;3) ECOG评分 ≤ 3分,接受免疫治疗或化疗至少2个周期。排除标准:治疗前有明确的严重心肺功能疾病、遗传性/ 获得性免疫缺陷疾病、自身免疫性紊乱/疾病。
2 治疗方法 化疗组:接受以吉西他滨或紫杉醇(白蛋白结合型)联合顺铂、卡铂等铂类为主的化疗,每21 d为1个周期。免疫联合化疗组:接受紫杉醇(白蛋白结合型)、铂类、替吉奥等单药或双药化疗,同时联合帕博利珠单抗(每21 d静脉滴注100 mg或200 mg)、纳武利尤单抗(每14 d或21 d静脉滴注200 mg)、信迪利单抗(每21 d静脉滴注200 mg)等PD-1单抗,直至患者出现疾病进展、死亡或无法耐受药物毒性。
3 疗效评价与生存分析 1)疗效评价标准:两组治疗前完善基线评估,每治疗6周行影像学检查,根据实体瘤疗效评价标准(Response Evaluation Criteria In Solid Tumors,RECIST)1.1版,评价综合疗效为完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)或疾病进展(progressive disease,PD)。以CR+PR所占比例为客观缓解率(objective response rate,ORR),以CR+PR+SD所占比例为疾病控制率(disease control rate,DCR)。2)不良反应:根据常见不良反应事件评价标准(Common Terminology Criteria for Adverse Events,TCAE) 4.0版对不良反应进行评价(Ⅰ ~ Ⅳ级)。3) PFS:指患者从接受治疗至疾病进展或因任何原因死亡的时间。4) OS:指患者从最初治疗至因任何原因死亡的时间。随访截止日期为2020年10月14日。
4 统计学处理 采用SPSS22.0软件进行统计学分析。使用χ2检验或Fisher精确概率检验比较两个治疗组的基线特征和疗效数据。建立Kaplan-Meier生存模型,以log-rank检验进行两组PFS比较。P<0.05为差异有统计学意义。
结 果
1 两组一般资料比较 两组患者性别、年龄、ECOG评分、肿瘤特征等方面的差异均无统计学意义(P>0.05)。见表1。
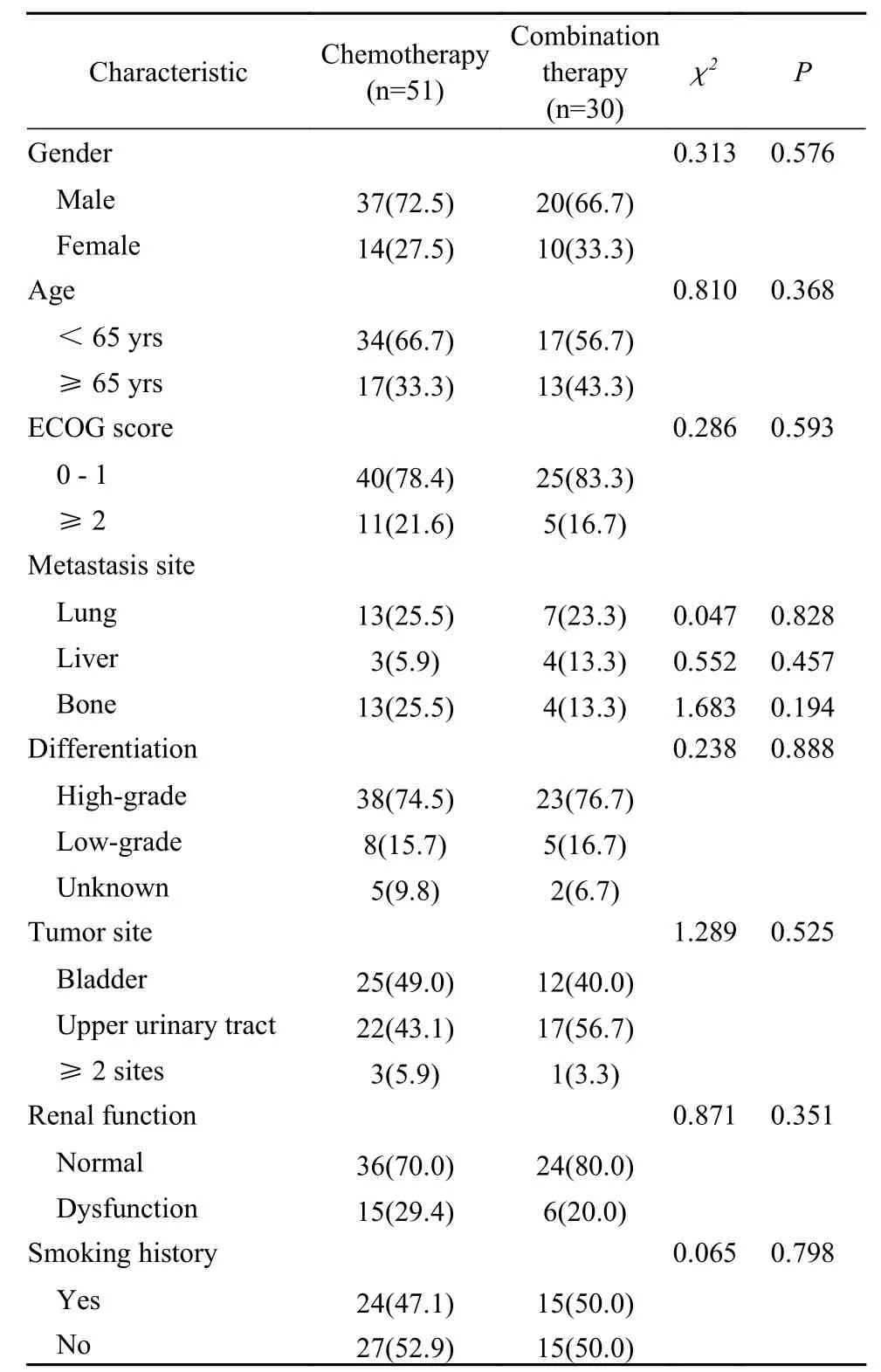
表1 两组晚期尿路上皮癌患者的基线特征比较(n, %)Tab.1 Baseline characteristics of the patients in the two groups (n, %)
2 近期疗效比较 免疫联合化疗组和化疗组的ORR分别为46.7%(14/30)和49.0%(25/51)。两组均有达到CR病例,分别为4例(13.3%)和1例(2.0%),两组DCR分别为90.0%(27/30)和80.4%(41/51)。疗效整体差异无统计学意义(P>0.05)。见表2。

表2 两组患者的近期疗效比较Tab.2 Comparison of short-term clinical outcomes between the two groups
3 两组患者生存期比较 截至2020年10月14日,达到PFS事件61例(75.3%),达到OS事件43例(53.1%),其中达到OS事件中化疗组34例(66.7%),免疫联合化疗组9例(30%)。免疫联合化疗组的中位PFS为15.8个月(95% CI:8.14~23.60),显著高于化疗组的7.17个月(95%CI:5.94~8.40),差异有统计学意义(P=0.020,图1)。化疗组的中位OS为17.8个月(95% CI:9.78~25.83),免疫联合化疗组尚未达到中位OS,但从目前的数据可以看到曲线分开。见图2。
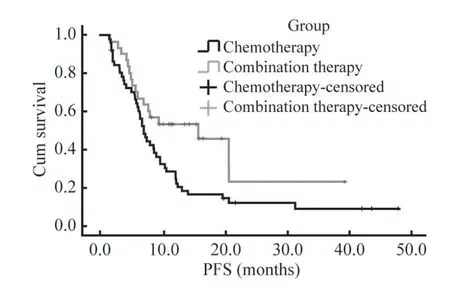
图1 两组患者无进展生存期曲线Fig.1 Progress-free survival curves of patients in the two groups
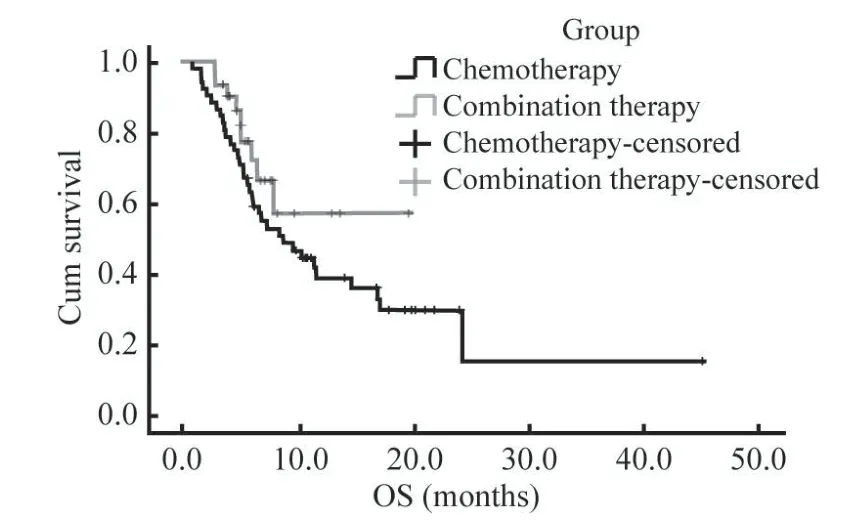
图2 两组患者总生存期曲线Fig.2 Overall survival curves of patients in the two groups
4 两治疗组不良反应比较 化疗组与免疫联合化疗组81例患者治疗相关不良事件的发生情况相似(表3),常见不良反应有骨髓抑制、消化道反应、肝损伤、乏力和脱发等,大部分为Ⅰ~Ⅱ级。免疫联合化疗组和化疗组总体不良反应发生率分别为83.3%和84.3%(P=0.908),Ⅲ~Ⅳ级不良反应发生率分别为33.3%和35.3%(P=0.858),差异均无统计学意义。81例患者均未发生与治疗相关的死亡事件。

表3 两组治疗相关不良反应比较(n, %)Tab.3 Comparison of adverse drug reactions between the two groups (n, %)
讨 论
近年来,靶向PD-1/PD-L1的免疫检查点抑制剂在不同实体瘤中取得了较好的疗效[17]。研究表明,ICIs在突变率较高的肿瘤中有更强的抗肿瘤活性[6,18]。癌症基因组图谱(The Cancer Genome Atlas,TCGA)的数据表明,UC的突变率在所研究癌症中排名第三,其具有高的突变负荷,可导致新抗原的产生[19-20]。因此,PD-1/PD-L1单抗在UC治疗中可能有较好的应用前景。
近年来的研究针对ICIs在尿路上皮癌治疗中的应用也取得了巨大的进展,临床试验IMvigor-210、KEYNOTE-045和KEYNOTE-052分别研究阿特珠单抗和帕博利珠单抗在转移性UC二线或不耐受顺铂患者中一线应用的情况,结果证实ICIs治疗晚期UC有良好的疗效和安全性[6,14-15]。之后的临床试验也逐渐证实了纳武利尤单抗、度伐利尤单抗和阿维鲁单抗在晚期UC二线应用的有效性[8-12]。ABACUS和PURE-01两项临床试验分别研究了应用阿特珠单抗和帕博利珠单抗新辅助治疗的疗效,研究结果均显示新辅助免疫治疗有较高的病理学完全缓解率,分别为31%和42%[21-23]。2019年欧洲肿瘤内科学会(European Society for Medical Oncology,ESMO)专家对KEYNOTE-057的研究结果进行了报告,该研究结果显示在高危且对卡介苗灌注治疗无反应的膀胱原位癌患者应用帕博利珠单抗有较高的完全缓解率(40.2%)及较长的中位反应持续时间(16.2个月)[24]。FDA据此结果批准了帕博利珠单抗用于治疗对卡介苗灌注无反应、高风险的不适合或拒绝手术的非肌层浸润性膀胱癌患者。
2020年ESMO会议公布了晚期UC患者一线应用免疫联合化疗对比单纯化疗(KEYNOTE-361)的研究结果,两治疗组ORR分别为54.7%和44.9%,中位PFS分别为8.3个月和7.1个月,中位OS分别为17个月和14.3个月,差异均无统计学意义,该研究结果与晚期非小细胞肺癌一线免疫联合化疗显著的疗效优势形成明显反差[25-26]。IMvigor130试验中OS尚未达到研究终点,因此无法改变临床实践。目前关于晚期UC一线治疗的单免、双免、免疫联合化疗的研究均在进行中,我们将期待各研究数据的更新。
虽然ICIs在UC的晚期、围术期等治疗中显示出了良好的疗效,但目前尚缺乏一线免疫联合化疗在真实世界中的数据。基于本中心早期在肺癌、恶性黑色素瘤等肿瘤中应用免疫治疗的经验,结合免疫治疗在晚期UC二线治疗中的良好数据,解放军总医院第一医学中心自2017年起在患者充分知情同意的情况下将免疫治疗与化疗联合应用于一般状况良好的晚期UC患者的一线治疗,观察到其良好的临床疗效及可接受的不良反应。本回顾性研究比较一线应用PD-1单抗联合化疗与单纯化疗治疗晚期UC患者的有效性和安全性。在本研究中,免疫联合化疗组与化疗组的ORR、DCR和CRR差异均无统计学意义,但联合组DCR和CRR较化疗组存在一定优势,且一线免疫联合化疗较单纯化疗明显延长了晚期UC患者的PFS,进而可能延长OS,本研究结果与晚期非小细胞肺癌一线应用免疫联合治疗的各项研究结果相似。在药物安全性方面,与单纯化疗相比,联合免疫组新出现的不良反应包括发热、肺炎、视物模糊,考虑与免疫相关,发生率较低且程度多较轻,总体上免疫治疗不会增加不良反应发生率。
本研究为回顾性研究,因此具有以下局限性:1)晚期UC患者数量有限,样本量不大,研究结果尚需大样本前瞻性临床研究进一步证实;2)治疗方案烦杂,未能进行不同治疗方案亚组之间的对比分析;3)由于随访时间限制,缺乏成熟的OS数据;4)缺乏生物标志物与疗效之间的分析。尽管这些因素在一定程度上削弱了结论的有效性和可靠性,但较早的临床数据仍对下一步的前瞻性研究有所支持。

