基于纳米材料的信号放大策略作用于电致化学发光生物传感器的研究
熊成义, 梁文斌, 刘 雄, 郑莹宁, 柴雅琴*,袁若*
(1. 西南大学化学化工学院, 重庆400715)
(2. 湖北大学化学化工学院, 湖北武汉430062)
(3. 湖北省生态环境监测中心站, 湖北武汉430072)
0 引言
电致化学发光(electrochemiluminescence,ECL)是集合电化学的电位可控性和化学发光的高灵敏性优点的新型分析技术,通过施加一定的电压进行电化学反应, 在电极表面产生电生物质,然后这些物质与自身或者体系中的其他组分因电子传递作用而转化成激发态,随后从激发态回到基态的过程,并在此过程中伴随着发光现象[1-2]。自Kuwana 等成功发掘出鲁米诺的电致化学发光动力学原理及其发光机理以来,电致化学发光体系受到了更多的关注[3]。
随着ECL 的蓬勃发展,它在生命分析领域也逐渐有了一席之地。 生命分析对于发光体的生物相容性要求很高,而传统的ECL 体系无法满足这一条件,因此纳米材料直接作为ECL 发光体逐渐占据了研究的核心位置,以金属量子点、碳点和金属纳米簇为其代表。这些ECL 发光体具有较高的生物相容性、合成成本低及稳定性好的优点。
1 新型电致化学发光纳米材料
虽然研究者们发现了许多物质的电致化学发光现象,但是能够应用于实际的类型并不多。其中以酰肼类化合物的代表——鲁米诺(luminol),吖啶类化合物的代表光泽精(lucigenin)及金属配合物——钌(Ru)配合物的应用较为广泛。
量子点(quantum dots)是指三个维度的尺寸都小于材料内部电子的费米波长的纳米晶粒,属于三维尺度限域的零维纳米材料。 由于在量子点内部电子在各个维度上的运动都受到限制,使得量子点内部的电子和空穴被强烈限域,准连续能带结构变为分立能级结构, 因此可以产生荧光。相比传统的有机荧光分子,量子点具备一些独特的光学性质,如发射光谱可调谐、抗光漂白、宽的激发谱和窄的发射谱、 较大的斯托克斯位移、良好的生物相容性以及荧光寿命长等优点,因此近年来广泛应用于生物、医学成像、光学检测等领域。量子点的ECL 现象于2002 年首次被报道,随后, 包括CdSe 量子点[4]、 ZnS 量子点[5]、碳量子点[6]等多种类型量子点陆续被发现具有ECL 现象。 由于量子点具有优异的发光性能,良好的生物相容性,以及可重复激发的特点被认为是理想的替代联吡啶钌的ECL 发光物质。 近年来,量子点ECL 体系成为研究的热点领域,被广泛应用于各类ECL 生物传感器。自2009 年Bard 课题组发现硅量子点之后,各种金属量子点逐渐走进研究者们的视野[7]。 Ju 等首次报道了CdTe QDs 的阳极ECL 现象[8]。 当他们把CdTe QDs 固载在氧化铟锡电极上,置于pH 值为9.3 的介质溶液中时,可以获得强的阳极ECL 信号,并且在+1.17 V(vs.Ag/AgCl) 电位下ECL 强度值达到最大。 除此之外,Ju 等还研究了多巴胺 (DA) 在该条件下对CdTe QDs 的猝灭机制,如图1 所示。
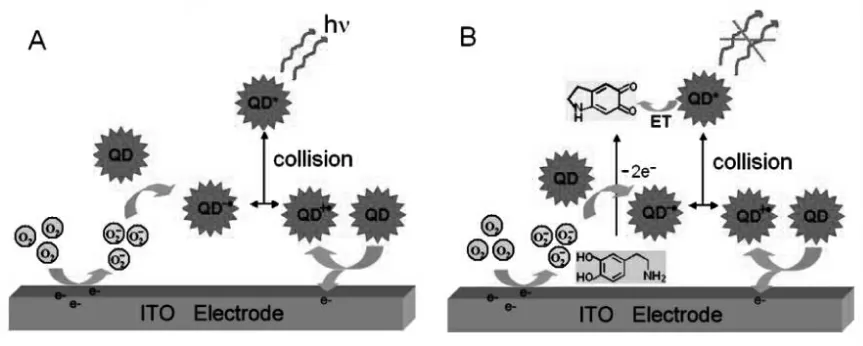
图1 量子点的阳极ECL 机理(A)和多巴胺的氧化产物对它的猝灭过程(B)Fig.1 Anodic ECL Mechanism of QDs(A)and Its Quenching Procedure by Oxidation Product of DA(B)
镉基量子点合成工艺成熟,成本低廉,是构建ECL 生物传感器中最常用的量子点之一,鞠熀先教授研究小组将CdSe QDs 修饰到电极表面,再修饰凝集素作为糖基的识别元件, 以S2O82-为共反应试剂增强CdSe QDs ECL 信号, 构建高灵敏生物传感器实现对细胞表面糖基化表达水平定量分析[9]。 糖基化的细胞能够被凝集素识别而附加到电极界面,阻碍电子传递,引起ECL 信号降低。 具体检测原理如图2 所示。 镉基量子具有较好的ECL 性能,然而,关于其生物毒性的研究表明, 镉基量子点存在一定程度的镉离子泄漏,造成一定的生物毒性,同时也对分析人员健康造成潜在的威胁,因此,人们开始把目光转向无毒性重金属的新型量子点。

图2 ECL 细胞传感器的构建原理图Fig.2 Schematic representation of ECL cytosensor for monitoring cell surface carbohydrate expression
为进一步提高金属量子点的ECL 性能,复合型的金属量子点也相继问世, 如CdS:Mn QDs、CdSe@ZnS QDs[10-11]。 Zhu 课题组提出,利用刮削涂覆在电极上制备高效的钙钛矿型QDs 薄膜的方法, 并借此合成了具有强ECL 性能的CsPbBr3QDs[12](图3)。

图3 (a)CsPbBr3 QDs 的立方晶体结构示意图;(b)CsPbBr3 QDs 的荧光和紫外吸收光谱;(c)CsPbBr3 QDs 的高清TEMFig.3 (a)The schematic cubic crystal structure of CsPbBr3 QDs.(b)Fluorescence and UV-vis absorbance spectra of CsPbBr3 QDs dispersed in hexane.The inset shows photographs of CsPbBr3 QDs under visible and UV light.(c)HRTEM image of CsPbBr3 QDs
这些半导体金属量子点虽然在一定程度上提高了ECL 发光体的生物相容性,但是重金属离子的生物毒性限制了它们在生命分析领域的深入应用。
二硫化钼(MoS2)是一类具有类似石墨烯独特二维结构的过渡金属二硫化物半导体纳米材料,具有良好的生物相容性。 采用top-down 的制备工艺,在有机溶剂中回流,可以获得生物相容性好的,无有机配体的MoS2量子点。Zhao 等将这种MoS2量子点用作ECL 发光物质, 表现出较强的ECL 信号,并且能够被经典的胺类共反应试剂三乙胺显著增强,基于此MoS2量子点ECL 体系,结合滚环扩增信号放大策略构建的ECL 适体传感器,实现内毒素(LPS)的灵敏检测[13]。 首先,将合成的MoS2量子点富集到Pd-Au 多面体复合物表面并在电极上成膜,为传感器提供初始ECL 信号,进一步组装引物构建生物传感平台,LPS 能够引发从引物开始的滚环扩增,产生有大量串联的富G 碱基片段的产物嵌入hemin 形成hemin/G-四分体, 能有效地淬灭MoS2QDs/TEA 体系的ECL 信号,ECL 信号的减小值随LPS 浓度的增加而增加。 具体过程如图4 所示。
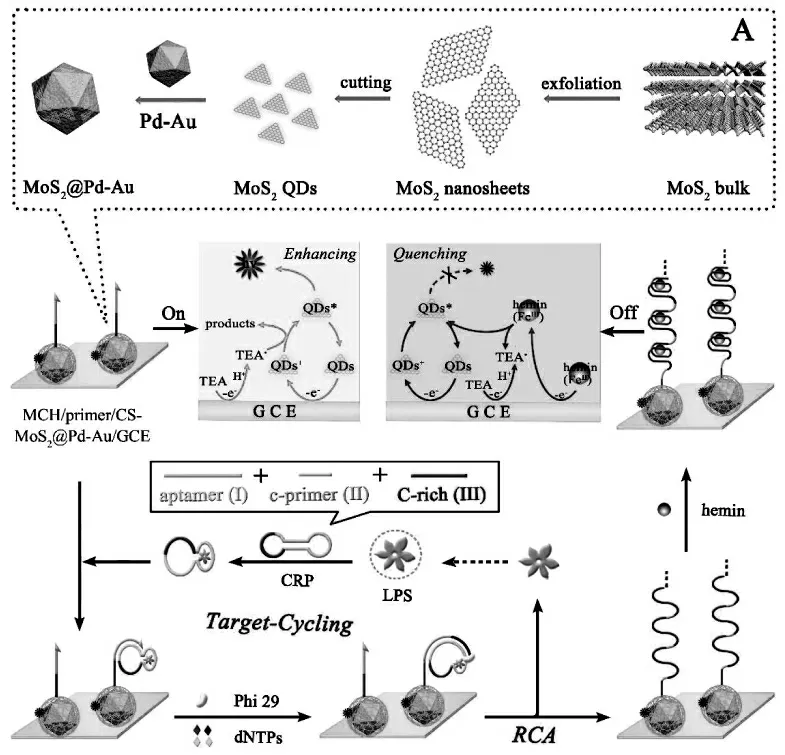
图4 基于二硫化钼量子点的生物传感器构建原理图(A)MoS2@Pd-Au 的制备过程Fig.4 Schematic Illustration of the Ultrasensitive “on-off”ECL Aptasensor for LPS Detection Based on Aptamer Recognition-Driven Target-Cycling Synchronized RCA:(A)Preparation Process of MoS2@Pd-Au
除了过渡金属半导体量子点,常用于ECL 生物传感器的有碳量子点(碳点,CDs)。 碳量子点是一系列直径小于10 纳米, 具有特定的发光特性的碳纳米材料,其中一些具有类似石墨烯的二维平面结构的碳量子点也被称为石墨烯量子点(GQDs)。 碳量子点继承了碳纳米材料所具备的优异的导电性、良好的生物相容性和稳定的化学性能,同时其发光强度大,获取成本低廉,相比金属半导体量子点具有突出的优势[14]。 因此,碳量子点在生物成像、生物传感器和发光器件等应用领域受到广泛的关注[15-16]。 2008 年,Chi 小组首次报道了电解石墨产生的碳量子点的ECL 现象,促使碳量子点成为ECL 领域的一颗新星,在ECL生物传感器的构建上受到研究者们的青睐。
Liu 等将碳量子点直接修饰到电极表面成膜,作为ECL 信号源,以修饰了hemin/G-四分体的纳米金作为ECL 猝灭探针, 构建了ECL 生物传感器检测蛋白激酶A(PKA)[17]。 目标物蛋白激酶A 在ATP 的辅助下, 能够将修饰在电极上的多肽底物磷酸化,在Zr4+离子存在的条件下,猝灭探针依靠磷酸与Zr4+离子的配位键结合到电极表面,实现ECL 信号响应。 具体过程如图5 所示。
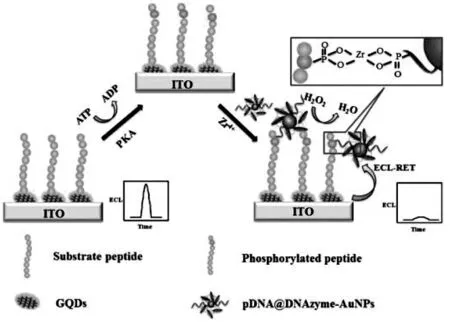
图5 以GQDs 为基底构建的PKA 生物传感器构建示意图Fig.5 Schematic illustration of ECL assay for PKA based on double-quenching of GQDs by pDNA@DNAzyme-AuNPs
碳量子点化学性质十分稳定,属于较难通过电化学反应获得激发态的一类发光物质, 因此,大多数情况下需要使用强氧化性的过硫酸盐作为共反应试剂并施加一定的负电压, 这对碳量子点在ECL 生物传感器中的应用存在一定的限制作用。 Dong 等发现将电化学扫描拓展到-1.3 ~+1.4 V 的电压范围内, 亚硫酸盐也能有效地增强碳量子点的ECL 信号,为碳量子点在ECL 生物传感器中的应用开辟了一条新的途径。 研究表明,宽的电化学扫描范围是亚硫酸根离子 (SO32-)能够转化为活性中间体硫酸根自由基(SO4·-),从而使碳量子点得以产生激发态[18]。 具体机理如图6所示。

图6 CQD-SO32-系统的ECL 反应原理图Fig.6 Schematic diagram for the ECL reaction mechanism of CQD-SO32-system
碳量子点是一种纳米晶体,尽管具有一定有机物的特征,其碳核具有较高的结晶度,这是鉴别碳量子点的重要特征之一,也是碳量子点发光特性的结构基础。 但是近期的研究发现,有一些有机聚合物,尽管没有晶体特征而不能归入碳量子点, 也具有包括ECL 在内的独特的发光现象,被称为聚合物点 (PFO)。 Chen 等利用H2O2对CdTe 量子点ECL 增强而对PFO 的ECL 猝灭的特点构建了比率型ECL 酶传感器,实现有机磷农药残留(OPs)的灵敏检测。如图7 所示,以石墨烯作为载体,修饰CdTe 量子点和PFO 构成纳米复合物, 在电极上成膜提供双电位的ECL 信号,然后,继续修饰乙酰胆碱酯酶(AChE)和胆碱氧化酶(ChOx),检测底液中加入乙酰胆碱;当底液中没有OPs 时,乙酰胆碱通过AChE 的作用转化为硫代胆碱(R-SH), 然后进一步通过ChOx 被氧化,其巯基转化为二硫键并伴随着过氧化氢的生成,此时CdTe 量子点的ECL 信号增强而PFO 的信号受H2O2猝灭; 当底液中存在OPs 时,OPs 能够抑制乙酰胆碱酯酶的活性, 从而抑制H2O2的生成,CdTe 量子点的ECL 信号降低而PFO 的信号增强,通过两种ECL 信号的比率变化,从而实现OPs 的检测[19]。 具体过程如图7 所示。

图7 基于PFO 聚合物点与CdTe 量子点构建的双响应ECL 生物酶传感器原理图Fig.7 Schematic Description of the Biosensor Fabrication and Response Mechanism
金属纳米簇是一类由几个到大约一百个原子组成的一种金属纳米颗粒, 其直径通常小于2 nm,它们的性质介于单核金属配合物和大的金属纳米粒子之间。 对于单核配合物,它具有量子化的电子能级;大的金属纳米颗粒仍然是一个等离子体,具有连续能带的离域电子能级;而纳米簇则介于两者之间。 由于纳米簇的尺寸接近于电子的费米波长, 连续态能带分裂成分立的能级,随着尺寸的减小, 纳米簇的成键能级与反键能级都将减小,禁带宽度则增大。当原子数小到一定的范围时,纳米簇就能够具备在可见光区的荧光发射。
与量子点类似,金属纳米簇同样具有ECL 行为。 2009 年,Diez 教授首次报道了聚合物稳定的银纳米簇的ECL 现象[20]。 更加可贵的是,最常见的由金、银、铂、钯等生物毒性低的元素组成的纳米簇具有比一般半导体量子点更加优越的生物相容性,因此,金属纳米簇已经成为一类非常重要的ECL 探针成为研究的热点。金纳米簇是目前为止在ECL 领域研究得最多,应用最广泛的一种贵金属纳米簇。金纳米簇ECL 体系既可以是以过硫酸盐共反应试剂的阴极发光,也可以是以叔胺(三丙胺、三乙胺等)为共反应试剂的阳极发光。其中,阳极发光由于条件相对温和更受研究者们的关注。 Chen 等以三乙胺作为共反应试剂,将金纳米簇底涂到电极表面成膜提供ECL 信号,以二茂铁功能化的PdPt 纳米立方标记二抗, 构建了夹心型ECL 生物传感器监测ConA[21]。 二茂铁能够有效猝灭金纳米簇的ECL 信号, 当检测到ConA 时,猝灭探针组装到电极表面,ECL 信号降低。 具体如图8 所示。

图8 PtPd NCs 和GOD@Fc-COOH-PtPd NCs 的合成示意图以及ECL 生物传感器的制备原理图Fig.8 The illustration of the synthetic process of PtPd NCs and GOD@Fc-COOH-PtPd NCs,and the preparation of the ECL biosensor
相比金纳米簇, 银纳米簇在化学稳定性,生物相容性上有所不如,但是在发光性能有一定的优势,同时,由于银纳米簇可以在特定的DNA 模板上原位合成,因此,在ECL 生物传感器中同样受到青睐。Chen 等以滚环扩增产生的由大量富胞嘧啶片段串联而成的长链DNA 为模板, 原位生成银纳米簇作为ECL 信号探针, 构建了超灵敏ECL 生物传感器检测miRNA[22]。 首先,构建了一个多功能的DNA 环形模板, 不仅作为滚环扩增的模板,是扩增产物中包含大量串联的富胞嘧啶片段,同时控制目标物miRNA 识别,仅在目标物miRNA 存在时,滚环扩增才能启动,在滚环扩增进行时,目标物被置换进入下一循环。 滚环扩增完成后,只需孵育AgNO3后漂洗电极,然后通过电化学还原的方式, 在DNA 上原位生成银纳米簇,产生ECL 信号。 具体过程如图9。
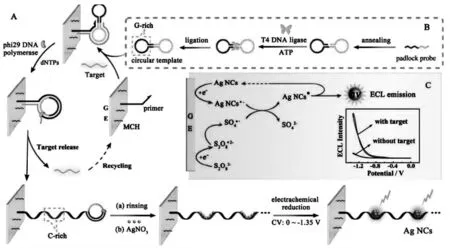
图9 目标物循环同步滚环放大结合原位电化学生成电致化学发光银纳米簇检测MicroRNAFig.9 Schematic Illustration of(A)the Principle of Target-Cycling Synchronized RCA and in Situ Electrochemical Generation of Ag NCs,(B)Preparation of the Circular Template,and(C)ECL Mechanism of Ag NCs/S2O82--Based ECL System Copyright 2017 ACS
除了单一金属构成的纳米簇,合金纳米簇由于其更好的电化学活性, 也开始进入人们的视野。 汪尔康教授课题组以牛血清白蛋白(BSA)为配体合成了金银合金纳米簇,并以其作为信号探针构建了ECL 传感器检测汞离子。该合金纳米簇相比单独的金纳米簇和银纳米簇具有更好的ECL 性能, 但是汞离子可以通过与纳米簇结合高效猝灭ECL 信号, 由此实现对汞离子的信号响应[23]。 具体如图10 所示。
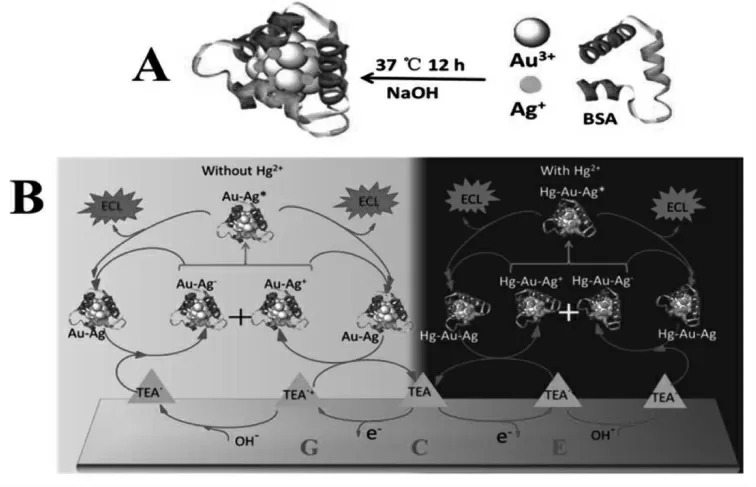
图10 (A)Au-Ag 合金纳米簇的制备;(B)Au-Ag 合金纳米簇的ECL 反应机理以及ECL 传感器对Hg2+的检测Fig.10 (A)Preparation Process of Au-Ag Bimetallic NCs;(B)ECL Mechanisms of Au-Ag Bimetallic NCs and the Proposed ECL Sensor for Hg2+Detection
与贵金属纳米簇相比,铜纳米簇则在成本方面具有一定的优势。 Zhao 等报道了铜纳米簇的ECL 现象并研究了联氨作为共反应试剂的ECL机理,基于该ECL 体系构建了检测多巴胺的ECL传感器[24]。如图11 所示,联氨被电化学沉积到玻碳电极表面,能够高效地增强了铜纳米簇的ECL信号,多巴胺则是该体系的猝灭剂。
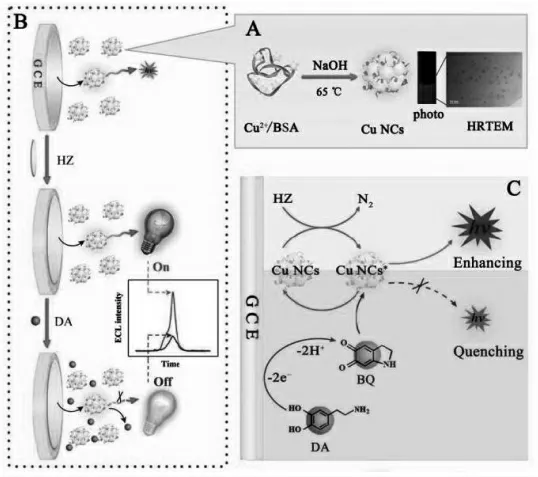
图11 基于铜簇的ECL 传感器构建示意图Fig.11 Schematic Showing the Preparation Process of Cu NCs and the Photo and Typical HRTEM Image of the As Prepared Cu NCs(A),Sketch Diagram of the Sensing Platform for DA Detection Based on the Cu NCs/HZ ECL System(B),and Proposed ECL Enhancing Mechanism of the Cu NCs/HZ System and ECL Quenching Mechanism by DA toward the Cu NCs/HZ System(C)Copyright 2017 ACS
2 纳米材料信号放大平台
随着粒径的变小,纳米材料表面原子与总原子数之比急剧增大,比表面积、表面原子数迅速增加,会引起性质上旳巨大变化。 表面原子的晶体场环境和结合能与内部原子不同,表面原子周围缺少相邻的原子,有许多悬空键,具有不饱和性质,易于其他原子相结合而稳定下来,因而表现出很高的化学和催化活性。 由于具有很高的比表面积和化学活性,纳米材料在ECL 分析领域常被用为纳米载体,富集ECL 活性物质(发光物质或其他活性分子),以提高分析方法的灵敏度。
王柯敏教授课题组利用介孔硅高比表面积及多孔特性,将ECL 发光物质联吡啶钌吸附到生长在电极表面的介孔硅膜的孔洞中,并使用各种靶标的核酸适配体分子封闭介孔硅的孔洞,从而构建了免标记的通用ECL 适体传感平台[25]。 其中,介孔材料是指孔径介于2~50 nm 的一类多孔材料,具有极高的比表面积。 介孔硅对联吡啶钌的高效吸附,是决定ECL 传感器高灵敏度的关键因素。 具体过程如图12。
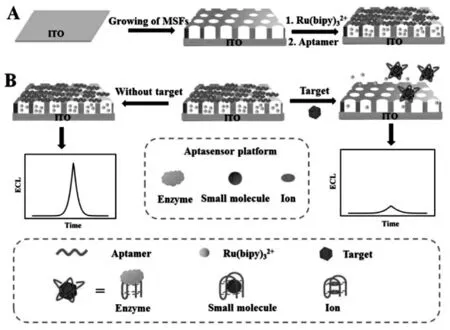
图12 (A)Apt-Ru@MSFs/ITO 的制备(B)传感器的构建示意图Fig.12 Schematic Illustration of(A)the Preparation of Apt-Ru@MSFs/ITO and(B)Apt-Ru@MSFs/ITO-Assisted ECL Aptasensor Platform for Target Detection.Copyright 2017 ACS
有些ECL 体系中,其发光物质不如其共反应试剂/猝灭剂容易标记或固载, 如过硫酸盐ECL体系,可通过纳米材料富集相关体系的共反应试剂/猝灭剂,提高反应试剂/猝灭剂增强/降低ECL信号的能力。 基于这样纳米复合物,可以构建信号增强(或减小)的分析方法,同样能够取得较高的灵敏度。 Zhao 等将聚组氨酸(过硫酸盐ECL 体系的共反应试剂) 修饰到纳米金功能化的C60复合纳米材料表面获得的复合纳米材料,表现出对过硫酸盐ECL 体系的高效增强[26]。 利用该复合纳米材料修饰电极,为信号减小型ECL 生物传感器提供更强的ECL 初始信号,从而提高传感器的灵敏度。 具体过程如图13。
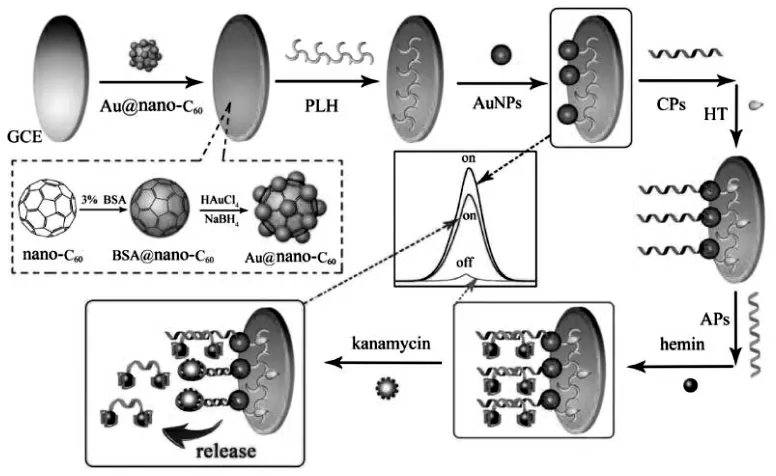
图13 ECL 适体传感器的原理图Fig.13 The schematic diagram of the preparation of the ECL aptasensor.Copyright 2015 Elsvier
纳米材料所具备的高比表面积的特性赋予其良好的吸附能力,实现ECL 发光物质或共反应试剂的大量固载, 获得ECL 性能好的纳米复合物。 另有一类纳米材料则是由发光物质或共反应试剂直接构成,相比表面吸附,其固载效率更高。Wang 等将自增强联吡啶钌衍生物制备成纳米棒,并将其作为信号标签,构建超灵敏ECL 免疫传感器。 这类纳米材料将固载活性物质的能力推向最大化,从而能够产生更强的ECL 信号,有效地提高传感器的灵敏度[27]。 具体过程如图14。
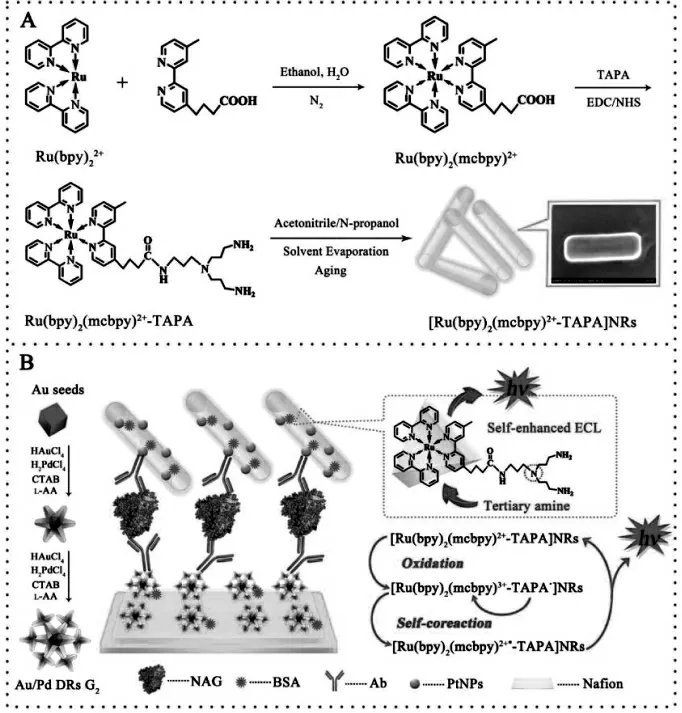
图14 (A)钌纳米棒的制备;(B)ECL 免疫传感器的制备及反应机理Fig.14 (A)Preparation of[(Ru(bpy)2(mcbpy)2+)-TAPA]NRs;(B)Fabrication of the Immunosensor and the Reacted Mechanism.Copyright 2016 ACS
以上工作表明,纳米材料通过其强大的固载能力, 使大量的ECL 活性物质能够进入传感界面, 从而产生更灵敏的ECL 信号相应, 实现对ECL 生物传感器的信号放大。
除了作为纳米载体富集ECL 活性物质之外,有些纳米材料由于其本身的光电性质, 能够对ECL 过程产生增强或者猝灭效果。 例如,纳米金(Au NPs)在紫外-可见光区域内具有较大的吸收系数和较宽的吸收范围等优良的光学性质,可作为很多发光体的能量受体(猝灭剂)。 当Au NPs与发光体距离较近时,能够发生ECL 共振能量转移(E-RET)高效猝灭ECL 发光。 陈洪渊课题组将Au NPs 与ECL 发光体分别标记到富G 碱基DNA的两端, 利用K+诱导富G 碱基DNA 序列折叠成G-四分体结构的特性, 当K+存在时,DNA 折叠成G 四分体结构,引起Au NPs 靠近被固定在电极表面的ECL 发光体,引起ECL 猝灭,从而实现对K+的响应[28]。 当Au NPs 与发光体的距离在适当的范围时, 由于局部表面等离子共振效应(LSPR),又能够增强某些ECL 体系的发光(图15)。

图15 基于CdS NCs 与AuNPs 间能量转移的ECL 传感器构建原理图Fig.15 Preparation of the ECL biosensor for K+assay based on energy transfer between CdS NCs and AuNPs Copyright 2013 RSC
最近,袁若教授课题组在研究中发现,有一些特定的物质,其本身不能产生ECL 信号,也不能作为共反应试剂单独用于增强发光试剂的ECL 信号强度,但是却可以加速共反应试剂与发光试剂间的相互作用,帮助共反应试剂进一步增强ECL 信号,这类物质统称为共反应促进剂。 其中,纳米材料作为共反应促进剂由于可以同时兼具纳米载体的功能而成为该领域的研究热点。
Zhou 等发现TiO2纳米材料可以作为共反应促进剂, 有效提高银纳米簇-溶解氧ECL 体系的发光性能,通过在TiO2纳米花表面原位合成银纳米簇制备复合纳米材料作为信号标签, 构建了ECL 免疫传感器[29],实现β-淀粉样蛋白(Aβ)的灵敏检测,具体过程如图16。该工作中,TiO2纳米花不仅扮演了纳米载体的角色,富集了大量的发光物质,同时,还能够促进银纳米簇-溶解氧ECL体系的共反应作用,增强ECL 信号强度。 机理研究表明,TiO2纳米材料由于表面缺陷具有出色的催化性能,通过催化溶解氧的转化,可以生成具有强反应活性的羟基自由基(OH·),从而提高银纳米簇的激发效率,实现ECL 信号增强。
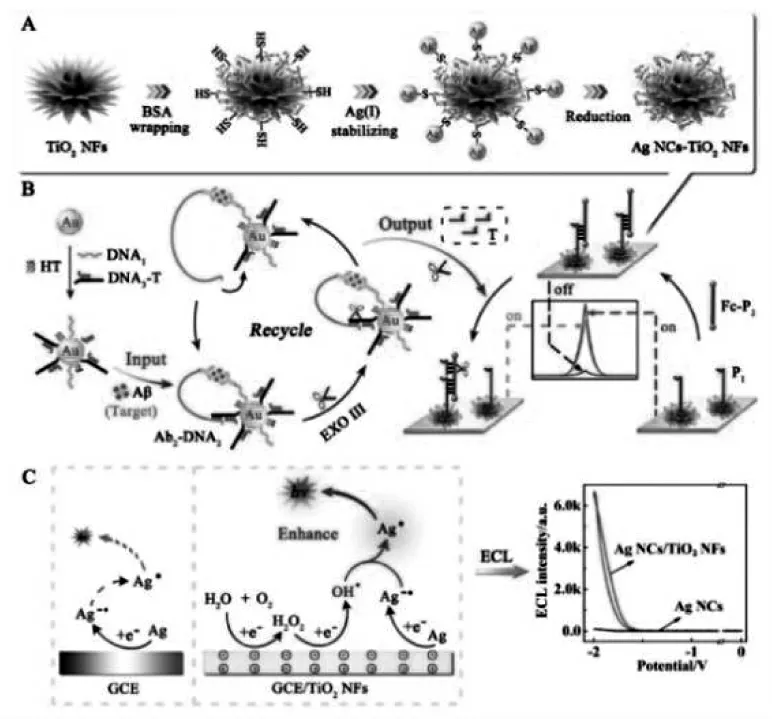
图16 以Ag NCs-TiO2 NFs 为基础构建的ECL 生物传感器原理图Fig.16 Schematic Diagrams Showing the Preparation of Ag NCs-TiO2 NFs(A),Ultrasensitive Detection of Aβ by Combining Immunoreaction-Induced DNA Nanostructure with Fc-Driven Light Switch Biodetection(B),and Possible ECL Emitting Mechanism of Ag NCs-TiO2 NFs(C).Copyright 2017 ACS
无论是通过纳米材料富集ECL 活性物质,或者参与ECL 反应过程, 都是以直接增强/猝灭ECL 体系信号强度的方式,实现信号放大,提高ECL 生物传感器的灵敏度。 为适应传感器小型化的发展潮流,随着精准化学的发展,诞生了一类将生物放大策略集成到纳米材料界面的新型信号放大技术。 由于有意识的控制和优化了生物分子的动力学行为,这种集成在纳米材料界面的生物放大策略相比传统的粗放的方式具有更高的效率。
磁分离技术是一种在生物分析领域常用的利用纳米材料集成生物放大策略的方式。 磁分离技术往往将识别元件组装到磁性纳米颗粒表面,可以很方便地将样品中的目标组分从干扰基质中分离出来,并实现浓缩,从而提高分析检测的灵敏度。 Zhou 等将一抗修饰在磁珠 (Fe3O4-Au)上, 将二抗上标记量子点功能化的纳米复合物(CdS-Au), 构建了基于磁分离技术的ECL 免疫传感器检测甲胎蛋白(AFP)[30]。目标物AFP 通过夹心免疫反应将二抗标记物装配到磁珠上,在磁场的作用下, 磁珠被富集到电极界面进行检测,检测灵敏度得到提高。 具体过程如图17 所示。
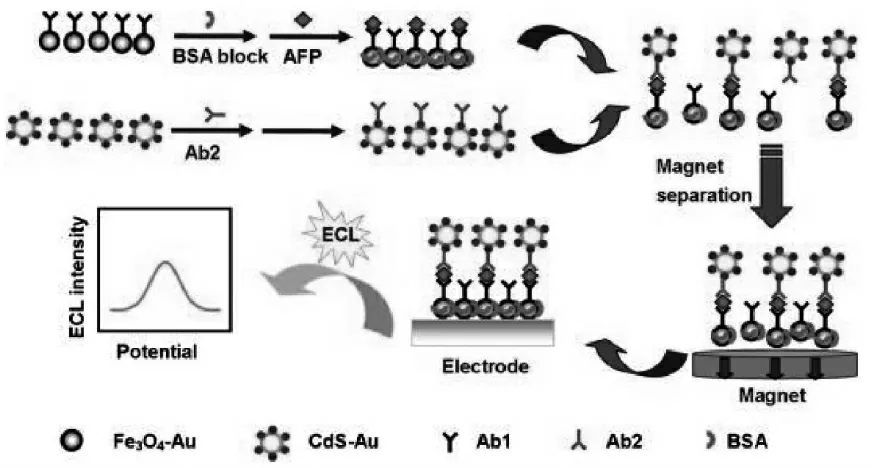
图17 基于磁分离技术的免疫传奇构建示意图Fig.17 Scheme of the preparation procedures of the immunosensor.Copyright 2012 Elsvier
催化胆碱氧化, 伴随着过氧化氢的生成,生成的过氧化氢马上被Pt@AuNFs 模拟过氧化物酶催化分解产生活性中间体,从而极大地增强鲁米诺的ECL 信号,实现信号放大。 通过在纳米材料表面修饰各种生物酶或模拟酶,可以将酶催化信号放大集成到纳米材料表面进行,酶催化原位生成的共反应试剂相比直接加入的共反应试剂具有更高的能量,反应活性更强;同时,由于ECL发光试剂也被修饰在纳米材料表面,从而使活性共反应试剂与ECL 发光试剂被限定在较小的空间内,发生反应的效率更高。 Zhou 等在以ECL 试剂鲁米诺作为还原剂制备的花状的Pt@Au 纳米合金材料(Pt@AuNFs)表面修饰固载胆碱氧化酶(ChOx),构建集成了酶催化信号放大策略的纳米复合物,以此为二抗标记物制得了检测心肌肌钙蛋白(cTnI)的夹心型ECL 免疫传感器[31]。在含有胆碱的电解质溶液中进行测定时,胆碱氧化酶催化胆碱氧化,伴随着过氧化氢的生成,生成的过氧化氢马上被Pt@AuNFs 模拟过氧化物酶催化分解产生活性中间体,从而极大地增强鲁米诺的ECL 信号,实现信号放大(如图18 所示)。
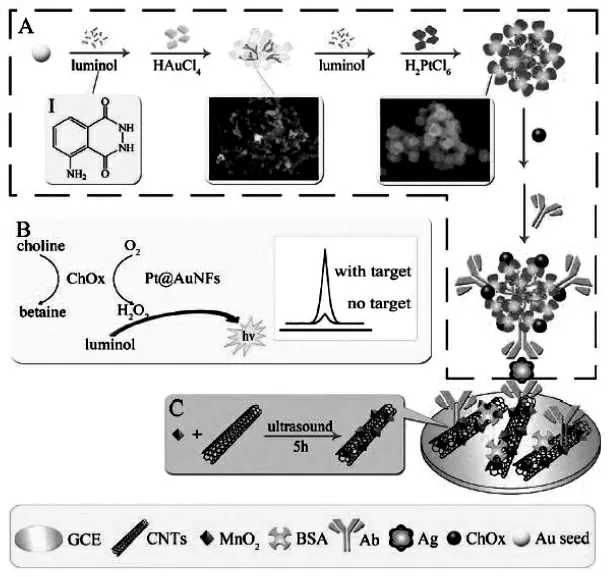
图18 以ECL 试剂鲁米诺作为还原剂制备的花状的Pt@Au 纳米合金材料并以该材料为基础构建的ECL免疫传感器的原理图Fig.18 The schematic diagrams of(A)show the preparation of Ab2/luminol-Pt@AuNFs/ChOx probes(Ab2 bioconjugates),(B)reveal the mechanism of the multiple signal amplification strategy and the comparative ECL signals with the target and without the target,and(C)exhibit preparation of MnO2@MWNTs,then(I)display the structure of the luminol molecule,(II)and(III)display the SEM images of luminol-AuNFs and luminol-Pt@AuNFs,respectively.Copyright 2014 RSC
除了酶催化信号放大策略之外,核酸信号放大策略是另一类重要的信号放大手段。 核酸信号放大策略可以将少量的目标核酸分子转化为数万倍的核酸分子响应, 有效提高分析灵敏度,因此,快速、灵敏、适用性好的核酸信号放大策略是构建决定ECL 生物传感器性能的关键之一。传统的ECL 生物传感器中,核酸信号放大策略往往在电极界面执行,这种异相反应给生物大分子(核酸,蛋白等)之间的相互作用造成了很大的阻力,信号放大效率往往要打折扣。 因此,近几年,受到传感器微型化潮流的引导,更重要的是得益于等温核酸信号放大技术的逐渐发展成熟,将复杂的核酸信号放大策略集成到单个纳米材料表面构成DNA 纳米机器成为ECL 生物传感器领域的一个重要研究方向。Jiang 等将适体识别触发的催化发夹组装策略集成到具有催化活性纳米材料(CoFe2O4@Au)上,构建了DNA 纳米机器,实现了黏蛋白(MUC1)的ECL 超灵敏检测[32]。 MUC1 与适体的特异性识别使发夹型的适体被打开,从而引发两个发夹型DNA 的自组装, 是标记有ECL信号分子(ABEI)的ABEI-H2组装到纳米颗粒表面,最后通过DNA 杂交,该纳米复合物组装到电极表面检测ECL信号,CoFe2O4@Au 能够催化H2O2生成活性OH·增强ABEI 的ECL 信号,实现DNA 自组装和催化双重信号放大。具体过程如图19 所示。
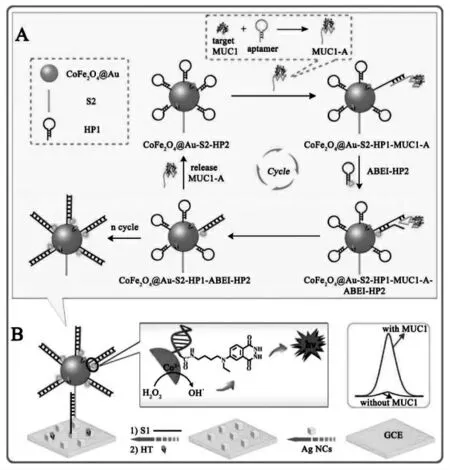
图19 (A)3-D DNA 机器的工作机理;(B)ECL 生物传感器的构建示意图Fig.19 (A)Assembly Process of 3-D DNA Nanomachine Signal Probe Induced by Protein-Aptamer Binding Complex;(B)Schematic Diagrams of the Construction and the Luminescence Reaction Mechanism of the Biosensor.Copyright 2017 ACS
3 纳米材料用于固载ECL 发光体
为了提高ECL 发光体的发光性能,缩短电子传输距离一直是研究者们所致力于的事情,这就需要将ECL 发光体固载到电极表面。那么如何实现稳定高效的ECL 发光体固载就成为研究的中心点,除了少数ECL 发光体的成膜性好而可以直接滴涂在电极表面,采用纳米材料作为载体固载ECL 发光体则成为了常用的手段。 目前比较常见的纳米材料载体有以下几类:纳米碳材料、贵金属纳米材料、半导体纳米材料。
纳米碳材料是纳米材料中极其重要的一类,其稳定性好, 比表面积大及来源丰富等优点,因而备受关注。 Ke 等利用介孔碳纳米球的大的比表面积,借助Nafion,通过物理吸附作用实现了大量的ECL 发光体Ru(bpy)32+的固载[33]。 此外,结合贵金属纳米材料作为载体不仅能够提高ECL发光体的固载量,还可以利用其导电性好、具有催化活性等优点来增强发光体的ECL 性能。 Hu等以N-掺杂的碳纳米管(NCNTs)为载体,用乙二醇(EG)作为溶剂,加入H2PtCl6/EG 和RuCl3/EG混合均匀后加入NaOH/EG, 以微波照射的方式获得具有电催化活性的Pt-Ru/NCNT 复合物[34](图20)。

图20 固载策略的示意图及夹心型ECL 适体传感器的构建Fig.20 Representative illustration of design strategy and fabrication process of the sandwiched magnetic ECL aptasensor.Copyright 2018 Elsvier
贵金属纳米材料是指Au、Ag、Pt 等一类的纳米级材料, 它们可以与多种基团结合, 占据了ECL 领域的半壁江山。 对鲁米诺ECL 体系而言,因其酰肼结构上的氨基活性低而使它的固载成为难题。 早期,崔华老师课题组以鲁米诺直接作为还原剂,采用水热法直接还原氯金酸得到金纳米粒子(AuNPs),因此鲁米诺就吸附在表面形成Au@luminol NPs,实现了对鲁米诺的固载。 Qu 课题组首先以蜡烛烟灰为原料,加入硝酸回流制得荧光碳点,此碳点表面富有羧基;随后将其固载于Ag 纳米粒子表面,形成CDs@Ag 复合物,再把复合物与PAH 包裹的石墨烯片结合而实现碳点的成功固载[35](图21)。

图21 以CDs@Ag 为信号物的ECL 传感器的原理图解Fig.21 Illustration of the fabrication of a label-free electrochemiluminescent cytosensor.Copyright 2013 RSC
作为鲁米诺的衍生物,ABEI 上的氨基具有相对高的活性, 能够与很多官能团发生反应,易于固载。 Shu 等合成了5,10,15,20-四(4- 羧基苯基)-卟啉(TCPP)修饰的二氧化钛纳米颗粒(TiO2nanoparticles),该纳米粒子表面带有羧基,可以与ABEI 在交联剂的作用下发生反应,结合在一起,实现了对ABEI 的固载[36](图22)。

图22 (a)TiO2-TCPP-ABEI nanoluminophores 的制备过程;(b)TiO2-TCPP-ABEI nanoluminophores 的透射电镜图;(c)紫外-可见吸收光谱图Fig.22 (a)Schematic illustration for fabrication of TiO2-TCPP-ABEI nanoluminophores.(b)TEM image of TiO2-TCPP-ABEI nanoluminophores.(c)UV-vis absorption spectra of TiO2 nanoparticles,ABEI,TCPP,TiO2-TCPP nanocomposites,and TiO2-TCPP-ABEI nanoluminophores.Copyright 2017 ACS
4 纳米材料用以界面修饰
因电极的表面积有限,为提高ECL 发光体在电极上的固载量,研究者们常常会在电极界面修饰具有大比表面积、导电性能好的纳米材料。
片层碳材料具有成膜性好的优势,经常用于界面修饰。 但单纯的碳材料对ECL 的贡献不大,因此与其他纳米材料的结合,尤其是一些对ECL体系有一定催化作用的纳米材料就格外受青睐。Chen 等在片层的碳氮化合物(CNNS)表面修饰金纳米离子,形成CNNS@AuNPs 复合物,然后将该复合物用于界面修饰,可以增强催化性能,为后续修饰提供基石[37]。 Rashidiani 等先合成了Si-Au NPs,再将其与表面巯基包裹的GO 结合在一起,形成tGO-Si-Au NPs 复合物,最后把它滴涂在电极界面上,起到固载第一抗体和促进luminol ECL体系的作用[38(图23、24)。

图23 夹心型CNNS ECL 生物传感器的组装过程示意图Fig.23 Procedures of assembling the sandwiched CNNS ECL biosensor and the control for evaluating the Dam MTase activity.Copyright 2018 ACS

图24 制备的免疫传感器的组装过程示意图Fig.24 Schematic illustration of proposed immunosensor in approaches 1 and 2.Copyright 2018 Elsvier
纳米线结构的纳米材料是另外一种重要的界面修饰材料。 Wang 等将半胱氨酸溶液加入到新制的硝酸银溶液中, 通过适当升温合成了银-半胱氨酸纳米线(AgCys NWs),然后把AgCys NWs用于固载一抗[39]。 除了单金属纳米线以外,双金属合金纳米线也是界面修饰载体之一。 Fu 等在N,N-二甲基甲酰胺溶液中加入氯铂酸、氯金酸和氢氧化钠溶液, 通过高压反应釜合成了金-铂纳米线Au-Pt NWs。 然后将其与半胱氨酸及hemin修饰的还原石墨烯复合物(rGO-H-Cys)反应后的复合物作为界面修饰的纳米材料[40](图25、26)。
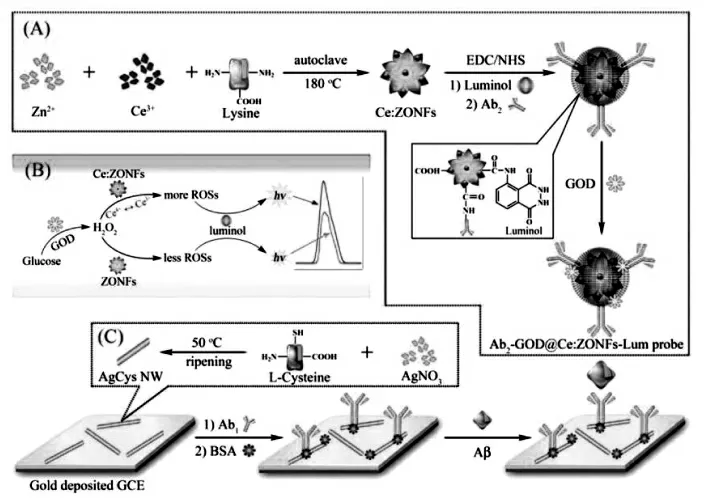
图25 (A)二抗耦合物制备图解;(B)ECL 信号增强机制;(c)AgCys Nanowires 制备Fig.25 Schematic Illustration of(A)Synthesis Process of Ab2-GOD@Ce:ZONFs-Lum Signal Probe;(B)Possible ECL Mechanism of Signal Generation and Enhancement;(C)Preparation Process of the AgCys Nanowires.Copyright 2016 ACS
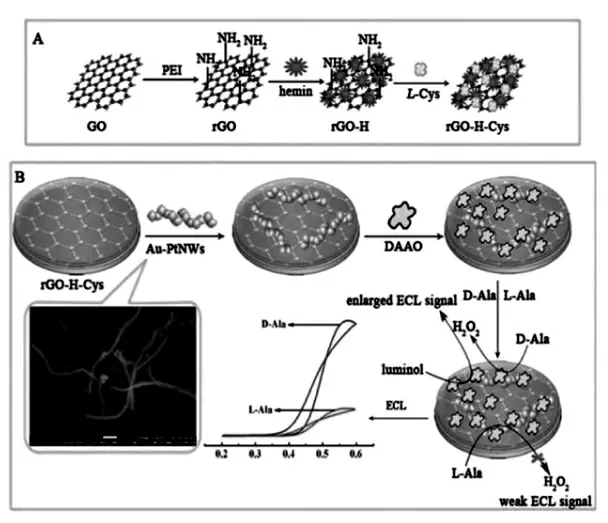
图26 (A)界面修饰材料制备过程示意图;(B)检测D-Ala 的ECL 传感器组装过程图Fig.26 (A)The preparation process for the rGO-H-Cys composite.(B)Schematic of the stepwise fabrication of the biosensor for ECL detection of D-Ala.Copyright 2018 RSC
5 结论与展望
标志物电化学传感是多学科交叉和发展的产物,它融汇了生命科学、分析化学、纳米技术等多个领域的特点,具有成本低廉、灵敏度高、响应速度快、易于微型化等优点,在疾病标志物的分析检测中发挥着重要作用。 近年来多种生物技术以及纳米材料相继兴起并飞速发展,国内外研究人员构建了系列的电化学生物传感器,为其在各方面的应用提供了前所未有的机遇。 同时,21 世纪是生物经济时代,作为生物技术支撑之一的生物传感器迎来了新的发展机遇。 随着材料、电子信息与生物科学等领域不断进步, 分析化学家、生物学家、工程师和医疗专业人员之间的密切合作必将为电化学传感进一步发展提供更广阔的空间。

