脑原位成像的小分子荧光探针研究进展
周 颖, 谌委菊, 李俊彬
(长沙理工大学化学化工学院, 细胞化学湖南省重点实验室, 湖南长沙410114)
0 前言
大脑是人体最重要和最复杂的器官,严格控制着身体的其他器官[1-2]。 与此同时,任何轻微的疾病和损伤都可能导致大脑功能产生障碍,从而引发各种脑部疾病,如阿尔兹海默症、癫痫、抑郁症及脑缺血等[3-4]。 目前,中枢神经系统相关疾病占全球疾病负担的6.3%, 不仅给患者带来了难以忍受的痛苦和折磨,同时也给患者家属带来了巨大的压力。 随着人口老龄化的严重,这一数据仍在不断增加[5]。 研究表明,脑部疾病的发生和发展过程与活性氧(ROS)、活性氮(RNS)、活性硫(RSS) 以及各种蛋白等物质有着密不可分的关系。如,氧化应激所产生的ROS、RNS 可导致神经元死亡,造成不可逆的神经元功能障碍,进而引发脑部相关疾病[6-9]。 RSS 作为重要的还原调节剂,为氧化还原平衡的维持提供了重要保障[10-11]。淀粉样蛋白(Aβ)斑块和高度磷酸化的神经原纤维缠结(NFT)是阿尔兹海默症的两种重要的生物标志物[12]。 此外,酶含量及活性的变化也与脑部疾病密切相关。 如脑供血不足会引起缺氧和硝基还原酶的过表达[13];乙酰胆碱酯酶(AChE) 是神经递质乙酰胆碱的关键水解酶,保证生物体内神经信号的正常传递,与抑郁症等疾病相关[14]。 因此,实时、原位检测脑内生物活性分子对于揭示脑部疾病的病理机制,预防、早期诊断及有效治疗脑疾病具有重要意义。
目前, 一些脑原位成像技术已经发展起来,如计算机断层扫描[15]、正电子发射断层扫描[16]、磁共振成像和血管造影[17]等。 然而,上述方法难以实现活性分子的原位、实时可视化。 基于小分子探针的荧光成像因具有结构可调、 高灵敏度、高时空分辨率及操作简便等优点,是脑内生物活性分子原位成像的首选。 然而,不同于其他器官的检测与成像,用于原位检测脑内活性物质的探针首先需要穿透血脑屏障。 血脑屏障(BBB)作为将中枢神经系统与血管系统分开的最严格调节的界面, 限制了外部物质和有毒化学物质的通过,只允许选择的离子和必需分子通过[1,18]。 然而,血脑屏障的存在使得大约98%的小分子和几乎所有的大分子都无法进入脑实质[1,18],从而导致脑疾病诊断的效率并不理想。 虽然通过各种物理、 化学和生物刺激, 可瞬时增加BBB 的通透性[6],在不改变小分子的化学结构的情况下增强其在大脑中的积累,但这种非特异性和非选择性的方法也会导致一些有毒有害物质同时进入大脑,带来新的病理问题。 此外,还可通过脑注射的方式将小分子探针及药物直接注入脑实质,但这种方式有可能影响中枢神经系统的正常功能,且其准确性也有待考究。
据文献报道, 通过严格的分子结构设计,可使其能被动跨细胞扩散穿过BBB。 亲脂性和分子量被认为是评估小分子荧光探针穿过BBB 能力的两个重要参数。 分子探针应具有合适的脂水分配系数(一般为2.0~5.0 之间),且其分子量一般应小于500 Da[19],才能较好的穿透BBB。 分子氢键数目、分子极性表面积及灵活性等参数也可能影响其BBB 渗透能力[20-21]。 此外,因可见光的组织穿透深度较浅,为了更好的实现脑组织的原位成像,分子探针的激发和发射波长处于近红外区域也是重点考虑的。 该文综述了分子探针在大脑生物活性分子原位成像中的研究进展,并探讨该领域面临的挑战与发展方向。
1 小分子荧光探针在脑原位成像中的应用
近年来,科研工作者已设计并合成了多种小分子荧光探针用于脑原位成像,其传感机制主要涉及光诱导电子转移[22]、分子内电荷转移[23-24]、荧光共振能量转移[25-27]、聚集诱导发光[28]等。 探针的分析对象主要为ROS、RNS、RSS 以及蛋白质,为相关脑疾病的病理机制研究、诊断及治疗提供了有效工具。
1.1 ROS 荧光探针
研究表明,较低水平的ROS 对于维持细胞稳态和功能至关重要,而细胞中ROS 的过度产生会导致细胞功能障碍。 2017 年,冉崇昭等设计并合成了探针CRANAD-61 用于成像阿尔兹海默症和脑淀粉样血管病中的ROS[29]。 该探针对ROS响应快速、灵敏度高且能穿透BBB,可同时通过微观和宏观水平的成像监测大脑ROS 含量变化(图1)。
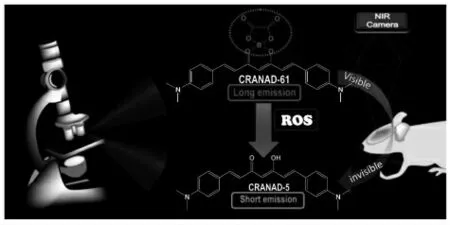
图1 用于ROS 敏感成像的探针CRANAD-61 的设计原理[29]Fig.1 Schematic of the design of probe CRANAD-61 for ROS-sensitive imaging[29]
刘志洪等报道了一种近红外发射荧光探针Mito-NIRHV 用于粘度和H2O2的高灵敏检测[30]。探针在近红外区域有两个独立的发射,且两者都具有>200 nm 的斯托克斯位移。 基于探针良好的光物理特性和BBB 穿透能力, 该探针成功实现了活细胞和阿尔兹海默症大脑中H2O2和粘度变化的成像(图2)。
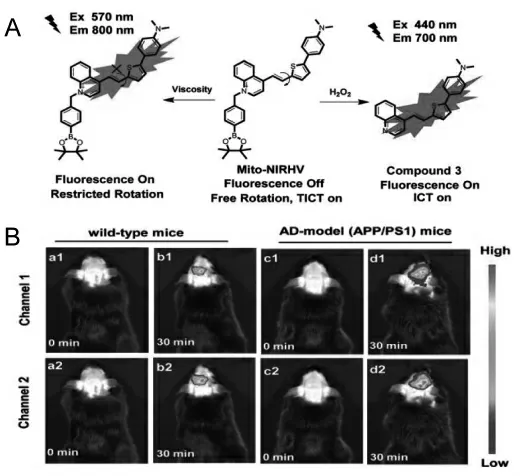
图2 探针Mito-NIRHV 对粘度和H2O2 的响应机理及其在AD 大脑中的成像[30]Fig.2 Response mechanism of Mito-NIRHV to viscosity and H2O2 and its imaging application in AD brain[30]
2019 年,唐波等构建了一种双光子荧光探针TCE 用于生命系统的·OH 原位成像[31]。该探针以3-甲基-吡唑啉酮的单电子氧化作为特异性识别位点,具有优异的选择性。 通过对抑郁症小鼠大脑中的·OH 成像,他们发现·OH 的增加与抑郁严重程度呈正相关。 此外,·OH 已被证明可以使去乙酰化酶SIRT1 失活,从而诱导抑郁症的发生和发展(图3)。
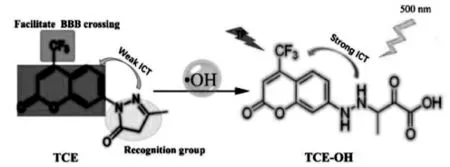
图3 探针TCE 的结构和荧光响应机理[32]Fig.3 Structure and fluorescence response mechanism of TCE[32]
受喹诺酮类神经保护药物的启发,2020 年,钱勇等构建了一种双光子HClO 荧光探针HCP用于对髓过氧化物酶介导的氧化应激进行成像[33]。利用该探针可在具有癫痫行为的小鼠大脑中可视化过表达的HClO。 此外,他们采用探针设计了一种高通量筛选方法来筛选潜在的抗癫痫药物以调节髓过氧化物酶介导的氧化应激。 筛选所得的黄酮类化合物芹菜素可缓解髓过氧化物酶介导的氧化应激并抑制神经元细胞的铁死亡(图4)。

图4 探针HCP 对MPO 介导产生的HClO 的响应机理及高通量筛选抗癫痫药物的策略[32]Fig.4 Response mechanism of HCP to MPO-mediated HClO and strategy for high-throughput screening of antiepileptic drugs[32]
梁磊等基于哒嗪酮骨架开发了一种超灵敏的脑靶向荧光探针PCAB,用于脑内H2O2的成像和脑缺血再灌注损伤的快速检测[33]。作为一种双光子荧光探针, 该探针具有较好的BBB 穿透能力,且对H2O2表现出快速、特异性响应。 通过追踪活体小鼠脑内H2O2的动态变化, 他们发现脑缺血再灌注损伤与H2O2诱导的不同大脑区域的自噬有关(图5)。
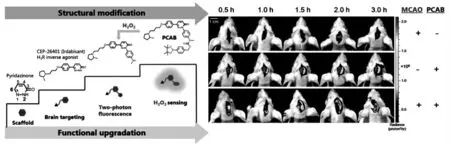
图5 探针PCAB 的结构及其在脑缺血小鼠体内对H2O2 的成像[33]Fig.5 The structure of PCAB and its imaging of H2O2 in mice with cerebral ischemia[33]
1.2 RNS 荧光探针
RNS 是一类高活性分子,在各种生理和病理过程中起着至关重要的作用。 2019 年,钱勇等曾基于亚甲基蓝报道了一种近红外荧光探针ONP用于跟踪活细胞和体内过氧亚硝酸根离子(ONOO-)的动态变化[34]。 该探针具有高灵敏度和选择性的优点,可用于红藻氨酸诱导的癫痫发作的大脑中内源性ONOO-原位成像。 实验表明ONOO-在癫痫脑中过度表达会引起神经元损伤,而采用姜黄素给药可消除该损伤,进一步有效保护神经元细胞(图6)。
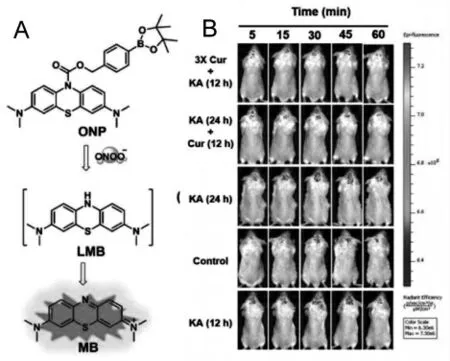
图6 (A)探针ONP 对ONOO-的响应机制;(B)探针ONP 在小鼠体内进行荧光成像[34]Fig.6 (A)The proposed response mechanism of ONP;(B)In vivo NIR fluorescence imaging with ONP[34]
2020 年,李新等设计开发了一种超灵敏探针B545b,用于脑中风疾病中亚硝化应激成像[35]。探针显示出几乎为零的背景荧光信号,与ONOO-响应后荧光增强近1000 倍。 经静脉注入后,探针可顺利穿透BBB,在脑内迅速积聚并监测局部血管损伤。 他们进一步研究了中风中亚硝基应激的病理影响(图7)。
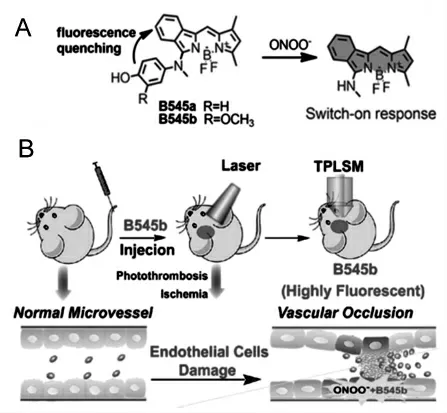
图7 (A)探针B545b 的结构及其对ONOO-的响应机理;(B)探针B545b 应用于微血管堵塞的成像原理图[35]Fig.7 (A)The structure of B545b and its response mechanism to ONOO-;(B)The imaging principle of B545b applied to microvascular occlusion[35]
1.3 RSS 荧光探针
RSS 常作为生命活动的调节剂,在损伤和氧化应激下作为抗氧化剂发挥关键作用。 2019 年,唐波等报道了一种用于监测Cys 的新型双光子荧光探针TCS[36],该探针具有优异的灵敏度和生物相容性,能实现Cys 特异性响应。 探针成功用于二硫苏糖醇刺激的PC12 细胞中Cys 检测。 通过构建抑郁症小鼠模型,探针成功揭示了Cys 水平与抑郁程度呈负相关(图8)。
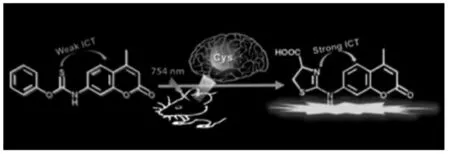
图8 探针TCS 的结构及其对Cys 的响应机理[37]Fig.8 The structure of Mito-CP and its response mechanism to Cys[37]
刘志洪等设计了一种近红外荧光探针Mito-CP 用于跟踪戊四唑诱导的癫痫发作大脑中的内源性Cys[37]。 探针具有良好的线粒体靶向和BBB穿透能力,不仅能实现在戊四唑刺激下PC12 细胞中Cys 的检测, 还可以在斑马鱼中实时监测到由脂多糖诱导的氧化应激中的Cys 波动, 并成功应用于活体小鼠癫痫模型中Cys 原位成像(图9)。
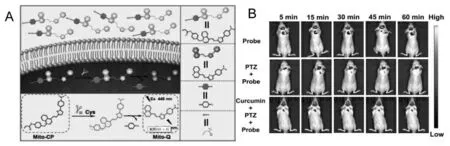
图9 (A)Mito-CP 的结构及其对Cys 的响应机理;(B)Mito-CP 应用于小鼠中进行荧光成像[38]Fig.9 (A)The structure of Mito-CP and its response mechanism to Cys;(B)In vivo fluorescence imaging of Mito-CP[38]
王卓等基于半花菁和Si-罗丹明结构设计并合成了一种近红外荧光探针SiR-Bs,用于精神分裂症中H2S 的成像研究[38]。 Mindo-SiR 表现出良好的线粒体靶向性、BBB 穿透能力。 探针成功实现活细胞和小鼠大脑外源性和内源性H2S 变化,并对精神分裂症小鼠模型脑内H2S 的变化进行原位成像,表明精神分裂症小鼠脑内H2S 水平会异常升高(图10)。
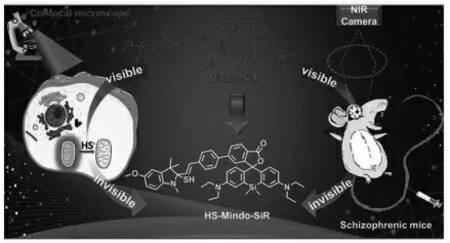
图10 Mindo-SiR 的结构及其对H2S 的响应原理[38]Fig.10 Structure of Mindo-SiR and its response to H2S[38]
1.4 蛋白类荧光探针
2019 年, 崔梦超等基于多光谱荧光成像报道了一系列近红外环境敏感型探针用于区分阿尔兹海默症患者大脑中Aβ 斑块和NFT[39]。 其中,探针18 与Aβ 斑块和NFT 之间均存在强烈的相互作用, 并分别在体外和体内荧光实验中证实了其分辨Aβ 斑块和Tau 聚集体的能力(图11)。
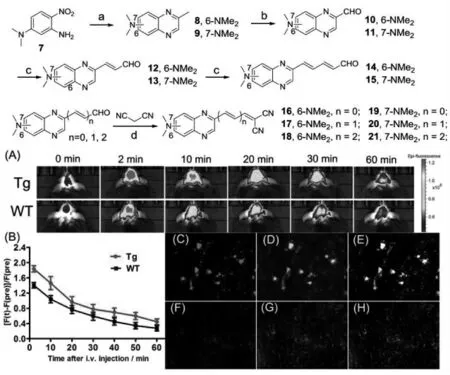
图11 近红外环境敏感型探针的合成路线及其在阿尔兹海默症小鼠中的成像应用[39]Fig.11 Synthetic route of a series of near-infrared environment-sensitive probes and its imaging application in Alzheimer's disease[39]
唐波等报道了一种双光子荧光探针MCYN用于实时可视化乙酰胆碱酯酶[14]。探针的氨基甲酸酯基团可被乙酰胆碱酯酶特异性识别,释放出染料,荧光显著增强。 采用双光子成像,探针在抑郁症小鼠模型中成功实现乙酰胆碱酯酶原位成像。 作者发现抑郁症小鼠大脑中的乙酰胆碱酯酶活性明显增加(图12)。
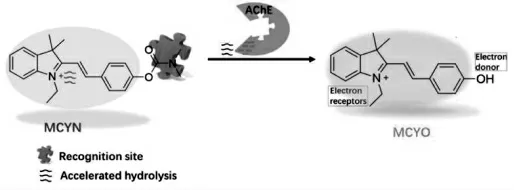
图12 MCYN 的结构及其对乙酰胆碱酯酶的响应机制[14]Fig.12 Structure of MCYN and its response mechanism to acetylcholinesterase[14]
脑供血不足会引起缺氧和硝基还原酶(NTR)过表达。 吴水珠等设计了一种近红外NTR荧光探针TPAQS-NO2用于监测脑缺血小鼠模型中的缺氧[13]。 探针因存在光致电子转移效应,荧光猝灭。 在NTR 的催化下,探针的硝基被还原为伯胺基团,随后发生1,6-重排消除反应,光致电子转移效应被阻断,荧光增强。 探针成功用于监测小鼠肿瘤模型中早期肿瘤和晚期肿瘤的缺氧情况及脑缺血小鼠模型中的缺氧状态(图13)。
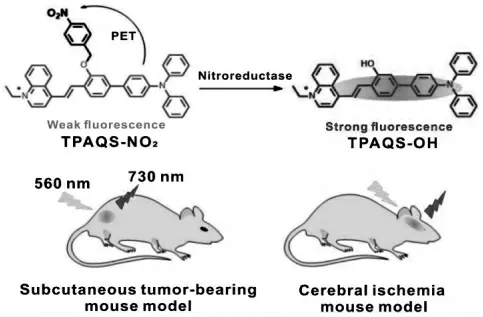
图13 探针TPAQS-NO2 对脑缺血中硝基还原酶的响应机理[13]Fig.13 Response mechanism of TPAQS-NO2 to nitroreductase in cerebral ischemia[13]
朱为宏等通过引入亲脂性π 共轭噻吩桥来红移探针的发射波长并增强BBB 穿透性,构建了一种近红外聚集诱导发光探针QM-FN-SO3[28]。探针避免了如商业硫黄素衍生物等存在的荧光自猝灭现象。探针与Aβ 斑块具有出色的结合力,且结合后荧光显著增强。 探针成功用于小鼠脑内Aβ 斑块的原位成像(图14)。
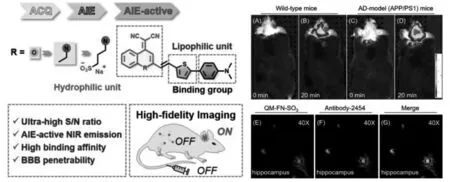
图14 探针QM-FN-SO3 的结构及其在野生型和APP/PS1 型小鼠脑内和离体脑切片中Aβ 斑块的荧光成像[28]Fig.14 Structure of QM-FN-SO3 and fluorescence imaging of Aβ plaques in wild-type and APP/PS1-typemouse brains and in isolated brain sections[28]
2021 年,钱勇等通过引入分子内旋转供体基团, 构建了一种基于姜黄素的近红外荧光探针CAQ 用于选择性监测体内Aβ 斑块[40]。 探针具有出色的BBB 穿透性,可在复杂生物体系中对Aβ斑块进行选择性近红外荧光成像。 探针成功应用于阿尔兹海默症小鼠模型脑内Aβ 斑块的原位成像(图15)。

图15 探针CAQ 的结构及其对Aβ 斑块的成像原理[40]Fig.15 Structure of CAQ and its imaging principle of Aβ plaques[40]
2 结论与展望
脑疾病的预防、早期诊断及有效治疗对于生命健康至关重要。 近年来,科研工作者投入了大量精力来开发用于脑原位成像的可激活小分子荧光探针,为阐明相关信号通路、实现脑疾病的早期诊断及治疗提供了有效工具。 尽管已取得了一定进展,但仍面临较大的挑战。 首先,探针在脑实质中的富集效率仍然有限,并且大部分探针无法穿透BBB;其次,大多数探针的穿透深度和分辨率仍不足,虽然采取双光子成像解决了部分问题,但是激发光能量高,面临创伤的挑战;再次,用于原位脑成像的分子探针构建不仅要考虑合适的脂水分配系数, 同时也要兼顾分子量及激发、发射处于近红外区域,难以进行通用的设计。针对以上挑战,开发具有通用的设计思路,如筛选合适的荧光基团及合适的靶向基团构建探针,满足大脑内更多生物活性分子的实时、原位成像需求可能是未来的发展方向之一。

