登革病毒模拟ADE效应中肝细胞lncRNA的差异表达
王效军,黄 洁,梁慧琳,徐秀娟(广东医科大学公共卫生学院,广东东莞 523808)
登革病毒(DENV)有4 个血清型(DENV1‑4)[1],肝细胞对各型DENV普遍易感,不同血清型间具有一定的交叉免疫反应,可发生抗体依赖的感染增强效应(ADE)[2]。NS1 是DENV 中主要的非结构蛋白,NS1抗体与细胞表面的相应抗原相互作用并引起信号转导,促进细胞激活增加病毒产量和释放,有助于DENV 的ADE 发病机制的形成[3]。长链非编码RNA(lncRNA)作为新的调控分子具有表观遗传、转录及转录后调控等功能在病毒感染中发挥重要生物学调控功能[4‑5],DENV 感染致肝细胞损伤中lncRNA 的表达及可能的生物学作用尚不明确。本研究模拟建立体外DENV 感染L‑02 细胞的ADE 模型,探讨DENV感染致ADE 中lncRNA 差异表达及可能的生物学作用,为登革热的预防控制提供依据。
1 材料和方法
1.1 登革病毒液滴度测定
调整C6/36 细胞浓度为1×106个/mL,每孔加入100 μL悬液制备96孔板,DENV2病毒液(南方医科大学病原生物系惠赠)用RPMI‑1640维持液(2%FBS)连续10 倍稀释(10−1~10−8),用Reed‑Muench 方法[6]计算病毒液的滴度(TCID50)。
1.2 L‑02 细胞ADE 模拟感染条件的筛选及样品制备
(1)RPMI‑1640 培养基(10%FBS,1%青链霉素混合液)37 ℃(5%CO2)培养L‑02细胞,调整细胞浓度为1×106个/mL,每孔加入1 mL悬液制备6孔板。
(2)鼠源抗DENV1 NS1 抗体用RPMI‑1640 维持液(2%FBS)进行1:160 稀释,并与DENV2 病毒液(Moi=0.1、0.5、1.0)37 ℃孵育90 min,然后感染6 孔板中L‑02 细胞模拟ADE 效应;以RPMI‑1640 维持培养基(2%FBS)作为对照组,每组准备4份。
(3)染毒37 ℃(5%CO2)培养48 h 后,吸取上清,定量ELISA 试剂盒测定谷丙转氨酶(ALT)和谷草转氨酶(AST)吸光度值(OD),利用标准品建立回归方程,用回归方程计算每个感染滴度的数值。感染滴度计算AST/ALT 并依据如下标准判定[7]:AST/ALT<1.0为轻度损伤,AST/ALT≈1.0 为中度损伤,AST/ALT>1为重度损伤,AST/ALT>2为严重损伤。
(4)每个6 孔板吸净培养上清后的细胞立即加入1 mL TRIzol 试剂,反复吹吸,吸到另一个2 mL EP 管中,ADE 和对照组每个感染滴度的细胞样品各4 份,选择AST/ALT比值最高的感染滴度,其中3份干冰送检,另一份-80 ℃保存备用。
1.3 RNA‑Req及差异表达判定
(1)由华大基因公司进行RNA 的提取、合成cD‑NA 第二链经过试剂盒纯化并建立测序文库,并用Il‑lumina HiSeqTM2 000进行测序。
(2)以FPKM 值作为衡量转录本或基因表达水平的指标,ADE 感染组与对照组比较,计算log2ratio(ratio=ADE/对 照),取log2(ratio)≥1.5 为高表达,log2(ratio)<1.5为低表达[8]。
1.4 差异表达lncRNA 潜在靶基因的功能注释和预测
使用TopHat2软件[9]将对比组差异表达的ln‑cRNA 映射到不同的参考基因组,如果lncRNA 映射的位置在某个基因上游的启动子区域,则lncRNA 可能在转录或者转录后水平对基因的表达进行调控[10];如果lncRNA映射的位置在某个基因下游,则lncRNA可能参与其他调控作用[11];采用RNAplex软件[12],依据最小自由能预测lncRNA 与正义链mRNA 最佳碱基配对结合而调控基因沉默、转录及mRNA 的稳定性,通过PubMed数据库搜索其功能。
1.5 差异表达lncRNA的miRNA前体预测
研究发现一部分lncRNA 可做为miRNA 前体,通过酶的剪切后形成miRNA 行使相应的功能,特别是成熟的miRNA 可以作用于多个位点,抑制翻译过程或导致基因沉默。利用miRPara软件[13]或直接将ln‑cRNA比对到miRBase数据库,对潜在的miRNA前体及其靶基因探讨。
1.6 RT‑qPCR验证
用TRIzol 试剂提取保存样品的总RNA,试剂盒逆转录成cDNA,合成lncRNA 引物,在ABI7500 定量PCR 仪中应用SYBR Green 法对差异表达的lncRNA进行实时定量PCR[14]。扩增后的结果用ΔCt(循环临界值的差值)来评估每个组lncRNA的表达水平,计算方法为ΔCt=(lncRNA 的平均Ct)−(β‑actin 的平均Ct),将ΔCt转换为2−ΔCt表示lncRNA的相对表达量[15]。取均值计算,采用两样本t检验比较lncRNA 在ADE组与对照组的相对表达量差异,并绘制柱状图。
1.7 主要数据库
(1) DAVID 在线基因功能注释数据库,http://da‑vid.abcc.ncifcrf.gov/;(2)Gene Ontology 数据库,http://geneontology.org/page/go‑database;(3)KEGG 数据库,http://www.kegg.jp/;(4) miRBase 数据库,http://www.cuilab.cn/hmdd。
1.8 统计学处理
应用SPSS25.0 统计软件分析数据,计量资料以表示,多组间比较采用单因素方差分析,两组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 不同感染滴度L‑02 细胞病变及培养上清AST、ALT、AST/ALT比值
培养48 h 后在倒置显微镜下观察L‑02 细胞病变,如图1 可见,其中Moi=0.1 组细胞出现一定皱缩,折光度有增强;Moi=0.5 组细胞有一些脱落;Moi=1.0组细胞脱落明显,皱缩和折光度增强;对照组细胞未出现明显病变。

图1 ADE感染L‑02细胞状态(48 h,200倍)
根据回归方程计算得到每个感染滴度下的AST和ALT值,然后计算AST/ALT比值,如表1所示,L‑02细胞在DENV2 感染48 h 后,感染滴度MOI 为0.5 时,AST/ALT 比值最高为2.74,因此,以MOI 为0.5,感染48 h为感染的最适条件,后续送检样品及RT‑qPCR验证均以此为依据。

表1 ADE模拟致肝细胞损伤中转氨酶检测结果
2.2 LncRNA差异表达谱
本研究根据log2(ratio)≥1.5 为高表达,log2(ra‑tio)<1.5为低表达的筛选标准,ADE 组中得到75 个差异表达的lncRNA,其中36 个高表达,39 个低表达。而这75 个差异表达的lncRNA 又可分为46 个已知lncRNA和29个未知lncRNA。
2.3 差异表达lncRNA潜在靶基因的注释和预测
对差异表达lncRNA(前10)可能位于某潜在的靶基因上、下游预测结果如表2 所示:ADE 中有2 个lncRNA(XLOC023862,XLOC039796)位于某基因上游,2 个lncRNA(n344659,XLOC017926)位于某基因下游。通过碱基互补配对及最小自由能预测差异表达未知lncRNA(前10)与mRNA 是否存在互作关系,结果如表3所示:2个lncRNA(XLOC008997,XLOC029149)与mRNA(NM_002864,NM_032487)存在相互作用。对差异表达lncRNA调控的基因通过PubMed 数据库搜索该基因的功能,检索到n344659潜在靶标为基因10236,其编码蛋白具有miRNA前提处理功能。
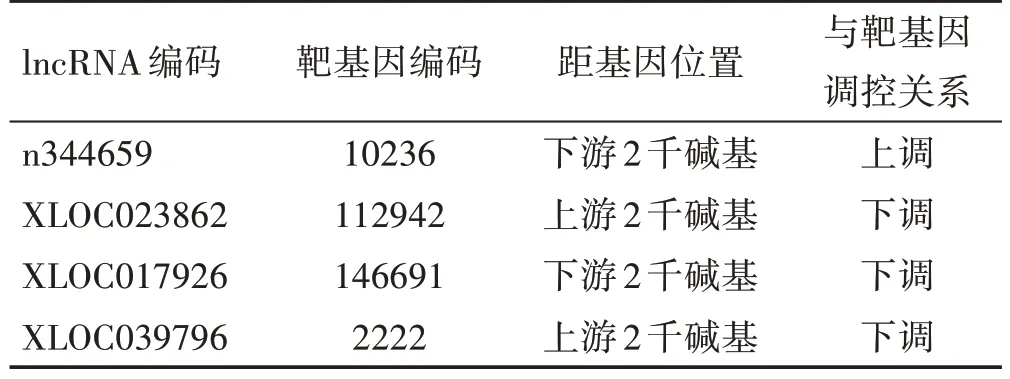
表2 差异表达lncRNA(前10)与潜在靶基因上下游关系预测

表3 差异表达lncRNA(前10)与靶mRNA相互作用预测
2.4 差异表达lncRNA的pre‑miRNA预测
在miRBase 数据库中,已知lncRNA(前10)预测pre‑miRNA,结果如表4。其中n344462 的预测结果中,hsa‑let‑7a‑1 为肿瘤活性抑制因子,而hsa‑let‑7f‑1可抑制Bcl‑xL 基因的表达;未知lncRNA 预测得到的pre‑miRNA,由于尚无成熟的数据库,结果仅以碱基序列的形式表达,见表5。

表4 已知lncRNA的pre‑miRNA预测结果

表5 未知lncRNA的pre‑miRNA预测结果
2.5 差异表达lncRNA验证结果
在ADE 与对照组中8 个高表达lncRNA(4 个已知,4 个未知)和8 个低表达lncRNA(4 个已知,4 个未知)中扩增出8 个已知lncRNA,5 个未知lncRNA。根据循环参数差值在两组间计算的相对表达量值2−ΔCt进行两样本t检验,差异具有统计学意义(P<0.05),见图2。

图2 ADE与对照组lncRNA差异表达(2−Δct)
3 讨论
LncRNA 参与宿主与病毒之间的相互作用及调控[10],还可作为小RNA 的前体发挥转录后调控作用[16],影响细胞内及生物体发育过程中的信号转导[17]。在感染性疾病中差异表达及作用机制受到愈来愈多的关注。本研究通过建立ADE 模拟感染肝细胞,利用RNA‑Seq 及生物信息学方法,根据设定的差异表达阈值得到差异表达的lncRNA。作为抗病毒感染和抗炎症反应中的负调控因子[18],宿主的lncRNA可参与病毒的复制以及调控宿主的先天免疫反应[19]以及调控内源性miRNA 的表达功能[20]。本研究通过预测差异表达lncRNA 潜在的靶基因和miRNA 的前体,结果进一步证实了某些差异表达lncRNA 具有重要的生物学功能,利用RT‑qPCR扩增结果转换成的相对表达量在对比组间的数值关系与生物信息学分析的差异表达结果基本一致。本研究初次得到的差异表达lncRNA信息可为深入研究登革病毒感染引起肝细胞损伤机制提供一定科学依据。

