Peiminine通过调控COX-2/PGE2/EGFR信号通路促进人结肠癌HCT-116细胞凋亡的分子机制
饶 军 熊爱华 张康梅 何勤思 郑 智
结肠癌是临床常见的恶性肿瘤之一,发病率近年来呈明显上升趋势,平均发病年龄在41~65岁[1]。近二十年来,结肠癌尤其是晚期结肠癌的临床疗效仍未获得明显改善,肿瘤的复发和转移是治疗失败的主要原因。随着对中医药研究的不断深入,中医药在癌症综合治疗中的作用和地位得到了重视和提高,中西医结合肿瘤治疗已成为我国恶性肿瘤治疗中不可或缺的重要组成部分[2-3]。在前期的研究工作中,我们对贝母素乙(Peiminine)抗癌机制进行了一些探索和总结,其具有镇静、抗炎,抗肺纤维化,抗过敏、增强耐药肿瘤细胞对药物敏感性等作用。本文拟进一步研究Peiminine对COX-2/PGE2/EGFR信号通路的调控作用,或为进一步治疗结肠癌患者指出新的方向。
1 材料与方法
1.1 药物及细胞株
贝母素乙(Peiminine)购自于中国食品药品检定所,人结肠癌 HCT-116 细胞由清华大学生命科学院友好提供。
1.2 主要试剂与仪器
PGE2 ELISA试剂盒由晶美生物有限公司上海分公司提供;封闭缓冲液:含5% (w/v) 脱脂奶粉的PBS缓冲液;1 × PBS缓冲液(上海生工);二抗缓冲液:150 mM NaCl,50 mM Tris-Cl pH7.5;ECL底物显色液(Thermo);一抗:COX-1(proteintech,13393-1-AP)、COX-2(proteintech,12375-1-AP)、P-ERK(Santa Cruz,sc-7383)、ERK(proteintech,11049-1-AP)、P-P38(Santa Cruz,sc-166182)、P38(proteintech,14064-1-AP)、P-P53(Santa Cruz,sc-377567)、P53(proteintech,60283-2-Ig)、NF-κB(proteintech,10745-1-AP)、IL-6(proteintech,66146-1-Ig)、IL-10(proteintech,20850-1-AP);二抗:HRP-羊抗兔、HRP-羊抗鼠;TRIZOL(sigma);DEPC-H2O(上海生工);氯仿(国药集团);异丙醇(国药集团);无水乙醇(国药集团);70%乙醇(国药集团);反转录试剂盒(TaKaRa);一般PCR试剂(TaKaRa)。
Western blot转移电泳槽:Tanon VE186;垂直电泳槽:Tanon VE180;凝胶成像系统:BIO-RAD Gel Doc XR+;低温高速离心机:Thermo ST40R;Roche 480 荧光定量PCR仪;分析软件:BIO-RAD Image Lab Software,Version 5.1。
1.3 细胞培养和处理
HCT116细胞用DMEM培养液(内含10%胎牛血清+1%双抗)重悬细胞,放至37 ℃,5% CO2的温箱中培养。根据细胞的生长情况以及培养液的变化情况,每2~3天换液1次;细胞长至培养瓶面积90%左右时,将细胞进行传代或冻存。选择第2~5代生长良好的细胞用于本实验。以每孔 250 μg 的贝母素乙加入,处理48 h后收集细胞。
1.4 Real-time qPCR法
Trizol法提取RNA,将培养瓶中的培养基吸出,用1×PBS加入培养瓶中,轻微洗干净,再将培养瓶放置于冰上,加入800 μl Trizol,反复吹打,将贴壁细胞全部吹打下来,转到1.5 ml EP管中;加入200 μl氯仿,剧烈震荡混匀;于4 ℃离心12 000 rpm,5 min;将上清转入1.5 ml小管中,加入与上清等体积的异丙醇,-20 ℃放置1 h或更长(充分沉淀)不要吸取中层物质,否则会有DNA污染;于4 ℃离心12 000 rpm,5 min;小心移去上清,防止沉淀丢失;用70%乙醇洗2遍,每次700 μl,12 000 rpm,4 ℃,5 min;小心的尽可能吸走上清,超净台上倒置将酒精空干;加入30 μl DEPC-H2O溶解,-70 ℃保存。RNA反转录成cDNA参照TaKaRa反转录试剂盒(RR047A)说明书,并按照一般定量PCR试剂体系(TaKaRa)进行荧光定量PCR。
1.5 Western Blot法
细胞长满培养瓶后,每孔中分别加入200 μl细胞裂解液,收集细胞,提取细胞中的蛋白。提取好总蛋白后采用BCA法进行定量,将每个样本的浓度调制基本一致。-20 ℃保存备用。50 μl收集的蛋白中,加入150 μl 4×loading buffer,混匀后,100 ℃水浴5 min,冰上冷却。配置好分离胶和浓缩胶,每孔上样40 μl,电泳90 min。转移结束后关掉电源,取出PVDF膜放入容器(培养皿)中,加适量的封闭缓冲液[含5%(w/v)脱脂奶粉的PBS缓冲液],室温轻轻摇动温育1~2 h。换新的培养皿,加入10 ml上述封闭缓冲液,并按1∶1 000的量加入一抗,4 ℃ 孵育过夜。PBS缓冲液洗涤3次,每次10 min。将PVDF膜转移至另一培养皿中,加入含有5%脱脂奶粉的二抗缓冲液,并以1∶5 000量加入二抗(HRP标记羊抗兔IgG),室温摇动温育1 h。再将PVDF膜转移至另一培养皿中,加适量二抗缓冲液(150 mM NaCl,50 mM Tris-Cl pH7.5),室温洗涤3次,每次10 min。ECL加底物显色液,拍照。
1.6 统计学方法
2 结果
2.1 ELISA法测定PGE2的变化
本研究利用ELISA试剂盒方法测定Peiminine处理人结肠癌HCT-116细胞后PGE2含量的变化,结果显示,与对照组(Ctrl)相比,Peiminine处理后细胞内PGE2含量明显降低,差异具有统计学意义(P<0.01),见图1。这表明,Peiminine药物能显著抑制PGE2的生成。
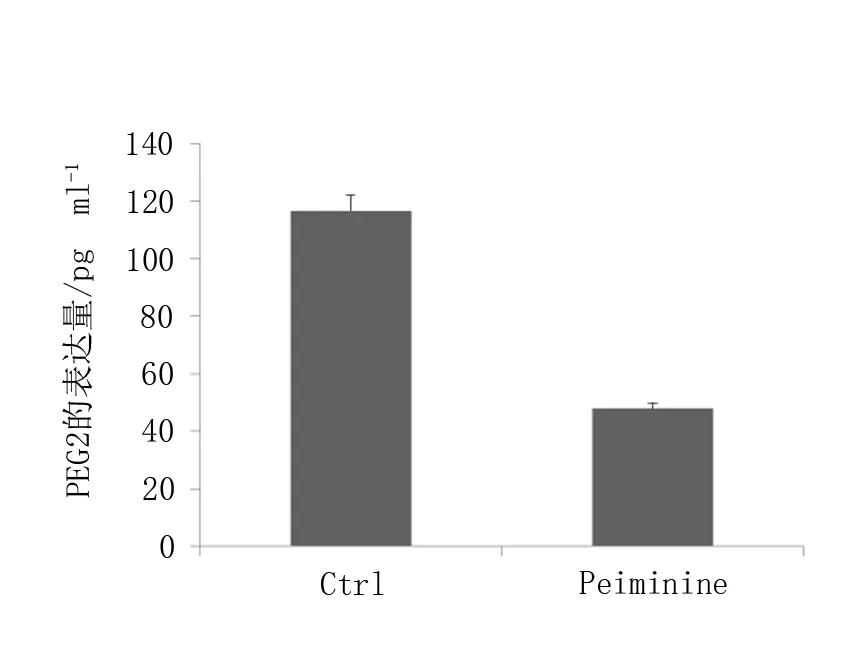
图1 ELISA法测定PGE2的表达变化
2.2 Real-time qPCR和Western Blot法测定COX-1和COX-2的变化
Real-time qPCR分别测定了Peiminine处理人结肠癌HCT-116细胞后COX-1和COX-2基因表达量的变化。如图2所示,Peiminine处理后细胞内COX-1和COX-2的含量都比对照组(Ctrl)的低,但只有COX-2的变化具有显著性(P<0.01)。为了进一步证实该结果,我们接着采用Western Blot法测定COX-1和COX-2的变化(图3),结果显示Peiminine处理后细胞内COX-2含量降低比较明显,相比而言,COX-1的变化不大显著。这表明Peiminine药物能显著抑制COX-2基因及其蛋白的表达。

图2 荧光定量PCR分析COX-1和COX-2表达变化

图3 WB分析对照组和250 μg的贝母素乙处理细胞组中的相关蛋白表达变化
2.3 Real-time qPCR和Western Blot法测定IL-6、IL-10和NF-κB的变化
针对IL-6、IL-10和NF-κB的变化进行了研究,实验结果显示,与对照组(Ctrl)相比,Peiminine处理后细胞内IL-6和NF-κB含量均显著性降低(P<0.01),而IL-10含量明显升高(P<0.01),见图4。Western Blot法测定结果也证实了Peiminine药物能影响相关炎症因子的表达,显著降低IL-6和NF-κB的表达量而促进IL-10含量的升高,见图3。
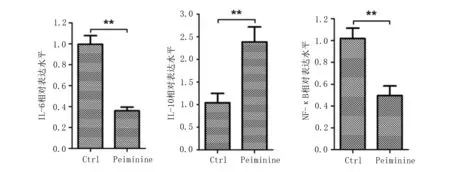
图4 荧光定量PCR分析IL-6、IL-10和NF-κB表达变化
2.4 Western Blot法测定EGFR信号通路中的关键蛋白
基于Western Blot法研究了EGFR信号通路中关键蛋白(ERK、P-ERK、P53、P-P53、P38和P-P38)表达量的变化。根据灰度值可以发现Peiminine处理后细胞这6种蛋白的表达量均降低(P<0.01),见图3。这说明Peiminine药物能抑制EGFR信号通路,调控其关键蛋白的表达。
3 讨论
研究表明Peiminine可以抑制PI3K/Akt/mTOR信号通路,激活AMPK 信号通路,促进结肠癌细胞凋亡[4-6]。高通量非靶向代谢组学分析结果表明经过Peiminine处理后57 种代谢物发生显著性变化 (P≤0.05),其中部分差异的代谢物参与 PI3K/Akt/mTOR 的调控或者与氧化应激有关。更重要的是一半以上(32/57)的差异代谢物都是脂类化合物,这其中涉及到不饱和脂肪酸代谢的COX-2/PGE2通路。为了进一步证实Peiminine对COX-2/PGE2/EGFR信号通路的调控作用,本研究通过细胞实验来研究Peiminine对该通路中的相关基因、炎症因子及其相关蛋白表达量的影响。
已有研究证实多不饱和脂肪酸与癌症(包括结肠癌)的发生及转移密切相关[7]。一方面 ω-6 PUFA(花生四烯酸)能够与环氧合酶2(COX-2)结合产生前列腺素PGE2,而PGE2是人体前列腺素中重要的一种,已经被研究证实在肿瘤细胞增殖、侵袭、血管生成、免疫抑制等多方面发挥重要作用。它可以通过G蛋白偶联的EP信号通路激活下游MAPKs途径中的一系列信号分子从而显著促进肿瘤的增殖、侵袭与转移。另外一方面,ω-3 PUFA(二十碳五烯酸)与环氧合酶1(COX-1)结合后产生PGE3,并抑制COX-2的活性,减少 PGE2的生成,抑制癌细胞侵袭能力。COX-2在许多癌症中过表达,与肿瘤微环境的免疫抑制以及高水平的PGE2产生密切相关。大量研究表明,抑制PGE2的产生及其信号级联可以改善抗肿瘤免疫反应的多个方面[8]。本研究发现Peiminine处理后人结肠癌HCT-116细胞后,其COX-2和PGE2含量明显降低,说明Peiminine能够调控COX-2的表达抑制PGE2的生成。与此同时,相关炎症因子IL-6、IL-10和NF-κB的表达量也随之受到影响。更重要的是,MAPKs途径中EGFR信号通路中重要蛋白P-ERK、P-P53和P-P38的表达量也相应降低。
综上所述,Peiminine可以抑制COX-2的表达和PGE2的生成,改善抗肿瘤免疫反应,抑制EGFR信号通路,促进肿瘤细胞凋亡,达到抗肿瘤的作用。

