壳寡糖抑制肺癌细胞系恶性增殖相关机制的探讨
刘丘岗
肺癌患病率逐年增加,且具有极高的死亡风险,非小细胞肺癌(non small cell lung cancer,NSCLC)是其主要病理类型之一[1]。当下临床治疗肺癌患者的措施诸多,然而尚未发现可有效根治该疾病的手段,患者5年生存率极低[2]。临床实践证实,尽管肺癌患者在早期诊断后得到有效的外科治疗,但其亦可出现继发局部转移或全身系统性转移,甚至导致死亡[3-4]。故探寻肺癌发病机制及相关基因对阐明肿瘤细胞转移及增殖具有重要价值。p53基因突变或失活在多类型癌症起病及演变过程中占据重要地位,如其可在50%左右的癌症中出现突变,并参与介导致癌信号[5]。p53是抑癌基因疗法中至关重要的一部分,其已成为临床实践基因疗法的主要试验基因之一[6]。壳寡糖水溶性良好,细胞亲和性较强,同时亦可与器官组织相容,有报道显示,其抗菌性、抗氧化性、抗癌作用显著[7]。临床研究证实,壳寡糖可促进诸多细胞凋亡,但针对其在肺癌中的作用及其机制尚未完全揭示[8]。故本次研究基于p53介导自噬通路,旨在探讨壳寡糖抑制肺癌细胞系恶性增殖的作用及其相关机制。
1 材料与方法
1.1 材料与试剂、仪器
1.1.1 细胞株 肺癌细胞系A549购于沈阳康沐瑞达生物科技有限公司。
1.1.2 试剂 壳寡糖购于上海雅吉生物科技有限公司;DMSO购于北京伊塔生物科技有限公司;0.25%胰蛋白酶购于武汉华联科生物技术有限公司;鼠抗Bcl-2、Bax、Survivin抗体购于艾美捷科技有限公司;DAB显色剂购于北京百奥莱博科技有限公司。
1.1.3 仪器 荧光显微镜购于广州科适特科学仪器有限公司;凝胶成像系统购于普迈精医科技(北京)有限公司;超净工作台购于上海辅泽商贸有限公司;倒置显微镜购于上海土森视觉科技有限公司;CO2培养箱购于;高速冷冻离心机购于杭州诺丁科学器材有限公司;酶标仪购于北京安麦格贸易有限公司。
1.2 方法
1.2.1 细胞培养 将肺癌细胞系A549置于1640培养基(含10%胎牛血清)中培养,然后放入CO2培养箱中孵育。密切关注细胞生长情况,待其处于对数生长期时进行后续研究。
1.2.2 细胞分组 将A549细胞随机分为阴性对照组、壳寡糖低浓度组、壳寡糖中浓度组、壳寡糖高浓度组,并分别予以0、1、2、5 mg·ml-1壳寡糖处理24 h。
1.2.3 MTT法测定A549细胞增殖能力 将处于对数生长期的细胞制成细胞悬液,以每孔6×103个细胞植于96孔板,每组设置5个复孔,然后将细胞放入CO2培养箱中孵育。分别于24 h、48 h、72 h时向每孔中加入20 μl 5.0 mg·ml-1MTT,4 h后置于离心机中以每分钟3000转的速度离心10 min,弃上清液并于每孔中加入150 μl DMSO,震荡15 s后于波长490 nm处检测吸光度值,同时分析其增长抑制率。细胞增长抑制率(%)=(1-实验组吸光度值/对照组吸光度值)×100%。
1.2.4 Hoechst染色法测定A549细胞凋亡形态 将处于对数生长期的细胞制备细胞悬液,并将其浓度调整为1×105个/ml,同时植于6孔板中,常规孵育24 h,待其贴壁后经0.25%胰酶消化、离心机离心后收集细胞。取提前冷处理的Buffer A冲洗3次并转至新的无菌EP管中,加入1 ml 4%甲醛固定液固定15 min,再次离心并弃上清液,采用Buffer A冲洗3次重悬细胞。将2滴细胞悬液加于载玻片中央制备细胞涂片,并放在室温下自然风干。加2滴Hoechst 33258工作液于图片,在室温下封闭反应15 min,然后采用蒸馏水冲洗,于紫外光波长340 nm处激发,并于显微镜下观察。
1.2.5 流式细胞术测定A549细胞凋亡率 将处于对数生长期的细胞制备细胞悬液,并将其浓度调整为1×105个/ml,同时植于培养瓶中,常规孵育24 h,采用0.25%胰酶进行常规消化,并放在离心机以每分钟1000转的速度离心10 min,吸弃上清液后取 PBS液重悬细胞,再次放入离心机以1000转的速度离心10 min,弃上清液后加入结合缓冲液及5 μl Annexin V-FITC,轻轻晃动使其充分混匀,放在室温下自然孵育15 min,离心弃上清液;加入10 μl碘化丙啶轻轻晃动并使其充分混匀,于室温下孵育15 min采用流式细胞仪检测。
1.2.6 western blot检测A549细胞凋亡相关蛋白[Bcl-2、Bax、生存素(Survivin)]及p53(p53、p-p53)通路相关蛋白表达水平 取处于对数生长期的细胞提取总蛋白,同时应用BCA蛋白定量试剂盒检测其蛋白浓度,经SDS-PAGE电泳、转膜至PVDF膜、封闭、一抗孵育、二抗孵育、DAB显色后进行显影及定影,然后采用凝胶成像系统采集图像,最后对图像进行分析处理。
1.3 统计学方法
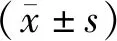
2 结果
2.1 壳寡糖对A549细胞增殖能力的作用
在24 h、48 h、72 h时,壳寡糖浓度组A549细胞系增殖抑制率较阴性对照组显著升高,且呈时间浓度依赖性(P<0.05)。见表1。

表1 各组A549细胞增殖抑制率比较
2.2 壳寡糖对A549细胞凋亡能力的作用
壳寡糖浓度组A549细胞凋亡率较阴性对照组显著升高,且呈浓度依赖性(P<0.05)。见表2。阴性对照组A549细胞染色较淡,表现为暗蓝色;壳寡糖浓度组A549细胞发生凋亡,出现核固缩、变小、核碎裂等现象,且和染色较深,表现为亮蓝色,同胞内及胞周存在颗粒状深染物质。

表2 各组A549细胞凋亡率比较
2.3 壳寡糖对A549细胞凋亡蛋白表达的影响
壳寡糖浓度组A549细胞Bcl-2、Survivin蛋白表达水平均较阴性对照组显著降低,Bax蛋白表达水平均较阴性对照组显著升高,且呈浓度依赖性(P<0.05)。见图1。
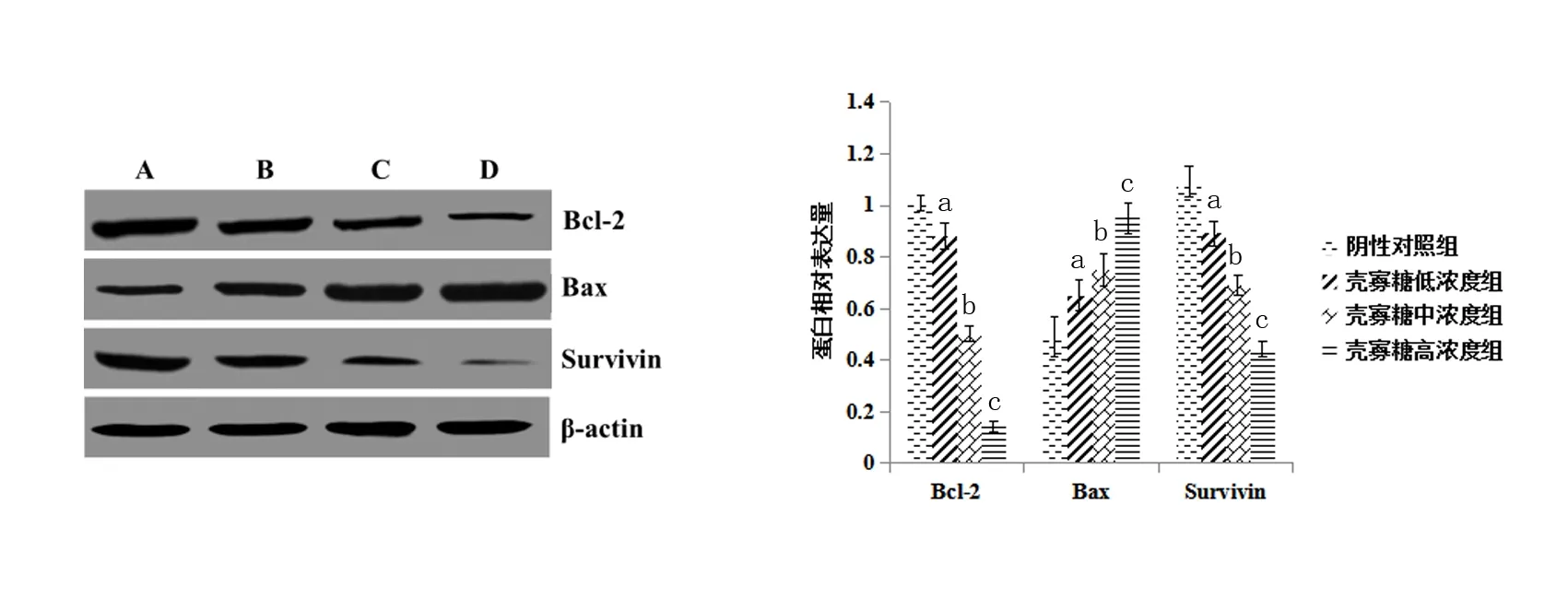
A为阴性对照组;B:壳寡糖低浓度组;C为壳寡糖中浓度组;D为壳寡糖高浓度组; a表示与阴性对照组相比,P<0.05;b表示与壳寡糖低浓度组相比,P<0.05;c表示与壳寡糖中浓度组相比,P<0.05。
2.4 壳寡糖对A549细胞p53信号通路蛋白表达水平的影响
壳寡糖浓度组A549细胞中p53、p-p53、beclin 1蛋白表达水平阴性对照组显著升高,且呈浓度依赖性(P<0.05)。见图2。
3 讨论
壳寡糖由甲壳素脱乙酰基并降解所得,易被人体吸收。Xu[9]研究表明,壳寡糖在肝癌、结肠癌、肺癌、等肿瘤中发挥明显的抗肿瘤作用,然而该过程涉及方面诸多,十分复杂。近年来多项研究显示,壳寡糖抗肿瘤作用机制主要是通过促进癌细胞凋亡及坏死实现的[10]。Pae等[11]研究证实,壳寡糖既可阻断人原髓细胞白血病细胞HL-60生长,亦可诱导该细胞凋亡,且该过程中存在细胞周期异常。但目前针对p53介导的自噬通路在肺癌细胞系中的作用及其机制尚未有研究进行探究,因此本研究将进一步进行分析。
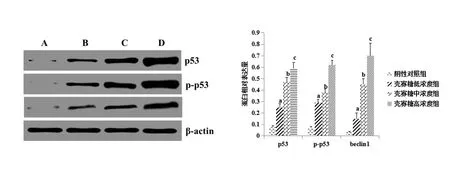
A为阴性对照组;B为壳寡糖低浓度组;C为壳寡糖中浓度组;D为壳寡糖高浓度组; a表示与阴性对照组相比,P<0.05;b表示与壳寡糖低浓度组相比,P<0.05;c表示与壳寡糖中浓度组相比,P<0.05。
本次研究中我们分别于不同时间段采用MTT法对各组A549细胞增值抑制率进行分析,结果发现,不同时间段内壳寡糖浓度组A549细胞系增殖抑制率较阴性对照组显著升高。此外我们亦采用Hoechst染色及流式细胞术对各组细胞凋亡形态及凋亡率进行检测分析,发现壳寡糖浓度组A549细胞凋亡较阴性对照组显著升高,壳寡糖浓度组A549细胞发生明显凋亡,表现为亮蓝色,且壳寡糖浓度为5.0 mg·ml-1时细胞增殖抑制作用及促凋亡作用最显著。以上结果提示壳寡糖抗肿瘤效果显著。Bcl-2可有效抑制细胞凋亡能力,主要是通过阻断Bax及Bak活性进行的。Survivin可发挥肿瘤特异性,且在癌细胞即胚胎组织中存在表达。董永强等[12]研究证实,Survivin可作为半胱天冬氨酶-3、半胱天冬氨酶-7直接阻断剂进而抑制诸多因素刺激产生的细胞凋亡环节,亦可与周期相关蛋白激酶相互作用发挥凋亡信号转导途径抑制作用。Western blot检测结果显示,壳寡糖浓度组A549细胞Bcl-2、Survivin蛋白表达水平均较阴性对照组显著降低,Bax蛋白表达水平均较阴性对照组显著升高,且呈浓度依赖性。提示壳寡糖抗促凋亡作用可能是通过上调促凋亡蛋白Bax表达及下调抗凋亡蛋白Bcl-2表达进行的,而肺癌细胞增殖抑制作用可能是通过阻断半胱天冬氨酶家族抑制剂Survivin表达实现的,可为壳寡糖抗肿瘤作用提供实验理论基础。针对p53抗肿瘤生物学作用主要由两方面入手,一是其可阻断细胞分裂过程,将细胞阻滞于G1期继而发挥抗肿瘤作用;二是p53可通过介导细胞凋亡及自噬发挥抗肿瘤作用,其中后者是p53阻断肿瘤生物学功能的主要通路,阻断肿瘤进展效果显著。beclin 1是1种具有抗肿瘤作用的自噬相关调节基因,其抗肿瘤作用机制主要是通过促进细胞自噬及凋亡达到阻断肿瘤进展的目的[13-14]。王文玉等[15]研究证实,beclin 1可明显阻断体外A549细胞系及裸鼠体内A549细胞系增殖能力,而应用药物可促进自噬发生,可在一定程度上增强癌细胞对放化疗敏感性。壳寡糖浓度组A549细胞中p53、p-p53、beclin 1蛋白表达水平阴性对照组显著升高,且呈浓度依赖性(P<0.05)。提示壳寡糖可通过调控p53介导的自噬通路进而上调p53、p-p53、beclin 1蛋白表达水平实现肺癌细胞增殖抑制及诱导凋亡。
综上所述,壳寡糖可抑制肺癌细胞系恶性增殖并促进细胞凋亡,其作用机制可能是通过调节凋亡相关Bcl-2、Survivin、Bax表达及p53介导的自噬通路实现的。

