蓝藻FBP/SBPase的制备及其与配体相互作用的分析
——科研转化的化学生物学综合实验设计
冯玲玲,陈琼,李玉梦,梁景晗,王舟
华中师范大学化学学院,农药与化学生物学教育部重点实验室,武汉 430079
人类活动的加剧和全球气候的变暖使得世界各地湖泊富营养化程度日益严重,蓝藻水华事件频繁爆发。蓝藻水华产生的高密度藻类危害水域中其他生物的生存与发展、破坏水域生态景观,给渔业、旅游业、人类生活等带来严重的危害[1,2]。使用化学杀藻剂抑制蓝藻生长或杀灭蓝藻是快速有效解决蓝藻水华问题的重要防治手段。现有的化学杀藻剂,如硫酸铜、高锰酸钾及过氧化物等不是针对藻类特异设计的,存在选择性差、对其他生物毒性大等缺点,极大地限制了化学杀藻剂防治藻害效能的充分发挥[3],因此,获得选择性高、毒性小的杀藻剂是现代杀藻剂创制研究的一个发展趋势,研发新型的杀藻剂具有重要意义。
化学生物学的一个重要研究内容是以生物体中重要调控酶为靶酶,通过研究靶酶与配体之间的相互作用机理,进而建立基于靶酶的农药或医药筛选模型,获得作用于新靶点的具有自主知识产权的医药及农药制剂[4–9]。运用化学生物学研究策略和技术,以藻类光合作用系统中重要调控酶为靶标进行抑制剂的设计与筛选是获得新型杀藻剂的有效途径之一。果糖-1,6-/景天庚酮糖-1,7-二磷酸酶(Fructose-1,6-/sedoheptulose-1,7-bisphosphatase,Cy-FBP/SBPase)是蓝藻光合作用中重要的调控酶,是寻找杀藻剂治理蓝藻水华污染问题的一个潜在靶标。研究Cy-FBP/SBPase的酶学性质、酶与配体的相互作用,是建立基于靶酶的杀藻剂筛选模型的关键。
化学与生物学、医学等学科的交叉融合大大促进了化学生物学学科的建立与发展。明显的标志是国际上著名大学如哈佛大学、耶鲁大学、康奈尔大学等纷纷将化学系改名为化学与化学生物学系[10]。我国自2000年由国家自然科学基金委化学部主持召开“化学生物学”研讨会以来,化学生物学科学研究得到了飞速发展,化学生物学专业人才的需求也急剧增加,因此国内多所高校相继设立了化学生物学本科专业或化学生物学特色人才培养基地[11–13]。化学生物学本科教学的理论课程体系得到了迅速发展和逐步完善,但化学生物学实验课程建设和发展相对滞后[14–17]。因此开发适合本科生高阶发展所需要的化学生物学创新实验项目,是建设及完善高等院校化学生物学本科实验教学课程体系亟需解决的问题。
前期我们报道了Cy-FBP/SBPase的晶体结构、酶学性质、酶与配体的相互作用、抑制筛选等研究成果[18–20]。基于此,本文结合化学专业高年级本科生的知识背景、发展需求,将我们在科研领域中取得的系列研究成果设计转化为一个化学生物学综合实验。实验内容包括通过异源蛋白的表达、纯化获得靶酶Cy-FBP/SBPase,然后测定靶酶的纯度及含量,测定底物、金属离子及抑制剂等配体对靶酶活性的影响,探讨靶酶的酶学性质、酶与配体之间的相互作用。通过本实验项目的训练,学生可以掌握以生物体重要调控酶为靶标建立抑制剂筛选模型的研究思路、研究方法及重要实验技术,拓展思维视野,提高分析问题及解决问题的能力,提升综合运用化学生物学知识的能力,为今后从事化学生物学科学研究活动及其他相关领域的研究工作奠定基础,同时有助于增强科研服务社会的意识及社会责任感。
1 实验目的
(1) 学习并掌握通过异源蛋白的表达、纯化获得靶酶的原理及方法,掌握运用十二烷基磺酸钠-聚丙烯酰胺凝胶电泳技术(SDS-PAGE)分析蛋白纯度及大小的方法以及Bradford法测定蛋白质含量的方法。
(2) 学习无机磷法测定Cy-FBP/SBPase活性的方法,掌握酶学性质、酶与配体相互作用的实验分析方法。
(3) 掌握紫外-可见分光光度计、酶标仪、冷冻离心机及蛋白质电泳仪等仪器设备的基本原理及使用方法。
(4) 学习基于靶酶建立抑制剂筛选模型研究中相关实验的设计,提升分析及解决问题的能力,增强对化学生物学实验技术的综合应用能力,增强科研服务社会的意识及社会责任感。
2 实验原理
2.1 Cy-FBP/SBPase的制备
以大肠杆菌为代表的原核表达系统具有操作方便、需时短、表达量大等优点,成为生物合成外源蛋白的首选。通过基因重组技术,将Cy-FBP/SBPase基因fbp克隆到带有组氨酸标签(His-tag)的pET-28a(+)载体上获得重组载体pET-fbp,然后转入大肠杆菌中,在异丙基-β-d-硫代半乳糖苷(isopropyl-β-d-thiogalactoside,IPTG)的诱导下生物合成目标蛋白。
Ni-NTA琼脂糖树脂是一种通过亲和层析法分离纯化带有His-tag重组蛋白的介质,His-tag中组氨酸残基与镍离子结合具有较高的特异性和亲和性。亲和纯化时含有His-tag的蛋白与Ni-NTA结合,而不带His-tag标签的蛋白则被洗涤下去。结合在介质中的目标蛋白再用高浓度的咪唑洗脱,从而得到高纯度的目的蛋白。
2.2 Cy-FBP/SBPase的纯度、大小及含量分析
SDS-PAGE法不受蛋白质本身所带电荷、形状的影响,电泳结果只与蛋白质的相对分子质量有关,可以根据蛋白的分子量不同将蛋白质各组分分开,从而定性及半定量地分析Cy-FBP/SBPase蛋白的纯度及大小。
Bradford法测定蛋白质含量的原理是蛋白质与染料考马斯亮兰G-250结合后,染料颜色由棕黑色变为蓝色,染料的最大吸收峰从465 nm变为595 nm。基于595 nm下测定的吸光度值与蛋白质浓度成正比,从而计算得出样品中蛋白质的含量。这一方法操作简单,灵敏度高。
2.3 Cy-FBP/SBPase的酶活性测定、酶学性质、配体与酶相互作用
采用磷试剂显色法直接测定Cy-FBP/SBPase催化底物果糖-1,6-二磷酸(Fructose-1,6-biphosphate,FBP)产生的无机磷,方法简单、高效快捷,适合用于Cy-FBP/SBPase抑制剂的高通量筛选。通过测定底物、金属离子浓度(镁离子和锰离子)、抑制剂对Cy-FBP/SBPase活性的影响,探讨Cy-FBP/SBPase酶学性质、酶与配体的相互作用[18–20]。
3 实验试剂和仪器
3.1 实验试剂
抑制剂D7为本实验室筛选获得的化合物小分子。Imidazloe、MgCl2·6H2O、MnCl2·4H2O、NaCl等为分析纯,购自国药化学试剂有限公司(中国)。酵母提取物、胰蛋白胨、琼脂粉、Tris-Base、IPTG、氨苄青霉素、二硫苏糖醇(DTT)、sodium lauryl sulfate (SDS)、过硫酸铵等为分析纯,购自Biosharp。金属离子溶液储存浓度为10 mmol·L−1,使用时用去离子水稀释至所需实验浓度。底物FBP、亲和树脂Ni-NTA、SDS-PAGE蛋白分子质量Marker及其他试剂在保证实验效果的前提下尽量购买国产可替代产品,比如广州鼎国生物、合肥博美生物学科技、新海基因等国内厂家生产的相关试剂。实验过程中使用水均为去离子水。
3.2 实验仪器
冷冻高速离心机5810R (Eppendorf)、凝胶成像仪(BIO-RAD),酶标仪SpectraMax M5 (Molecular Device),紫外分光光度计Smart SpecTMPlus (BIO-RAD),DYY-8C型双稳定时电泳仪电源(北京市六一仪器厂)。
4 实验内容
4.1 重组酶Cy-FBP/SBPase的制备
首先挑取有重组表达质粒的单菌落,接种于50 mL LB液体培养基(含氨苄青霉素100 μg·mL−1),37 °C振荡过夜,培养12–16 h。然后取过夜的培养液按1%比例接入新鲜LB培养基(含氨苄青霉素100 μg·mL−1)中,37 °C振荡培养至OD600达到0.6–0.8。加入终浓度为0.3 mmol·L−1的IPTG,22 °C振荡诱导培养8–10 h。然后,离心收集大肠杆菌细胞,加入裂解液(10 mmol·L−1Tris-HCl,pH 8.5,0.5 mol·L−1NaCl)将菌体重悬,超声破碎细胞,释放蛋白。离心制备用于亲和层析纯化所需要的上清粗酶提取液。
将制备好的上清粗酶提取液与Ni-NTA亲和树脂在冰浴条件下孵育2–3 h,然后依次分别在50 mmol·L−1、250 mmol·L−1咪唑溶液洗脱,再经过脱盐处理得到目标蛋白,−20 °C存储在50%甘油溶液中备用[18,19]。
4.2 蛋白质的纯度、大小及含量分析
用SDS-聚丙烯酰胺电泳(SDS-PAGE)检测Cy-FBP/SBPase的纯度和大小[18,19]。实验步骤大致为:(1) 制备15 mL 12%的分离胶(H2O 4.9 mL,30%丙烯酰胺6.0 mL,pH 8.8 Tris-HCl缓冲液3.8 mL,10% SDS 150 μL,10%过硫酸铵150 μL,6 μL TEMED);(2) 制备5%的积层胶:H2O 3.4 mL,30%丙烯酰胺0.84 mL,pH 6.8 Tris-HCl缓冲液0.63 mL,10% SDS 150 μL,10%过硫酸铵50 μL,TEMED 5 μL;(3) 蛋白及菌液样品的制备。取蛋白质样品8 μL,加入10 ×蛋白上样缓冲液2 μL,混匀后95 °C温育10 min变性。(4) 上样,电泳,电压100 V。(5) 染色及脱色:电泳结束后,取出蛋白胶,置于考马斯亮蓝染色液中染色20 min左右。然后将蛋白胶置于脱色剂中脱色结束(脱色时间根据脱色效果确定)。(6) 分析:凝胶成像仪分析SDS-PAGE结果。
蛋白含量用Bradford蛋白质定量试剂盒(Tiangen Biotech)提供的标准方法来测定。首先取1 mg·mL−1的牛血清蛋白(BSA) 0、1、2、3、4、5 μL BSA标准溶液,然后加入PBS补齐总体积为15 μL,混合均匀后加入考马斯亮蓝染色剂285 μL,反应10 min,以每孔100 μL加入到96孔板中,测定595 nm处的吸光度,制作蛋白标准曲线。然后取1 μL、3 μL待测目标蛋白溶液,用PBS补齐体积15 μL,按上述方法,测定595 nm处的吸光度,根据蛋白标准曲线拟合的方程计算目标蛋白含量。
4.3 Cy-FBP/SBPase酶活性的测定、酶学性质、酶与配体相互作用的分析
以100 μmol·L−1磷酸二氢钾溶液作为标准溶液,测定单位时间内Cy-FBP/SBPase催化特定底物FBP释放出无机磷量,计算酶的活性[18,19]。
首先取100 μmol·L−1磷酸二氢钾溶液0、10、20、30、40、50 μL,然后分别加入去离子水补齐总体积为100 μL。混匀后,取37.5 μL至干净的1.5 mL离心管。每个离心管中加入375 μL显色剂(钼酸铵溶液与孔雀绿溶液的体积比1 : 3配制,现配现用),显色10 min后,以每孔100 μL加入到96孔板中,测定620 nm处的吸光度,制作磷标准曲线。
实验项目“改变底物浓度对Cy-FBP/SBPase活性的影响”的操作步骤为:在反应体系里加入MgCl215 mmol·L−1,DTT 10 mmol·L−1,pH 8.5 Tris-HCl 50 mmol·L−1,0.04 μg Cy-FBP/SBPase,加水补足22.5 μL,混匀后,分别加入底物FBP 0,0.05,0.1,0.25,0.5,1,2 mM启动反应,分别反应10 min。然后加入12.5 μL HClO4终止反应,再加入375 μL显色剂显色10 min,以每孔100 μL加入到96孔板中,测定620 nm处的吸光度,根据磷标准曲线拟合方程计算Cy-FBP/SBPase催化产生的无机磷的量,从而计算酶的活性。Cy-FBP/SBPase活力单位U的定义是每分钟催化产生1 μmol·L−1无机磷所需要的Cy-FBP/SBPase酶量为一个酶活力单位。
然后通过单一因子变化分析法,分别改变金属离子浓度(镁离子和锰离子)、抑制剂浓度,测定金属离子、抑制剂对Cy-FBP/SBPase活性的影响。
5 实验结果与讨论
5.1 Cy-FBP/SBPase的制备、纯度及含量的分析
为了分析通过生物合成法获得Cy-FBP/SBPase的纯度,以未经pET28a(+)载体诱导的细胞的粗酶液为对照,通过SDS-PAGE分析重组载体未诱导细胞的粗酶液、重组载体诱导细胞的粗酶液、重组细胞裂解后的上清液、纯化时的流川液、50 mmol·L−1咪唑洗脱液及250 mmol·L−1咪唑洗脱液中Cy-FBP/SBPase的含量情况(图1)。从图1中可以看出,载体pET28a(+)未诱导细胞的粗酶液中没有目标蛋白的表达(条带1),重组载体pET-fbp没有IPTG诱导则没有目标蛋白的明显表达(条带2)。IPTG诱导之后,目标蛋白大量表达(条带3),而且大部分表达的蛋白存在上清液中,呈现可溶性状态(条带4)。流穿液及50 mmol·L−1咪唑洗脱液中只有少量的目标蛋白(条带5和6),说明有His-tag的目标蛋白和Ni-NTA亲和树脂结合效果比较好;而250 mmol·L−1咪唑洗脱液中有非常纯的Cy-FBP/SBPase,纯度达到95%以上(条带7)。因此可以说明异源蛋白的表达及纯化是成功的,而且通过蛋白含量的测定,结果显示1 L培养基可以获得30 mg Cy-FBP/SBPase。

图1 用12% SDS-PAGE分析Cy-FBP/SBPase的表达及纯化情况
5.2 底物FBP对Cy-FBP/SBPase活性的影响
底物浓度是影响酶活性的直接因素。为了分析底物浓度对Cy-FBP/SBPase活性的影响,在一定酶浓度下,改变底物浓度,测定酶活性。结果如图2所示。酶活性与底物浓度的关系可以通过Hill方程拟合,得到Cy-FBP/SBPase最大反应速度Vmax为15.02 ± 0.51 U·mg−1,米氏常数Km为0.083 ±0.01 mmol·L−1。米氏常数是酶的特征常数,可表征酶与底物的结合能力。Hill指数为2,说明一个酶单体分子可能结合2个底物分子,这和我们获得的晶体结构是相符的[19]。
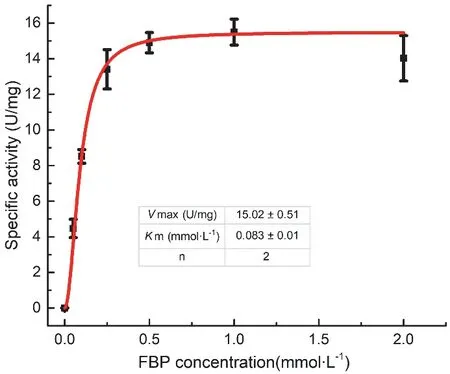
图2 底物FBP对Cy-FBP/SBPase活性的影响
5.3 金属离子对Cy-FBP/SBPase活性的影响
根据金属离子与酶结合的紧密程度,可以将酶分为金属酶和金属激酶。对于金属酶而言,金属离子和酶紧密结合,蛋白形成过程中金属离子就已经存在于酶中。而对于金属激酶,金属离子和酶结合并不那么紧密,但酶发挥催化作用时,加入金属离子,可以使酶的活性极大的提高。如图3所示,当加入金属镁离子及锰离子时,Cy-FBP/SBPase的催化活性迅速提高,说明Cy-FBP/SBPase是金属激酶,但镁离子及锰离子对Cy-FBP/SBPase的影响又是不同的。随着镁离子浓度的增加,Cy-FBP/SBPase的催化活性逐渐升高,然后达到最大值,之后再提高镁离子浓度,对酶的活性影响不是很明显。但是锰离子在很低浓度下可以迅速提高酶的活性,之后锰离子浓度的升高则会抑制酶的活性,预示着镁离子、锰离子与Cy-FBP/SBPase有着不同的作用方式[18,19]。

图3 金属离子对Cy-FBP/SBPase活性的影响
5.4 抑制剂对Cy-FBP/SBPase活性的影响
通过以上实验,我们获知Cy-FBP/SBPase的酶动力学参数,Cy-FBP/SBPase与不同金属离子之间的关系。基于对Cy-FBP/SBPase酶学性质的认识,可以建立以Cy-FBP/SBPase为靶点的抑制剂筛选模型,研究抑制剂对Cy-FBP/SBPase的抑制动力学。如图4所示,我们筛选获得的化合物小分子D7能抑制Cy-FBP/SBPase的催化活性,随着化合物浓度的升高,抑制效率逐渐增大,IC50为31.19 ±3.45 μmol·L−1。在此基础上,可以设计实验,比较不同抑制剂的IC50,分析抑制剂的结构与抑制活性的关系,获取抑制剂构效关系的规律,为筛选基于靶酶 Cy-FBP/SBPase 的杀藻剂奠定了基础[20]。

图4 抑制剂对Cy-FBP/SBPase活性影响
6 实验教学模式、教学设计及教学安排
本综合设计实验的主题面向社会需求,结合化学生物学科研成果,易于激发学生科研服务社会的意识及增强社会责任感。在强大内动力和社会需求的驱动下,学生带着目标学习,可以很好地综合运用所学知识,建立并掌握化学生物学思维方式、实验技术。本实验设计为28学时,每组学生最多8人。每组8名学生可以自由组合,分2人一小组完成相应的实验项目。教学模式、教学设计及教学安排建议如下:
(1) 阅读文献:阅读靶向酶的药物筛选模型建立的相关文献并绘制思维导图,本部分设计为4个学时。首先实验教师准备10篇靶向酶的药物筛选方面的最新研究性文献,然后每位学生至少阅读其中2篇,这样可以保证文献的质量和提高学生选择文献的效率,也给学生一定的自主选择的机会。通过文献的阅读,绘制思维导图,总结靶向酶的药物筛选模型建立的研究思路、技术路线、关键技术及方法,初步构建药物筛选模型的思维框架,完成信息输入过程,并以小组讨论和个人汇报的形式完成信息输出过程,教师或助教参与并引导信息输出过程。通过这4个学时的学习,学生可以提升阅读科研文献的能力、了解化学生物学的最新研究进展、研究思路和涉及的实验技术,同时还可以提升逻辑思维能力、倾听能力及语言表达能力。
(2) 多个实验项目的灵活安排与自主选择相结合。本部分为24学时。实验项目设置2个必选实验项目(14学时)、2个任选实验项目(8学时)及2个说课形式完成的实验项目(2学时)。
必选实验项目1为重组酶Cy-FBP/SBPase的制备。这部分实验是后续所有实验的基础,但耗时较长、步骤较多、间隔时间较长。建议这部分内容中挑取单菌落、接种,培养12–16 h;再扩大培养操作,继续培养3 h左右;然后诱导操作、诱导培养8–10 h,收集细胞、破碎细胞,直至制备出用于亲和层析纯化所需要的上清粗酶提取液等实验内容由教师或助教完成。学生可以现场观摩这部分的操作,或者由教师或助教将操作制作短视频,发给学生线上观看学习。
然后,学生可以从亲和层析纯化蛋白开始进行蛋白制备的实验操作。由于亲和层析法制备蛋白制备这一步是后续实验的基础,同时,Ni-NTA亲和层析法获得蛋白的技术也是化学生物学实验必备技能,重要且耗时较长,所以建议这一必选实验项目为8学时。
必选实验项目2为用SDS-聚丙烯酰胺电泳(SDS-PAGE)检测Cy-FBP/SBPase的纯度和大小,这是判断制备蛋白的质量及设计后续实验的关键环节,这一实验项目应设定为必选实验,耗时较长,建议6学时。
2个任选实验项目是从Braford方法测定蛋白质含量、底物浓度对Cy-FBP/SBPase酶活性的影响、金属离子对Cy-FBP/SBPase酶活性的影响、抑制剂对Cy-FBP/SBPase酶活性的影响等项目中任选2个实验项目作为实操实验项目,完成需要的相关实验操作,分析、讨论实验结果,提交实验报告。建议每个项目4学时,共8学时。如果学生能自己合成并表征抑制剂D7,从而对化学生物学综合实验会有更为完整的认识,凸显化学生物学交叉学科的特性,建议和有机合成组的教师进行协商,尽可能让有机合成实验项目和化学生物学实验项目相互衔接,让学生在有限的学习时间中获得更多的技能训练和能力提升。
剩余2未选的实验项目以说课形式展示实验原理、实验设计、预期的实验结果及分析实验结果的思路等,建议每个项目1学时,共2学时。
(3) 实验管理为开放式管理模式。以每组8名学生为单位,其中可以自由组合组成2人小组,学生可以根据自己的时间自主设计实验、安排实验项目的开始时间、实验进度及完成时间。教师对学生设计实验的合理性进行审核,实验采用预约制,以便实验教师提前统筹安排和协调,准备实验材料并进行指导,确保实验的顺利进行,及时解决实验中的问题。
(4) 多元化考核评价方式。在本实验进行过程中学生为主体,教师在每个环节进行必要的引导。考核评价方式采用过程评价和最终实验结果相结合,以及教师评价、小组互评及个人自评相结合的形式,全方位提高学生的实验能力、思维能力、表达能力、评价能力及团队精神。
7 结语
本综合设计实验以学科发展及专业人才需求为牵引,立足化学生物学科研前沿,结合化学学院本科三年级学生的知识背景、成长特点,将科研成果转化为本科教学实验项目,不断完善并充实本科实验教学内容,符合华中师范大学实验课程教学改革的基本思路。学生通过这一综合创新实验项目的训练,拓展思维视角,提高分析问题及解决问题的能力,提高综合运用知识的能力,为今后从事化学生物学科研活动及其他相关领域的研究工作奠定基础。这种将前沿科技成果、先进的科研理念及实验技术等转化为本科生高阶实验教学内容的科研与教学的交叉融合将有助于促进化学生物学本科实验教学课程的建设及完善。

