大豆和豆粕水提物致草鱼原代肝细胞损伤作用的研究
郁 浓 石瑶瑶 叶元土
(苏州大学基础医学与生物科学学院, 水产动物营养与饲料省重点实验室, 苏州 215123)
大豆具有蛋白含量高、消化率高和氨基酸结构相对平衡等营养优点, 被广泛应用于水产饲料中。然而, 大豆含有干扰鱼体健康状况的化学物[1],目前这些物质被归为抗营养因子。豆粕是大豆经浸提或预压浸提制油工艺的副产物, 脱溶和烘烤等处理可以部分去除一些热不稳定抗营养因子, 如胰蛋白酶抑制剂、凝集素和致甲状腺肿因子等[2], 已经有学者以豆粕基础日粮饲喂水产动物, 不仅会引起肠炎性疾病[3], 而且会导致肝脏组织病变和生理异常。例如, 在石首鱼的研究中证实了当日粮豆粕水平在44%以上时, 肝脏细胞核发生了偏移, 出现大量的脂质空泡[4]; 45%豆粕替代鱼粉能够破坏大黄鱼肝脏组织结构[5]; 16%豆粕替代鱼粉使凡纳滨对虾过度应激造成肝胰腺受损[6]; 我们实验室进行了不同比例豆粕含量日粮对草鱼肝胰脏结构与功能影响试验, 结果表明在日粮中添加60%豆粕能够引起草鱼肝胰脏代偿性增大[7], 肝胰脏的蛋白酶活力显著下降[8]。这种异常是由一种或几种抗营养因子, 例如皂甙、植物甾醇、寡糖和/或其他不明成分引起的[9—12]。目前文献报道主要是引起肠炎机制, 其毒性成分种类尚不明确, 肝毒性作用与抗营养因子是否具有相关性有待研究。
肝脏作为鱼类具代谢活性重要器官, 在营养物质的合成、转运、储存及外源物质的代谢等方面发挥重要作用[13,14]。采用体外培养草鱼原代肝脏细胞, 能够使代谢酶保持较高水平, 表现出完整的特异性功能, 是研究肝脏细胞体外代谢水平的较好模型[15]。在机体受到某些因子刺激时, 鱼体内过量的氧化物积累会对核酸、蛋白质组分和生物膜等重要大分子造成损伤[16]。线粒体被认为是产生活性氧的主要部位, 线粒体中过量的活性氧能够引起氧化应激, 增强细胞抗氧化系统的活性, 造成线粒体损伤, 甚至引起细胞凋亡[17]。营养物质作为一种信号, 肝细胞通过调节基因表达来改变代谢途径,使其达到稳态, 基因组学利用高通量方法研究肝脏的生理反应和植物性膳食成分适应性反应[18]。
本文利用草鱼肝脏分离的原代肝细胞为试验对象, 以大豆和豆粕的水提物为实验材料。在离体培养的肝细胞中定量加入不同剂量的水提物, 研究水提物对肝细胞活力和超微结构等的影响, 探讨大豆和豆粕水提物对肝细胞的损伤作用。采用RNAseq测序技术, 考察对肝细胞全基因表达谱的影响,阐明损伤作用的位点和机制等, 不仅提高了我们对鱼类肝细胞结构、代谢和免疫功能等方面的基本认识, 而且为修饰、消除或调节这些反应提供了潜在的靶点。
1 材料与方法
1.1 主要试剂与仪器
M199培养基(Hyclone, 美国)、胎牛血清(Gibco,美国)、胰蛋白酶(Gibco, 美国)、CCK-8(同仁化学,日本)、乳酸脱氢酶(Lactate dehydrogenase, LDH)、丙二醛(Malondialdehyde, MDA)、超氧化物歧化酶(Superoxide dismutase, SOD)、还原性谷胱甘肽(Glutathione, GSH)、线粒体膜电位检测试剂盒(南京建成)、Hoechst 33258染色液、活性氧(Reactive oxygen species, ROS)、可溶性糖试剂盒(碧云天)、Annexin V-FITC/PI凋亡检测试剂盒(联科生物)、CO2培养箱(HF 90/HF 240, Heal Force)、低速离心机、低速恒温振荡器、酶标仪(Gene Company Limited)、流式细胞仪(Beckman Coulter, 美国)、电子显微镜(型号: 120 kv HT-7700, 日立)。
1.2 SAE、SMAE的制备和成分分析
为了除去大豆中热敏感抗营养因子和脲酶对试验的影响, 模拟豆粕加工时温度[19], 故采用高温干热法去除脲酶, pH增值法进行检测脲酶活力, 当ΔpH<0.3时符合巴西豆粕质量指标。将热处理后的巴西大豆和同一批次巴西豆大豆生产的豆粕(均购于张家港中粮集团)粉碎并过60目筛, 分别称取等量豆粕和大豆, 均以1∶6(w/v)的比例加入蒸馏水, 在4℃冰箱中浸提24h, 不断进行搅拌; 真空抽滤后得到滤液, 冷冻干燥后得到水提物冻干粉, 将其置于–80℃保存以备后续使用。对冻干粉进行成分分析,测定其得率、水分、蛋白质、脂肪、灰分、可溶性糖及小肽含量。水分是105℃烘干至恒重下测定的。蛋白质含量测定采用凯氏定氮法(GB/T 6432-2018); 石油醚索式抽提24h后, 测定粗脂肪含量(GB/T 6433-2006); 气相色谱法对脂肪酸组成及含量进行测定; 550℃灼烧测定灰分含量; 高效液相色谱法(GB/T 22729-2008)测定肽组成和含量; 可溶性糖含量测定参照南京建成生物工程学院试剂盒说明书, 成分分析结果见表1。对大豆和豆粕冻干后的水提物进行了称重, 冻干前后干物质的浸出率分别为23.19%和18.86%。SAE和SMAE中存在的主要化合物是蛋白、碳水化合物和灰分, 2种样品在可溶性糖、蛋白和肽含量的相对含量上存在差异。
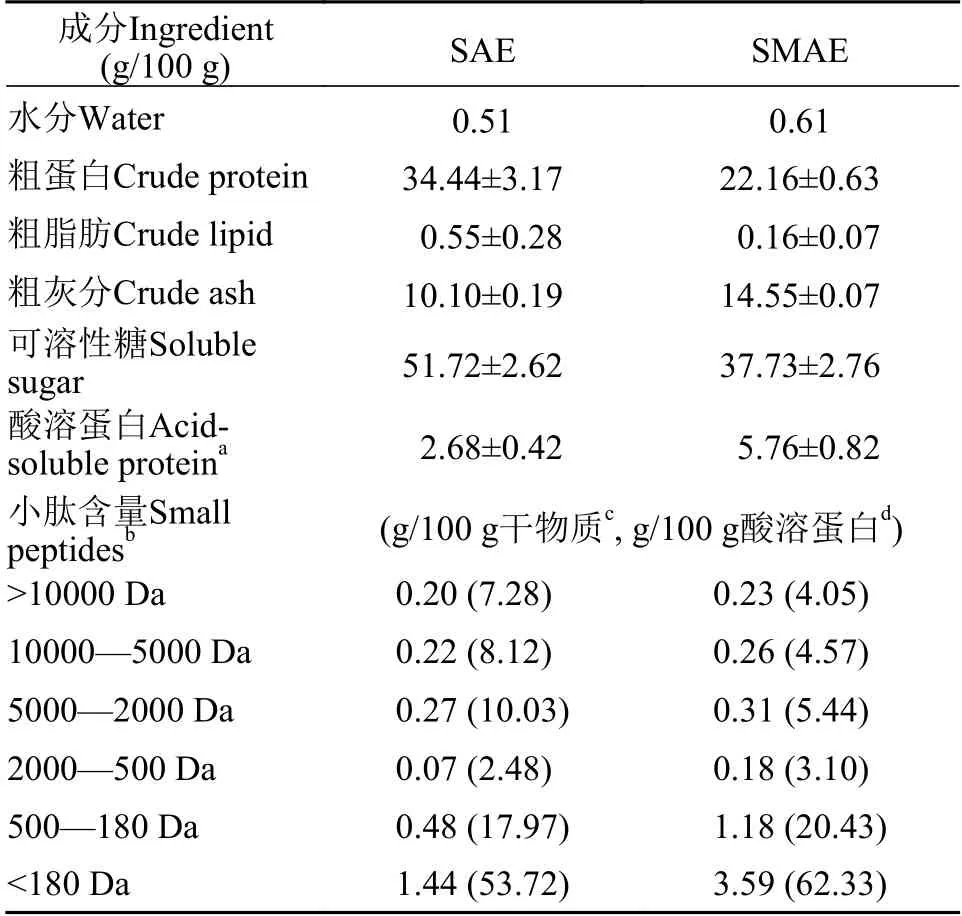
表1 SAE和SMAE的组成成分和小肽含量(g/100 g干物质)Tab. 1 Chemical compositions and peptides content of SAE and SMAE (g/100 g dry matter)
1.3 实验鱼的管理
实验草鱼平均体重为(15.0±5.0) g, 来自于苏州市吴江区水产技术推广站试验场, 为一冬龄鱼种。为了保障试验草鱼的生理健康, 将试验用草鱼暂养于苏州大学鱼类室内循环养殖系统中, 至少养殖2周以上, 每天投喂1次32%蛋白质和8%脂肪含量的草鱼膨化料, 养殖水体温度为(24.0±5.0)℃, 溶氧为(5.0±0.5) mg/L。
1.4 草鱼原代肝细胞的分离和培养
参考秦洁等[20]的组织块酶解法, 将实验草鱼浸泡在0.01%高锰酸钾溶液中30min, 用75%的酒精擦拭体表, 放入超净工作台中, 取出肝脏组织, 用预冷的D-Hanks试剂清洗, 将组织块剪切成1 mm3大小,加入3倍体积的0.25%胰酶放入振荡培养箱中低速振荡消化15min, 用70 μm细胞滤膜过滤组织块, 1000 r/min离心1min, 去除上清液。加入D-Hanks液和红细胞裂解液(1∶3)混合液以去除红细胞, 再进行离心(1000 r/min, 4min)去除上清液, 轻洗2次离心后得到肝细胞, 用台盼蓝对细胞进行染色检测, 活细胞的存活率>85%时进行后续试验。用M199培养基(15%胎牛血清、青霉素100 IU/mL、链霉素100 μg/mL和两性霉素0.25 μg/mL)重悬细胞进行计数, 调整细胞浓度后置于27℃、4.5% CO2的培养箱培养。
1.5 不同浓度水提物对草鱼原代肝细胞活力的影响
将上述方法获得的原代肝细胞(4×105个/孔)接种到96孔板中, 每孔100 μL。在培养24h后, 将SAE和SMAE用含5%胎牛血清的培养基稀释成不同浓度, 使SAE和SMAE在细胞培养液中的终浓度分别为0、0.5、2.5、5.0和10.0 mg/mL, 每个浓度至少设置6个复孔, 在培养箱中继续培养24h。采用CCK-8微板比色法检测细胞活力。方法为每孔加入10 μL CCK-8溶液, 培养箱孵育2h, 在450 nm波长下检测吸光度(OD值)。
1.6 透射电子显微镜检测细胞超微结构变化
收集对照组和5.0 mg/mL SAE、SMAE 组细胞数量为6×106个, PBS洗2遍, 弃上清, 用2.5%戊二醛作前固定, 1%锇酸作后固定, 梯度乙醇脱水后氧化丙烯浸透、环氧树脂包埋、制超薄切片, 切片在200目铜网上收集, 干燥24h, 用醋酸铀酰和柠檬酸铅双重染色, 在透射电镜下观察超微结构改变。
1.7 Hoechst 33285染色
Hoechst 33285是一种可以穿透细胞膜的非嵌入性荧光染料, 在染色体AT序列富集区域的小沟处与DNA结合, 在紫外光激发下可以发出亮蓝色荧光[21]。为了进一步观察细胞的凋亡特征, 使用荧光显微镜观察Hoechst 33258试剂染色后的细胞核形态。方法为PBS清洗细胞2遍, 在4%多聚甲醛固定后添加100 μL的 Hoechst 33258试剂, 避光孵育30min。PBS洗涤3次去除背景色, 在荧光倒置显微镜检测并拍照。
1.8 肝细胞相关抗氧化酶的检测
采用微板法测定上清中LDH活力, 450 nm波长下多功能酶标仪测定吸光光度值。采用可见分光光度计法检测上清中MDA的含量, 细胞内SOD和GSH按南京建成细胞专用试剂盒说明书处理, 分别在酶标仪450和405 nm处检测OD值。
1.9 Annexin V/PI双染检测细胞凋亡
肝细胞在含SAE和SMAE的培养基继续培养24h后, 收集板中所有细胞, 清洗后加入195 μL Annexin V-FITC轻轻重悬细胞, 依次加入5 μL Annexin VFITC、10 μL PI染色液, 轻轻混匀。避光孵育15min后置于冰浴中, 用流式细胞仪进行检测细胞凋亡百分比。统计每个样本中超过10000个细胞, 定量分析细胞凋亡率。
1.10 线粒体膜电位(MMP)检测
收集细胞重悬于0.5 mL细胞培养液中, 加入0.5 mL JC-1染色工作液, 颠倒多次混匀, 在27℃培养箱中孵育40min。染色结束后沉淀细胞, 用JC-1染色缓冲液洗涤2次, 重悬后用流式细胞仪进行分析。
1.11 ROS检测
加入荧光探针DCFH-DA于培养基中, 浓度为10 μmol/L, 27℃孵育细胞30min, 用胰酶消化细胞,加入培养基终止消化制成细胞悬液, 1000×g离心5min收集细胞, 用PBS洗涤2次, 再次离心收集细胞进行上机检测。
1.12 转录组分析
基于以上结果, 转录本选用的是对照组、5.0 mg/mL浓度下的 SAE组和SMAE组细胞进行分析。RNA的质量、完整性和纯度采用琼脂糖凝胶电泳法和分光光度计法。由上海美吉生物医药科技有限公司进行RNA-seq测序, 采用 Illumina HiSeq测序平台完成转录组测序, 构建Illumina PE文库(**bp)进行2×150 bp测序, 对获得的测序数据进行质量控制,利用生物信息学手段对转录组数据进行分析。
1.13 数据处理和分析
所有值均以至少3个批次独立实验的平均值±标准差表示。实验用SPSS 22.0统计分析软件进行单因子方差分析(One-way ANOVA), 组间差异显著性用Duncan氏多重比较进行分析(Duncan’s multiple range test)。用GraphPad软件(GraphPad Prism 6.0)进行统计检验和图形绘制。P<0.05表示显著差异, P<0.01表示极显著差异。
2 结果
2.1 SAE和SMAE对草鱼原代肝细胞活力的影响
如图1所示, 在细胞培养液中加入SAE和SMAE后, 细胞相对活力下降。0.5和2.5 mg/mL浓度下的 SAE和SMAE组细胞相对活力与空白对照组相比无显著性差异。5.0和10.0 mg/mL的 SAE剂量组相对细胞活力与浓度呈现负相关, 细胞活力分别为(78.10±8.57)%和(65.97±7.35)%, 与对照组相比具有极显著差异(P<0.01)。与之相同, 同剂量的SMAE组细胞相对活力分别为 (86.35±7.17)%和(80.26±7.08)%。

图1 CCK-8法检测相对细胞活力Fig. 1 Primary hepatocytes viability assessed by CCK-8 assay
2.2 肝细胞超微结构变化
如图2所示, 正常组肝细胞核呈现圆形或椭圆形, 双层膜结构清晰可见, 核仁位于核中央, 大而清晰, 细胞质均匀分布, 胞质内细胞器和内含物丰富,线粒体特别发达, 呈圆球形、椭圆形、弯月形、球杆状或长杆状, 内有清晰的细管状嵴, 粗面内质网,常呈层状排列, 膜表面有核糖体分布(图2A和2B)。相比之下, SAE组(5.0 mg/mL)细胞的内质网与线粒体数量减少, 且肿胀现象明显。肝细胞内聚集了大小不一的大脂滴(图2C和2D)。SMAE组(5.0 mg/mL)细胞超微结构发生了改变, 包括核染色质沿核膜的环状凝结、稀疏的光密度、胞质、线粒体肿胀和数量的减少、内质网的肿胀(图2E和2F)。上述结果表明, SAE和SMAE均能导致肝细胞微观结果的显著性改变, 主要的变化在细胞核和线粒体的微观结构。
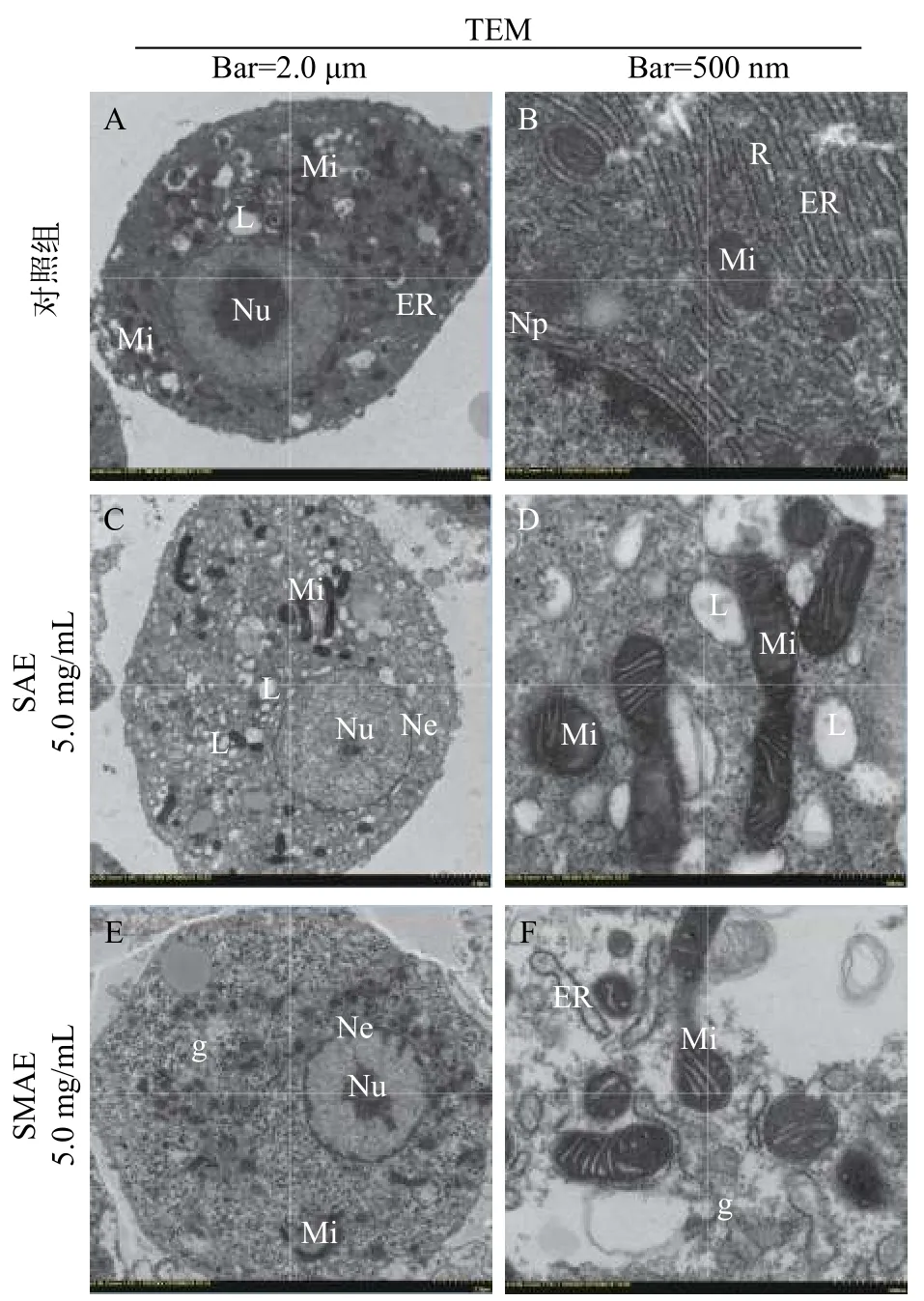
图2 肝细胞超微结构观察Fig. 2 Ultrastructural observation of Hepatocytes
2.3 Hoechst 333258染色
选用5.0 mg/mL浓度组的 SAE和SMAE组肝细胞被Hoechst 33258染色, 如图3所示, 荧光显微镜下可见对照组细胞大小一致, 形状为圆形, 且亮度均一。经水提物培养后的细胞蓝色荧光强度减弱, 核缩小, 形态不规则, 边缘模糊, 可见少量的核碎片,染色不均匀(染色质凝集), 染色质边缘化等形态变化。

图3 Hoechst 333258荧光染色观察细胞核形态变化Fig. 3 Nuclear morphological changes were observed by hoechst 333258 fluorescent staining
2.4 SAE、SMAE对草鱼原代肝细胞抗氧化相关酶活力的影响
图4A显示的是细胞上清液LDH含量的变化,可作为评价细胞损伤的指标。0.5 mg/mL浓度下的SAE组和0.5、2.5 mg/mL浓度下的SMAE组细胞上清液中LDH含量较低, 与对照组相比无显著性差异, 2.5 mg/mL SAE组细胞外液LDH与对照组相比有显著性差异(P<0.05), 在两组高剂量浓度(5.0和10.0 mg/mL)下, 细胞释放到培养液中的LDH含量与对照组相比差异极显著(P<0.01)。如图4B所示,两组细胞上清液的MDA含量趋势呈现上升状态(P<0.01)。如图4C和4D所示, 与对照组相比, 当SAE和SMAE添加量为5.0和10.0 mg/mL时, 还原型谷胱甘肽(GSH)含量差异极显著(P<0.01), 且SOD活性与对照组相比均有显著差异(P<0.01)。在同浓度下, SAE组细胞上清液中LDH和MDA含量高于SMAE组, 抗氧化酶活力低于SMAE组。
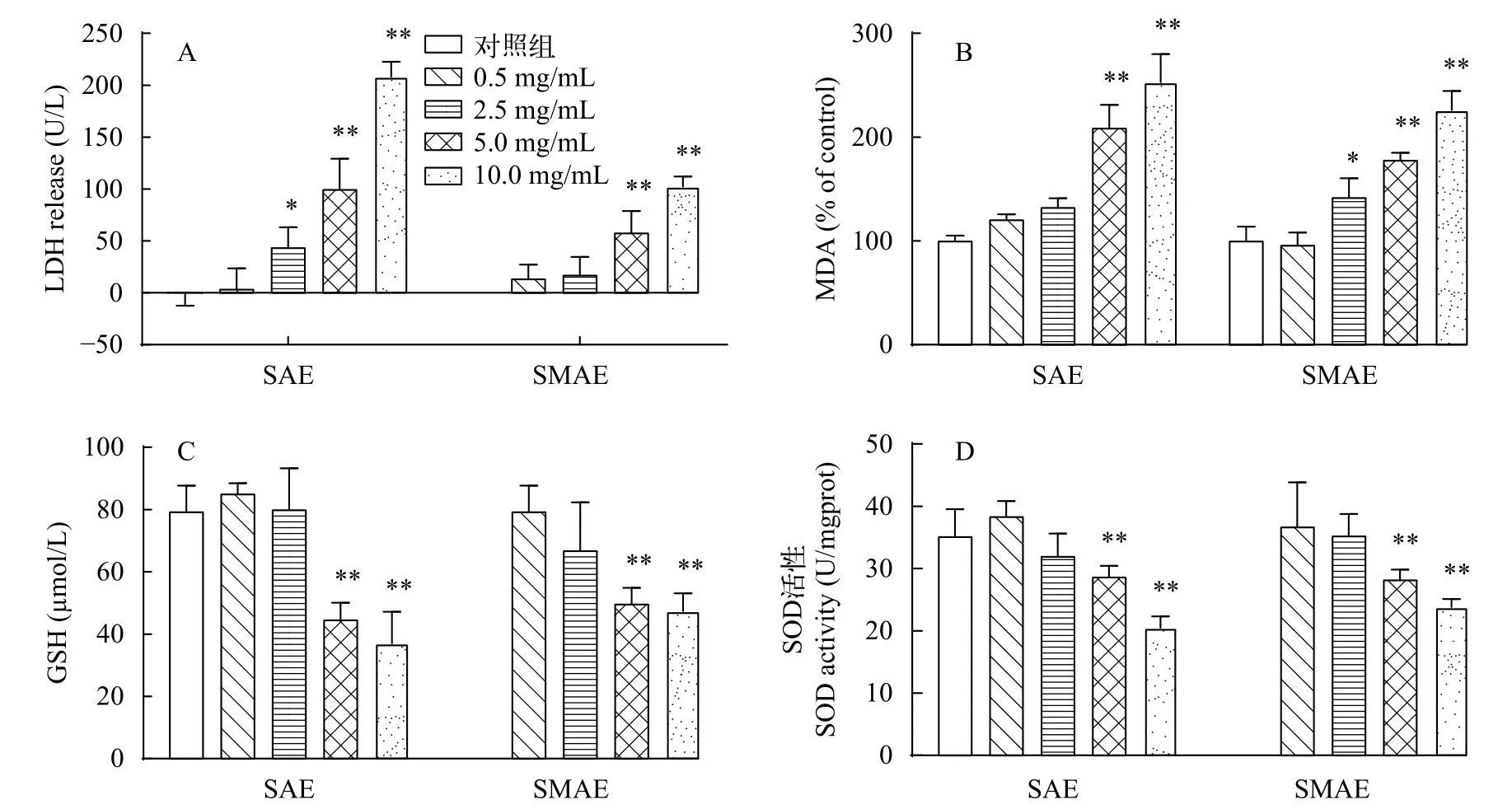
图4 SAE和SMAE对草鱼原代肝细胞抗氧化酶活性的影响Fig. 4 Effects of SAE and SMAE on antioxidant enzyme activity in primary hepatocytes of grass carp
2.5 SAE和SMAE诱导肝细胞凋亡
对细胞凋亡分析结果如图5所示, 随着水提物浓度的升高, 细胞早期凋亡率升高。低剂量组(0.5和2.5 mg/mL)与对照组的凋亡比没有显著性差异, 5.0和10.0 mg/mL浓度SAE组凋亡率为(22.55±4.35)%和(55.03±2.76)%, SMAE组的凋亡率分别为(32.67±5.79)%和(37.11±8.57)%, 均与对照组相比有极显著差异(P<0.01)。该实验结果表明, 水提物继续培养24h会诱导草鱼的肝脏细胞发生凋亡, 凋亡细胞数量呈剂量依赖性增加。
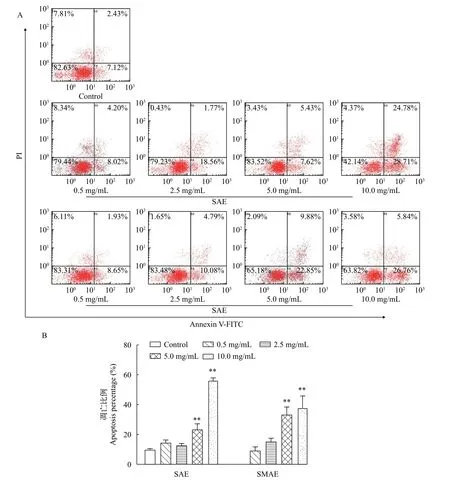
图5 SAE和SMAE对草鱼原代肝细胞凋亡的影响Fig. 5 Effects of SAE and SMAE on the apoptosis of primary hepatocytes in grass carp
2.6 SAE和SMAE诱导肝细胞线粒体损伤
流式细胞术检测结果显示(表2), 实验组细胞内平均荧光强度显著高于对照组(P<0.01), SAE和SMAE (5.0和10.0 mg/mL)培养肝细胞24h后, 可升高细胞内ROS水平。线粒体通过内在途径在细胞凋亡中发挥关键作用, 细胞膜电位的改变是诱导细胞凋亡的关键, 与对照组相比, SAE组(2.5、5.0和10.0 mg/mL)和SMAE组(5.0和10.0 mg/mL) MMP较对照组有不同程度的下降(P<0.05, 表3)。

表2 SAE和SMAE对原代肝细胞活性氧(ROS)形成的影响Tab. 2 Effects of SAE and SMAE on ROS formation in primary hepatocytes
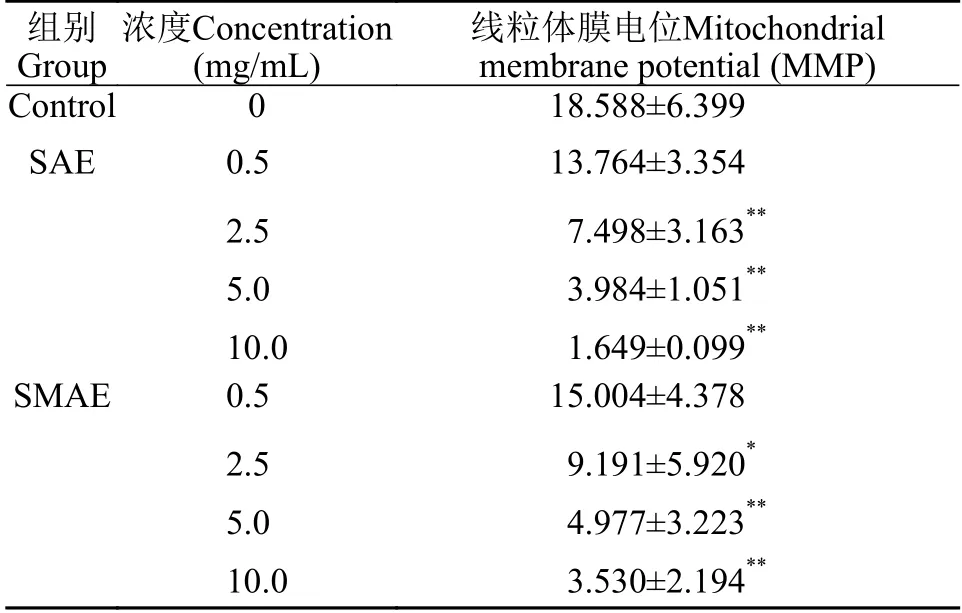
表3 SAE和SMAE对原代肝细胞线粒体膜电位(MMP) 的影响Tab. 3 Effects of SAE and SMAE on MMP in primary hepatocytes
2.7 基因差异表达和通路分析
对照(Con)组、5.0 mg/mL浓度下的 SAE组和SMAE 组细胞培养24h后肝细胞转录组中对照组和处理组分别采用TPM(Transcripts Per Million reads)计算方法计算各个基因表达量, 默认参数: p-adjust<0.05、|log2FC| ≥1, 即具有统计学意义, 对部分DEGs进行整理结果见表4。如图6所示, SAE组与Con组相比共有上调基因337个, 下调基因532个;SMAE组与Con组相比共有上调基因440个, 下调基因1011个。将筛选所得的DEGs分别从生物学过程(Biological process, BP)、分子功能(Molecular function, MF)和细胞成分(Cellular component, CC) 三个层面进行GO功能富集, 并采用KEGG通路分析研究DEGs可能参与调控的相关信号通路。

图6 SAE和SMAE引起原代肝细胞差异表达火山图和各组DEGs韦恩图Fig. 6 SAE and SMAE induced differential expression of primary hepatocytes in volcanic and DEGs Venn diagrams
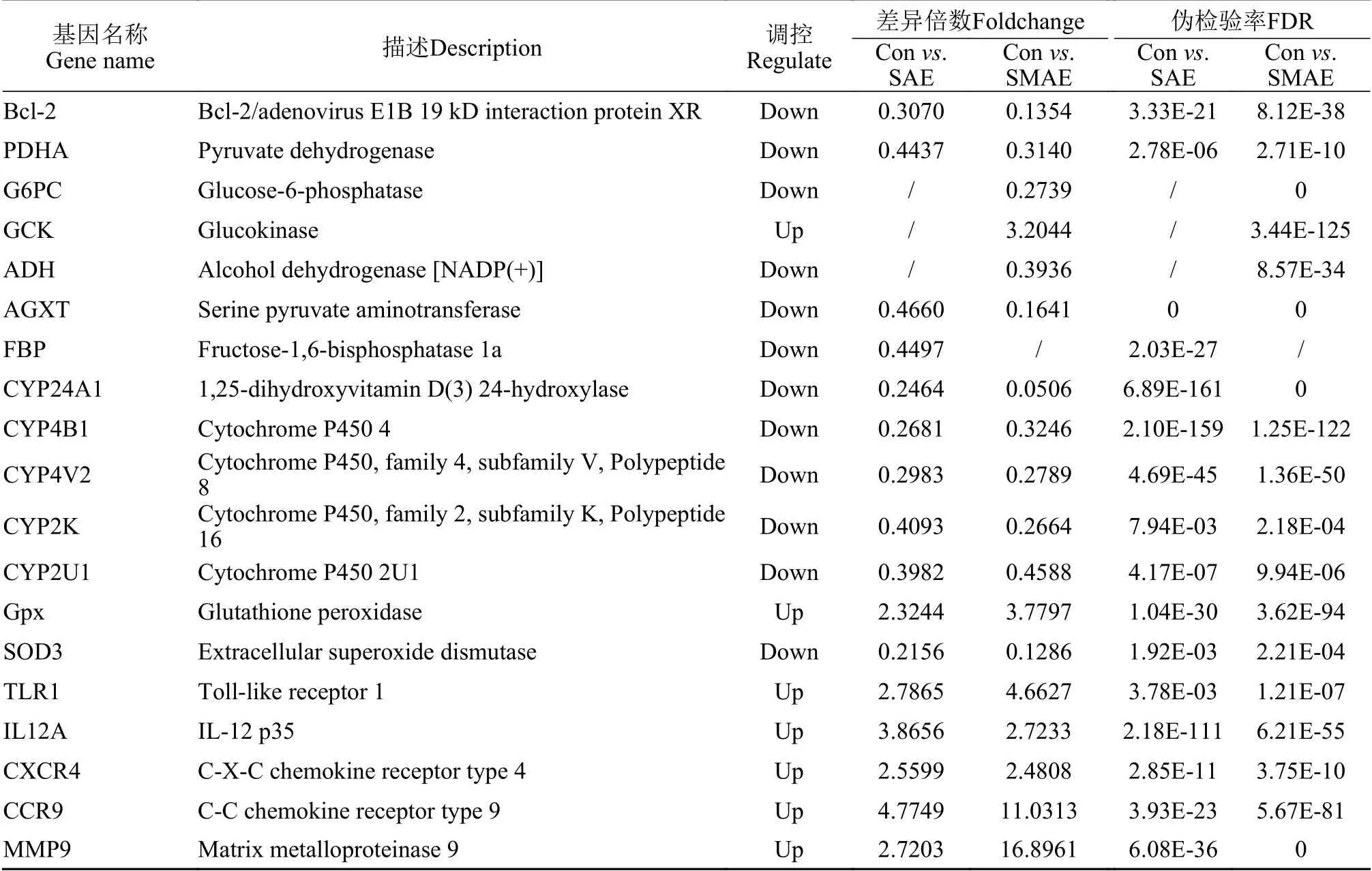
表4 差异表达基因列表Tab. 4 List of differentially expressed genes
由图7可见, Con组与SAE组相比, 可显著富集TOP15条途径, BP Term包括蛋白水解负调控(Negative regulation of proteolysis)、水解酶活性的负调控(Negative regulation of hydrolase activity)、肽酶活性的负调控(Negative regulation of peptidase activity)、细胞内脂类代谢(Cellular lipid metabolic process)和类异戊二烯代谢过程(Isoprenoid metabolic process)等。CC Term主要与细胞外空隙(Extracellular space)有关。所富集到的MF Term主要和肽酶抑制剂活性(Peptidase inhibitor activity)、肽链内切酶调节活性(Endopeptidase regulator activity)和肽酶调节活性(Peptidase regulator activity)有关。Con组与SMAE组相比, 主要涉及氧化还原过程(Oxidation-reduction process)、催化活性的负调节(Negative regulation of catalytic activity)、内肽酶活性的负调控(Negative regulation of endopeptidase acti-vity)、水解酶活性的负调控(Negative regulation of hydrolase activity)等BP Term。在CC Term中主要与细胞外区域部分(Extracellular region part)有关,在MF Term中, DEGs主要集中在氧化还原酶活性(Oxidoreductase activity)、酶抑制剂的活性(Enzyme inhibitor activity)及肽酶调节。
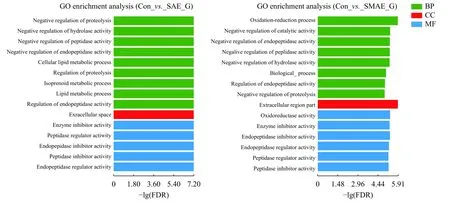
图7 SAE和SMAE引起原代肝细胞DEGs GO富集分析Fig. 7 SAE and SMAE caused DEGs GO enrichment in primary hepatocytes
对KEGG通路富集分析, DEGs可显著富集到20条信号通路。如图8所示, 影响最大的是补体和凝血级联, 其次为甾体生物合成、PPAR信号通路、细胞因子的相互作用、脂肪消化和吸收、甘氨酸、丝氨酸和苏氨酸代谢、萜类骨架生物合成和甘油三酯代谢等, 这些通路可能作为SAE引起肝细胞损伤的发生机制。SMAE组肝细胞显著富集到30条信号通路, 影响最大的是补体和凝血级联, 其次是细胞因子的相互作用、甘氨酸、丝氨酸和苏氨酸代谢、甘油三酯代谢、NF-κB信号通路、TNF信号通路、谷胱甘肽代谢、糖酵解/糖异生和细胞色素P450等。这些结果提示, SAE可能更多的是通过诱导蛋白质与脂质代谢异常, 参与氧化应激过程, 进一步导致肝细胞炎症和坏死的发生。

图8 SAE和SMAE引起原代肝细胞DEGs KEGG富集分析Fig. 8 SAE and SMAE caused DEGs KEGG enrichment in primary hepatocytes
3 讨论
3.1 SAE、SMAE诱导原代肝细胞线粒体途径凋亡
肝细胞凋亡是肝损伤和癌变的机制之一。诱导细胞凋亡的途径很多, 线粒体凋亡途径是脊椎动物的主要生理凋亡途径[22]。线粒体是细胞能量代谢中心, 线粒体动力学被认为在维持细胞内环境稳定方面具有重要的生理作用[23]。线粒体结构异常和功能障碍是坏死的基本特性, 伴随着线粒体膜通透性的改变, MMP的降低, Bcl-2家族中的促凋亡蛋白成员发生蛋白质的加工修饰, 易位到线粒体的外膜上, 引发级联反应, 最终触发细胞凋亡[24]。
SAE和SMAE 能够诱导肝细胞超微结构改变,结合Hoechst染色结果, 包括细胞核凝结和核破碎,光密度稀疏, 线粒体数量减少和肿胀现象明显, 出现大量脂滴堆积等。SAE和SMAE能降低肝细胞线粒体膜电位。与对照组相比, 各浓度水平SAE组细胞MMP水平分别为74.02%、40.34%、21.43%和9.87%, 而SMAE组中MMP水平仅略有升高。线粒体内膜的通透性屏障造成ATP合成功能障碍, 影响细胞活力。糖代谢过程与细胞能量供给密切相关,在糖酵解过程、三羧酸循环通路中, 葡萄糖激酶(GCK)表达上调, 丙酮酸脱氢酶基因(PDHA)、果糖-6-磷酸(G6PC)、乙醇脱氢酶(ADH)、果糖-1, 6-二磷酸(FBP)、丝氨酸-丙酮酸转移酶(AGXT)表达受到抑制, 不仅糖的合成、降解受到了阻碍, 而且能量供应出现障碍。其中AGXT在线粒体和过氧化物酶体中具有双重代谢调节作用[25]。
在大西洋鲑的日粮中豆粕含量的升高会引起肠上皮细胞凋亡数量增加, 远端肠体指数下降[10],及形态学的改变[26], 同样在Wistar大鼠的研究中发现, 饲喂过生大豆的鼠小肠黏膜内肠上皮细胞损伤最高[27]。通过流式细胞术检测10.0 mg/mL SAE组肝细胞凋亡百分比, 达到(55.03±2.76)%, SMAE组的凋亡百分比达到(37.11±8.57)%, 与对照组相比均有显著差异(P<0.01), Bcl-2基因显著下调, 表明水提物能够引起原代肝细胞凋亡。
3.2 SAE和SMAE引起原代肝细胞氧化损伤
ROS是指所有需氧细胞在一系列代谢反应和各种刺激物作用下产生的副产物[28]。线粒体被认为是ROS产生的主要场所, 这是在有氧条件下内源性的、连续的生理过程。线粒体呼吸链是由超氧阴离子歧化产生ROS的主要来源, 同时也是ROS破坏作用的重要靶点[29]。
在本研究中, SAE和SMAE在5.0 mg/mL浓度下诱导细胞内ROS过量产生, 说明草鱼原代肝细胞表现出氧化应激。通过对细胞相关酶活力检测发现,细胞上清液中LDH和MDA水平明显升高, 细胞内液中抗氧化酶(SOD和GSH)活性明显低于正常对照组(P<0.01), 反映肝细胞膜损伤, 导致脂质氧化, 抗氧化酶系统受损, 促进细胞炎性反应。肝细胞转录组结果显示细胞色素P450相关基因(CYP24A1、CYP4B1、CYP4V2、CYP2K和CYP2U1)参与外源性物质的氧化代谢, 参与NADPH依赖的电子传递途径[30]。谷胱甘肽过氧化物酶以还原型谷胱甘肽为电子供体底物, 催化过氧化氢或有机过氧化物还原成水或相应的醇[31], 谷胱甘肽过氧化物酶(Gpx)基因表达上调, 超氧化物歧化酶(SOD3)基因表达水平显著下降, 表明SAE和SMAE能致肝细胞氧化损伤。
3.3 豆粕中对肝细胞损伤的物质来自于大豆
豆制品作为重要的膳食蛋白来源, 在人类和动物中得到了广泛的应用。但是, 大豆中生物活性物质的高含量使它成为一种需要关注的膳食补充剂[32]。这些物质在鱼类体内不能正常代谢, 可引起一系列主要与消化生理、健康和代谢相关的作用, 导致肠黏膜屏障受损, 增加物质对肝脏的通透性, 进而引起代谢和免疫反应[33]。有研究表明, 在30%大豆营养胁迫下, 通过大西洋鲑的转录组水平发现, 补体级联反应和肉碱O-棕榈酰转移酶基因显著上调, 通过合成辅酶A参与脂肪酸的氧化, 肝脏接近酮体状态, 表明大豆诱导的营养胁迫对鱼类肝脏反应的不利影响[18]。
本研究中转录组结果显示, 对肝细胞影响最大的是补体和凝血级联反应。白细胞介素IL-12由p35和p40亚基组成, 促进细胞免疫和炎症反应, 在本研究中, Toll样受体1(TLR1)基因和IL12A基因表达上调。当肝细胞受到水提物中危害成分损伤刺激后, 触发TLR1介导的获得性免疫, 导致大量的炎症细胞因子产生, 同时伴随着中性粒细胞激活(CXCR4和CCR9基因上调), 分泌产生细胞外基质, 基质金属蛋白酶9 (MMP9)表达上调, 降解细胞外基质,引起肝细胞免疫反应, 加重肝细胞损伤。这些结果表明, 豆粕能够对鱼类免疫机能和生理健康产生负面影响。
Gupta等[34]研究发现0.4%(w/v)大豆蛋白水解物(60%肽/氨基酸和20%碳水化合物)能够促进仓鼠卵巢(CHO)细胞生长。而大豆异黄酮染料木素促进人和大鼠乳腺上皮细胞和仔猪肝细胞凋亡[35,36]。大豆凝集素能够降低猪肠柱状上皮细胞整合素的表达, 从而诱导细胞凋亡[37]。有研究表明, 大豆中的Glyceollins能够通过MMP去极化引起小鼠肝癌细胞凋亡[38]。大豆作为一个复杂的组成系统, 其对体外培养细胞的影响尚未得到全面的综述。通过化学成分分析结果显示, SMAE的可溶性糖含量下降, 小肽含量升高, 这都与加工相关, 在脱脂热处理的过程中可能发生了一些成分的改变(化学修饰反应)[39]。水提物中含有引起草鱼肝细胞氧化损伤的物质, 且这类物质来自于大豆自身的组成物质。SAE和SMAE 引起的肝细胞损伤可能有多种途径, 试验结果表明, ROS介导的线粒体可能是大豆诱导原代肝细胞氧化应激和凋亡的重要途径之一。
4 结论
本文研究结果表明, 在大豆和豆粕的水提物中存在有对草鱼原代离体肝细胞损伤的物质, 且豆粕水提物中损伤物质是来源于大豆而不是大豆生产豆油和豆粕的过程中。氧化损伤为主要作用方式,能够影响肝细胞核与线粒体的结构和功能, 损伤作用的路径为: 对细胞代谢产生干扰, 细胞内ROS增加、抗氧化能力下降, 细胞核与线粒体结构和功能改变, 并导致细胞活力显著下降, 最终引起细胞凋亡。虽然本文分析了部分营养物质成分和含量, 但具体的损伤物质种类还有待分析和鉴定, 这是一个更为细致和长期的研究工作。

