miR-202-5p在牙鲆性腺中的表达分析及其与cbx2靶向关系验证
申峰峰 晁青何 黄沁怡 张俊玲,
(1. 上海海洋大学农村农业部淡水水产种质资源重点实验室, 水产种质资源发掘与利用教育部重点实验室,水产动物遗传育种中心上海市协同创新中心, 上海 201306; 2. 青岛海洋科学与技术国家实验室,海洋渔业科学与食物产出过程功能实验室, 青岛 266071)
性腺发育是行有性生殖动物繁殖的基础, 也是复杂而高度有序调控的过程, 主要由大量时期差异性表达的基因在转录和转录后水平调控[1]。microRNAs(miRNAs)是一类长度约为21—23 nt的内源性单链小分子RNA。越来越多的研究表明,miRNAs通过与其作用的靶基因3′UTR区结合在转录后水平调节基因表达, 进而在性腺发育中发挥重要的调控作用[2—4]。近年来, 一系列与性腺发育相关的miRNAs相继被发现, 如miR-34c、miR-122a、miR-449a、let-7e、miR-20、miR-106a和miR-202等[5—10]。其中, miR-202-5p是一种在哺乳动物和低等脊椎动物的性腺中大量表达的miRNA。在小鼠中, miR-202-5p在睾丸中表现出特异性的高表达[11];而在人类中, 与正常男性相比, 不育男性睾丸中的miR-202-5p表达量降低了17倍[12]。miR-202-5p在非洲爪蟾(Xenopus laevis)和大西洋比目鱼(Hippoglossus hippoglossus)的未成熟或成熟精巢中也表现出特异性的高表达[13,14]; 在斑马鱼(Dnaio rerio)中,miR-202-5p在精巢中特异性高表达, 且在精原细胞和精母细胞中的表达高于精子细胞和精子, 但在卵巢的生殖细胞中几乎不表达[15]。尽管miR-202-5p在物种间的表达模式已有较多研究, 但对miR-202-5p作用的下游靶基因的研究还十分有限, 对其靶基因的鉴定将对研究miR-202-5p在脊椎动物性腺发育中的功能起到重要的推动作用。
研究发现色素框同源蛋白2(Chromobox homolog 2, CBX2)是多梳蛋白家族(Polycomb group, PcG)的关键成员之一[16]。PcG是一类保守的蛋白家族,主要针对一系列与细胞分化、发育相关的基因, 在染色质水平上进行表观遗传修饰, 从而达到基因沉默的作用[17]。M33/cbx2缺失的小鼠雌雄性腺均表现出发育不良的现象, 甚至会出现性反转[18]。在人类中,cbx2突变也会导致类似的性反转现象[19]。功能分析发现,cbx2突变后将不能与下游靶基因正确结合, 并会结合到不同的序列之上, 丧失对sf1等下游靶基因的调控作用, 进而不能充分调节性腺发育所必需的靶基因的表达[20], 从而造成性腺不能正常发育或性反转, 表明cbx2可能通过调节性腺发育相关基因的表达在脊椎动物性腺发育过程中发挥作用。
牙鲆(Paralichthys olivaceus)是我国重要的经济海水养殖鱼类之一, 与其他硬骨鱼类的性腺发育时期划分相似, 牙鲆性腺发育可以分为Ⅰ—Ⅵ期[21,22]。与牙鲆性腺相关的miRNAs已有一些报道, 但多集中于表达模式的研究[23,24], 而对miRNAs及其靶基因在性腺中的作用研究则鲜有报道。本实验室长期围绕miRNAs在牙鲆性腺分化与发育中的作用机制开展研究, 通过精卵巢miRNAs高通量测序发现miR-202-5p在牙鲆性腺中具有丰富的表达。为进一步探讨其在牙鲆性腺中的功能, 本研究采用荧光定量PCR确认了miR-202-5p在牙鲆中的组织表达分布, 利用原位杂交技术观察了其在精巢和卵巢中的定位表达, 并运用生物信息学和双荧光素酶报告基因实验鉴定了miR-202-5p与潜在靶基因cbx2的靶向关系, 期望为揭示miR-202-5p在鱼类性腺发育中的功能与调节机制奠定基础。
1 材料与方法
1.1 实验材料
本研究所用10月龄和12月龄牙鲆来自于中国水产科学研究院北戴河中心实验站, 无菌解剖获取精巢、卵巢、脑、心脏、肝脏、肾脏、肌肉和肠等组织样品, 经焦碳酸二乙酯处理水冲洗干净, 置于TRizol(Invitrogen, 美国)中匀浆, 用于总RNA提取;另取牙鲆精巢和卵巢组织, 用PBS洗涤后, 立即置于4%的多聚甲醛中固定24h, 用于组织切片制备。
1.2 Real-time PCR
首先采用TRizol法提取上述各组织中的总RNA, 然后分别使用miRcute miRNA first-strand cDNA Synthesis kit(天根, 中国)和PrimeScriptTMRT reagent Kit with gDNA Eraser (Perfect Real Time,TaKaRa, 日本)进行反转录, 合成cDNA的第一条链,分别用于后续miRNA和mRNA的荧光定量实验。使用Primer5.0设计牙鲆miR-202-5p和内参基因18S RNA的定量引物(表1)进行荧光定量实验。

表1 本实验所用引物Tab. 1 Primers used in this experiment
Real-time PCR反应在CFX96 Touch real time(Bio-Rad, 美国)上进行。根据miRcute miRNA qPCR detection kit(天根, 中国)进行miR-202-5p的荧光定量PCR, 总反应体系为20 μL: cDNA模板1 μL, 上下游引物各0.4 μL, SYBR Green 10 μL及8.6 μL灭菌水。PCR扩增程序为: 95℃, 20s; 60℃, 34s; 进行39个循环反应, 并添加溶解曲线。内参18S RNA基因的荧光定量PCR的反应总体系为20 μL: cDNA模板1 μL, 上下游引物各1 μL, TB Green Premix ExTaqTMII(TaKaRa, 日本)10 μL及7 μL灭菌水。PCR扩增程序为: 95℃, 10s; 60℃, 30s; 进行39个循环反应, 并添加溶解曲线。定量结果采用2–ΔΔCt法计算,获取miR-202-5p在牙鲆各组织中的相对表达水平,在SigmaPlot 12.5软件上进行数据分析及作图, 用Spass 24进行组间显著性分析, 当P<0.05时视为具有显著性差异。
1.3 石蜡切片制备与原位杂交分析
将上述固定的牙鲆精巢和卵巢组织样品使用70%—80%—90%—100% Ⅰ—100% Ⅱ酒精进行梯度脱水, 再经过1/2二甲苯+1/2无水乙醇-二甲苯Ⅰ-二甲苯Ⅱ逐级进行透明, 最后用石蜡进行透蜡和包埋, 制作石蜡切片。为了验证切片的时期和完整性,首先对切片进行HE染色, 并将验证好的切片保存起来, 用于后续的原位杂交实验。
用上述验证过的精、卵巢切片进行原位杂交实验。通过与miRBase V20.0数据库对比发现, 牙鲆miR-202-5p与斑马鱼miR-202-5p完全保守, 因此,牙鲆miR-202-5p探针及原位杂交检测试剂盒采购自丹麦Exiqon公司,vasa探针合成如下: 使用Primer5.0设计牙鲆生殖细胞标记基因vasa探针合成所需引物(表1), 将片段大小为846 nt的vasa的cDNA片段插入到pGEM-T载体中。根据RNA Labeling kit(罗氏, 瑞士)的说明书, 用spel或sphl将重组质粒线性化, 以转录DIG标记的反义或正义探针。合成探针用DNaseI(赛默飞, 美国)孵育, 并加入LiCl在–80℃沉淀2h。原位杂交基本过程如下: 组织切片脱蜡,水化, 于胃蛋白酶消化20min, 漂洗后, 55℃预杂交3h, 地高辛标记的miR-202-5p探针和vasa探针恒温杂交过夜, 洗涤后封闭1h, 于抗体中孵育过夜, 洗涤后加NBT/BCIP室温避光显色30min。使用正置光学显微镜(尼康, 日本)对原位杂交结果进行拍照并记录。
1.4 生物信息学方法预测miR-202-5p的靶基因
本研究根据已筛选获得的miR-202-5p的成熟序列及NCBI中牙鲆cbx2基因3′UTR序列, 采用RNAhybrid (https://bibiserv.cebitec.uni-bielefeld.de/rnahybrid/)软件预测候选靶基因cbx2的3′UTR与miR-202-5p的种子序列的结合位点。
1.5 双荧光素酶报告基因重组载体构建与酶切鉴定
根据牙鲆cbx2基因3′UTR序列, 使用Primer5.0设计候选靶基因cbx2双荧光素酶报告基因载体构建引物(表1)进行重组载体构建, 以牙鲆精巢cDNA为模板, 进行PCR扩增出上述候选靶基因的3′UTR片段。反应体系如下: cDNA 1 μL、2×TaqPCR Master Mix酶10 μL、上下游引物各1 μL、ddH2O补至20 μL。PCR反应程序如下: 95℃预变性3min,95℃变性10s, 60℃退火20s, 72℃延伸50s, 共35个循环。在反应完成后, 将PCR产物进行1%凝胶电泳检测, 在凝胶成像仪上, 将目的条带快速切下, 并使用胶回收试剂盒进行纯化回收。将回收的目的产物连接到pMD19-T Vector上, 16℃连接16h后转化到感受态细胞中, 随后进行蓝白斑筛选, 挑取单克隆菌落进行扩大培养, 经菌液PCR验证后选取阳性克隆送往上海生工生物工程公司测序。
将加有酶切位点的cbx2 3′UTR的质粒与pmir-GLO载体分别用XbaⅠ和SacⅠ限制性内切酶(NEB,美国)进行双酶切。分别回收目的产物, 并使用T4 DNA连接酶过夜连接, 转化到感受态细胞中, 蓝白斑筛选, 提取质粒后, 经双酶切和测序验证后, 将构建成功的重组质粒命名为pmir-GLO-cbx2。
1.6 细胞培养与转染
本研究所用miR-202-5p mimics购自上海吉玛基因。采用双荧光素酶报告基因检测技术对上述预测的候选靶基因进行鉴定, 具体步骤如下: 将状态良好的293T细胞接种于24孔板中, 并于10%-FBS培养基中培养, 待细胞密度达到70%左右进行转染。将1 μg重组质粒和12 pmol的miR-202-5p mimics、negative control mimics和1 μL lipofectamineTM3000 reagent转染试剂分别用不含FBS和抗生素的细胞培养基稀释到100 μL(n=3), 将混合液充分混匀, 孵育15min, 分别将混合液加入相应孔内,6h后更换新鲜培养基, 于37℃, 5%CO2环境中继续培养24h, 空白组仅添加1 μg 重组质粒DNA, 不添加miR-202-5p mimics和negative control mimics, 其余处理方式与上述实验组相同。荧光素酶活性检测根据Dual-Luciferase®Reporter Assay System说明书进行, 记录Firefly Luciferase与Renilla Luciferase比值(n=3), 用 SigmaPlot12.5软件作图, 用One-Way方差分析(ANOVA)检验各组数据的显著性差异, 当P<0.05 时视为差异显著。
2 结果
2.1 miR-202-5p在牙鲆不同组织中的表达分布
采用荧光定量PCR检测了miR-202-5p在牙鲆不同组织中的表达情况。结果显示, miR-202-5p在牙鲆性腺组织中表达丰富, 尤其是在精巢中的表达量最高, 卵巢次之, 而在其他组织中的表达量非常低(图1,P<0.05)。
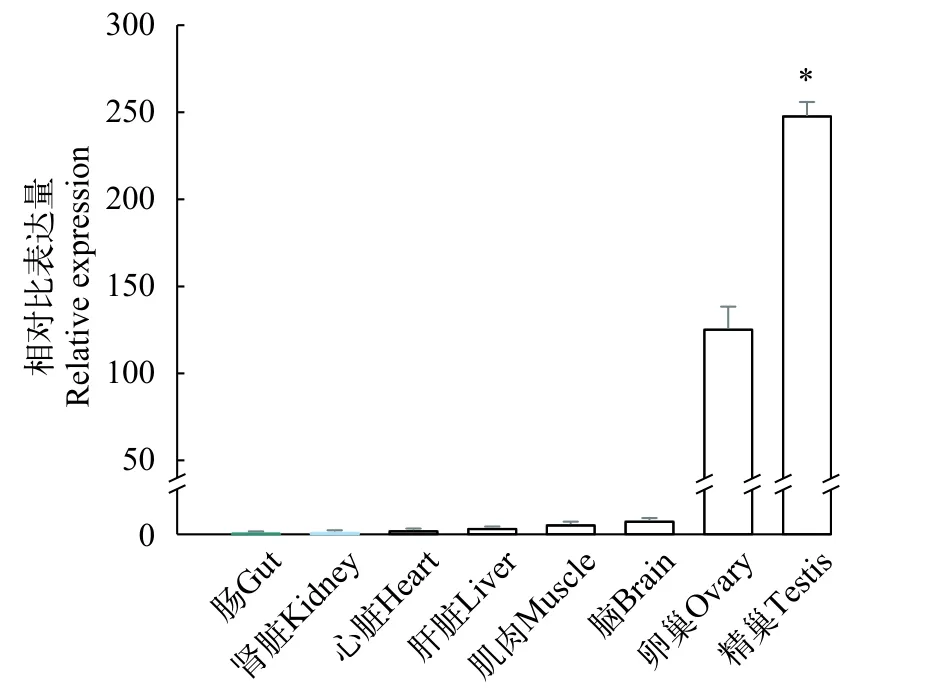
图1 miR-202-5p在牙鲆不同组织中的表达分析Fig. 1 The expression level of miR-202-5p in Japanese flounder different tissues
2.2 miR-202-5p在牙鲆雌雄性腺中的定位表达
为进一步检测miR-202-5p在性腺中的定位表达, 本研究进行了HE和原位杂交分析, 并以生殖细胞标记基因vasa作为定位参考。经HE染色鉴定本实验所用精卵巢组织为Ⅳ期的精巢和Ⅴ期的卵巢。牙鲆Ⅳ期精巢体积较大, 精巢中的生殖上皮随着结缔组织向精巢内部延伸, 形成许多隔膜, 把精巢分成许多不规则的精小叶, 同一个精小叶里生殖细胞发育不同步。从精小叶结构上看, 生殖细胞沿精小叶由外向里可分为精原细胞、精母细胞、精细胞和精子; 在牙鲆Ⅴ期卵巢中, 既可见Ⅴ期的成熟卵母细胞, 同时也存在Ⅰ—Ⅳ期卵母细胞。原位杂交结果显示: miR-202-5p仅在Ⅳ、Ⅴ期的卵母细胞中有较强烈杂交信号, 而在其他时期的卵母细胞中杂交信号微弱; 而vasa则是在Ⅰ、Ⅱ和Ⅲ等早期的卵母细胞中均检测到强烈的杂交信号, 在Ⅳ和Ⅴ时期的卵母细胞中杂交信号逐渐减弱。不同的是, 在精巢中, miR-202-5p表现出与vasa相似的表达模式, 其均在精原细胞和精母细胞中检测到强烈的杂交信号, 而在精子细胞和精子中杂交信号微弱(图2)。
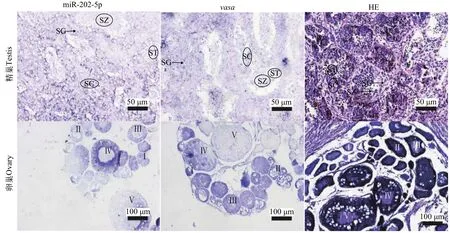
图2 牙鲆精卵巢中地高辛标记的原位杂交(ISH)Fig. 2 DIG-labeled in situ hybridization (ISH) in the testis and ovary of Japanese founder
2.3 miR-202-5p与cbx2靶向关系预测
利用生物信息学软件预测miR-202-5p种子序列与其候选靶基因cbx2的3′UTR区的结合位点, 如图3所示,cbx2 3′UTR区仅与miR-202-5p的2—8位种子序列第六位不互补, 可能是其潜在的靶基因。

图3 miR-202-5p靶基因的预测Fig. 3 Prediction of target gene of miR-202-5p
2.4 pmir-GLO-cbx2重组质粒构建与验证
以牙鲆精巢cDNA为模板, 根据牙鲆cbx2基因3′UTR序列设计特异性引物, 克隆出长度为501 bp的cbx2基因3′UTR片段(图4, 泳道1), 凝胶电泳条带大小与预测大小一致, 表明cbx2基因3′UTR片段克隆成功。将构建的重组质粒pmir-GLO-cbx2用XbaⅠ和SacⅠ限制性内切酶进行双酶切验证, 得到线性化质粒和cbx2基因3′UTR片段, 凝胶电泳分析显示两条条带大小分别约为7300和501 bp(图4, 泳道2), 结合公司测序结果, 与预期结果一致, 表明pmir-GLO-cbx2重组质粒构建成功。

图4 cbx2 3′UTR区克隆及重组质粒双酶切鉴定Fig. 4 Result of cloning of cbx2 3′UTR region and double enzyme digestion of recombinant plasmid
2.5 miR-202-5p与cbx2靶向关系的鉴定
双荧光素酶报告实验结果显示, 与空白组和对照组相比, mimics组的荧光素酶活性显著降低, 而空白组与对照组没有显著差异(图5,P<0.05)。结果表明, 过表达miR-202-5p后, 下调了cbx2 mRNA水平, 初步证实了cbx2是miR-202-5p直接作用的靶基因。
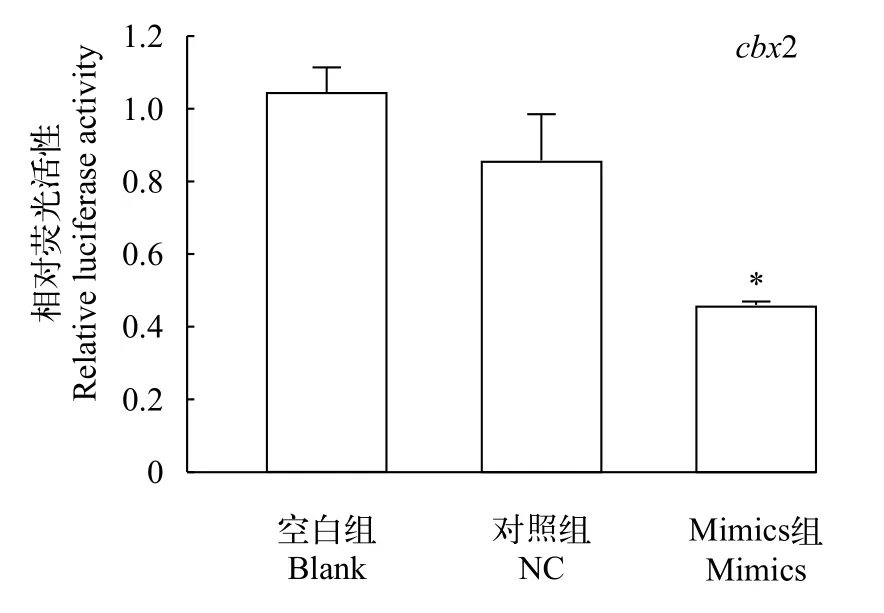
图5 转染重组载体pmirGLO-cbx2后荧光酶活性分析Fig. 5 Luciferase activity of reporter plasmid containing cbx2 3′UTR
3 讨论
本研究首先分析了miR-202-5p在牙鲆不同组织中的表达情况, 结果表明miR-202-5p在牙鲆雌雄性腺中的表达量丰富, 而在其他组织几乎不表达, 表明miR-202-5p是牙鲆性腺特异并高表达的miRNA,这与先前在斑马鱼[15]和青鳉(Oryzias latipes)[25]中的研究结果一致。在斑马鱼中, miR-202-5p在性腺中具有较高表达, 在精巢中表达量高于卵巢, 且在精原细胞中的表达最强[15]; 在青鳉中, miR-202-5p在精巢中的表达同样高于卵巢, 在精巢中所有的生殖细胞中均有表达, 但在精原细胞中的表达强于精子[25]。本研究发现miR-202-5p在精巢中的表达量高于卵巢, 原位杂交的结果进一步表明miR-202-5p主要在精巢的精原细胞和精母细胞中表达, 而在精细胞和精子中没有明显的信号。这表明miR-202-5p可能在牙鲆精子发生中发挥着重要的作用。据报道, 在鸡精巢的生殖细胞中, miR-202-5p在精原细胞中的表达量最高[26]。综上所述, miR-202-5p在脊椎动物中具有广泛的物种表达分布, 但在两性性腺中, 尤其是精巢中具有较高的表达, 这种雄性偏向性的表达模式表明miR-202-5p可能在精巢发育中发挥着重要的作用。
miRNA靶基因的预测与鉴定, 是研究miRNA功能的关键依据。双荧光素酶报告基因检测技术灵敏度高、操作简便, 是目前最常用的鉴定miRNA靶基因的一种手段[27]。本研究利用生物信息学和双荧光素酶报告基因检测技术鉴定了miR-202-5p的靶基因, 结果发现cbx2是miR-202-5p直接作用的靶基因, 在细胞水平初步明确了miR-202-5p与cbx2之间的负调控关系。先前的研究已表明cbx2是哺乳动物性腺发育调控的重要因子[28]。研究发现,M33(cbx2)基因缺失的雄性小鼠会出现向雌性转变的现象[29]。Eid等[30]在细胞中对cbx2进行RNA干扰, 发现随着cbx2被抑制, 减数分裂必不可少的基因-EXO1和雄性发育相关基因sox3的表达量也随之降低; 而过表达cbx2后,EXO1基因和sox3基因的表达量升高, 与此同时,Pbx1和Fzd1等雌性发育相关基因的表达量出现下降。研究表明,cbx2不仅可以通过调控下游靶基因sf1和NR5A1等的表达,进而调控sry基因的表达, 从而影响雄性性腺发育[20]; 还可以通过直接或间接抑制雌性性别相关基因wnt4和foxl2(forkhead transcriptional factor 2)的表达, 抑制雌性的某些信号通路[30]。此外, 较多的研究也表明cbx2在哺乳动物的细胞周期变化[31,32]、减数分裂、同源染色体的联会和生殖细胞增殖分化中发挥着较为重要的作用[33]。目前,cbx2基因在鱼类中的研究还很少, 本实验室王新艳等[34]研究发现,cbx2在牙鲆性腺中表达, 暗示cbx2可能在鱼类性腺发育中发挥重要作用。晁青何等[35]在青鳉中通过RNAi干扰抑制cbx2的表达发现, 雄性性别相关基因sox9(SRY-related HMG box 9)的表达量降低, 而雌性性别相关基因foxl2的表达量升高, 表明cbx2可能通过调节性别相关基因的表达调控鱼类的性腺发育。本研究明确了miR-202-5p与cbx2间存在直接的靶向关系, 表明miR-202-5p可能通过调节cbx2进而在牙鲆性腺发育中发挥重要作用, 为深入研究miR-202-5p和cbx2在牙鲆性腺发育中的作用机制提供了基础, 而其在牙鲆性腺发育和精子发生中具体扮演着怎样的角色仍需进一步实验探讨。

