中药单体成分调节肿瘤微环境的研究进展
周 雄 ,杨 明,李 翔*,张 婧*,刘 骏
1.江西中医药大学 现代中药制剂教育部重点实验室,江西 南昌 330004
2.江西中医药大学 中药固体制剂制造技术国家工程研究中心,江西 南昌 330004
肿瘤微环境与肿瘤的发生与发展密切相关,其相关的发病率和死亡率构成了世界范围内非常重要的健康问题。肿瘤微环境是肿瘤发展中的积极参与者,表现出癌症的多种标志性特性,促进血管生成和增殖、抑制肿瘤细胞凋亡、紊乱生长抑制因子以及其他功能失调[1-4]。
肿瘤微环境中涉及多种细胞类型,如肿瘤相关成纤维细胞(tumor-associated fibroblast,TAFs)、血管内皮细胞(vascular endothelial cell,VEC)、肿瘤相关巨噬细胞(tumor-associated macrophages,TAMs)、树突状细胞(dendritic cells,DCs)、髓源性抑制细胞(myeloid-derived suppressor cells,MDSCs)以及免疫和炎症细胞,均对肿瘤的发生、浸润和转移有着重要影响[5]。天然来源的中药单体成分通过调节肿瘤微环境中不同的细胞及因子转化来抑制肿瘤细胞的活性[6]。引入天然来源中药活性成分,是一种新的可靠的治疗方法,可利用它们的选择性分子靶标来治疗不同类型的肿瘤。
1 对TAFs的调节
在肿瘤微环境中,成纤维细胞含量最多[7]。正常情况下,成纤维细胞处于未激活状态,受损时可被激活并分化为肌成纤维细胞[8]。与响应伤口而激活的肌成纤维细胞不同,TAFs是不可逆且组成性激活,其位于生长中的肿瘤扩张边界附近,与肿瘤的发生发展密切相关,且不受程序性细胞死亡的影响而持续保持活性,与多种癌症类型的不良预后有关[9-10]。
1.1 上调脂肪组织中的mRNA和蛋白质水平
脂肪组织和脂肪细胞在肿瘤微环境中具有重要作用,人脂肪组织的干细胞是TAFs的来源。盐酸小檗碱的降血糖和调血脂作用能表明脂肪组织或脂肪细胞与肿瘤发生之间的关系,即盐酸小檗碱可以上调脂肪组织中的mRNA和蛋白质水平,包括过氧化物酶体增殖物激活受体(peroxisome proliferatorsactivated receptors,PPARs)、细胞周期蛋白依赖性激酶9(cyclin-dependent kinase,CDK9)和细胞周期蛋白T1(Cyclin T1)[6]。还可防止附睾脂肪组织的消耗,并改善结肠癌colon 26/20细胞移植小鼠和colon 26/20细胞的癌性恶病质,并体现了对肿瘤微环境中脂肪组织的有益作用[11-14]。
1.2 降低TAFs的生物标志物
TAFs的亚型-肌成纤维细胞在肿瘤发生发展过程中尤为重要,它释放的基质金属蛋白酶(matrix metalloproteinase,MMP)促进纤维间质形成,这是晚期肿瘤的特征之一。转化生长因子-β(transforming growth factor-β,TGF-β)能促进肌成纤维细胞表型变化、细胞外基质翻转以及生长因子的产生,含TGF-β的癌细胞衍生的细胞外小泡通过上调成纤维细胞中α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)的表达将成纤维细胞转化为肌成纤维细胞[15-16]。携带TGF-β的人卵巢癌EVs细胞能增加成纤维细胞α-SMA的表达,同时减少基质金属蛋白酶抑制物-2(tissue inhibitor of metalloproteinase-2,TIMP-2)的产生,进而激活成纤维细胞转化为TAFs,并增强其增殖、迁移、合成和分泌功能[17]。
水飞蓟宾能降低单核细胞趋化蛋白-1(monocyte chemotactic protein-1,MCP-1)和TAFs的生物标志物(成纤维细胞活化蛋白、α-SMA、TGF-β2、波形蛋白等),并显著调节肿瘤微环境中免疫细胞的募集从而达到改善肿瘤微环境的目的[10]。白藜芦醇能抑制Cyclin D1、原癌基因、MMP-2、MMP-9和胚胎干细胞关键蛋白的上调。白藜芦醇抑制TAFs促进的蛋白激酶B(protein kinase B,PKB/Akt)信号通路和信号转导及转录激活因子(signal transducer andactivatorof transcription,STAT3)的激活,从而抑制与人乳腺癌T74D细胞增殖相关的下游分子(CD44和Sox2)的表达[18]。
1.3 抑制Wnt16信号通路的表达
Wnt16是无翅型整合位点Wnt家族的成员,参与有丝分裂信号通路。通过基因敲除Wnt16,可抑制肿瘤细胞和TAFs之间的相互促进作用,最终抑制肿瘤细胞介导的化疗抗性[19]。在成纤维NIH3T3细胞、乳腺癌4T1细胞和结肠癌SW480细胞等肿瘤细胞中,槲皮素能够显著抑制活化的成纤维细胞中Wnt16的表达以及降低肿瘤细胞获得抵抗力和重建基质的活性[20]。
1.4 抑制活性氧(reactive oxygen species,ROS)的生成
ROS在促结缔组织增生中起重要作用。少量的ROS具有免疫防御作用,而过量的ROS可导致氧化应激、细胞外调节蛋白激酶1/2(extracellular regulated protein kinases 1/2,ERK1/2)途径的激活、肌成纤维细胞的分化和细胞外基质蛋白的异常合成,从而导致纤维化和肿瘤的形成[21-22]。葛根素能显著提高超氧化物歧化酶的活性,阻断脂质的自动氧化,并有效清除氧自由基。由于3′-羟基的存在,葛根素能清除ONOO-和总ROS,从而抑制TGF-β诱导纤维化[23]。
2 对TAMs的调节
巨噬细胞是肿瘤微环境中的重要组成部分,可分为经典活化的M1型巨噬细胞和替代性活化的M2型巨噬细胞。活化的M1型巨噬细胞介导机体获得性免疫和肿瘤细胞的凋亡;而M2型可通过刺激肿瘤细胞增殖,抑制肿瘤微环境,促进基质重塑以及肿瘤血管和淋巴血管形成等多个环节,促进肿瘤的侵袭和转移[24]。
2.1 上调免疫因子
研究利用小鼠全基因组寡核苷酸微阵列分析杜仲叶中提取的绿原酸给药后雌性BALB/c小鼠肉瘤EMT-6细胞的基因表达水平,通过时间序列(timeseries)分析、基因本体论(gene ontology,GO)功能分析和信号通路(pathway)分析筛选差异表达基因,并进行定量逆转录聚合酶链反应(quantitative reverse transcription polymerase chain reaction,RTqPCR)验证,结果表明参与免疫通路的应答基因CaN、NFATC2、NFATC2ip和NFATC3被显著上调,免疫因子如白细胞介素2受体(interleukin-2 receptor,IL-2R)和γ干扰素(interferon-γ,IFN-γ)的表达可以得到改善,从而促进T细胞、TAMs和自然杀伤细胞(natural killer cell,NK)细胞的活化和增殖,从而增强它们的监视和杀伤能力,进一步抑制肿瘤细胞的生长速率[25]。
2.2 抑制CD163
通过评估M2型巨噬细胞独特标记物CD163的表达,研究洋葱素A对IL-10诱导的M2型TAMs活化的毒性作用,洋葱素A 10、30 μmol/L显著抑制CD163的表达,抑制TAMs的活性,从而抑制肿瘤的发展[26-27]。
2.3 降低STAT6磷酸化和转录因子C/EBPβ表达
STAT是一种能与DNA结合的蛋白质家族。含有SH2和SH3结构域,可与特定的含磷酸化酪氨酸的肽段结合。当STAT被磷酸化,发生聚合成为同源或异源二聚体形式的活化的转录激活因子,进入胞核内与靶基因启动子序列的特定位点结合,促进其转录。从大黄中提取的大黄素可能通过降低STAT6磷酸化和C/EBPβ表达来抑制肺中TAMs募集和M2极化,从而抑制4T1细胞、乳腺癌EO771细胞的肺转移[28]。
木犀草素能阻断STAT6的磷酸化,并降低M2相关基因的表达,并以趋化因子配体2(chemokine ligand 2,CCL2)依赖的方式减少了肺癌Lewis细胞的迁移,通过抑制巨噬细胞分泌的CCL2,实现对单核细胞募集和癌症迁移的抑制作用,该机制可成为一种治疗恶性肿瘤的新思路[29],抑制巨噬细胞中的c-Jun氨基末端激酶(c-JunN-terminal kinase,JNK)信号,同时激活癌细胞中的这种激酶,抑制TAMs的表达[30]。
2.4 降低趋化因子受体2(chemokine receptors 2,CCR2)的表达
CCR2是在稳态和炎症条件下参与调节单核细胞迁移的最重要的趋化因子受体。水飞蓟宾可降低荷瘤动物骨髓间充质干细胞的CCR2表达,并通过对4T1荷瘤小鼠肿瘤微环境的骨髓间充质干细胞中IL-10的测定,证明水飞蓟宾可导致巨噬细胞免疫极化偏离M1表型[31]。水飞蓟宾能降低p65 NF-κB(ser276,38%;P<0.01)和STAT-3(ser727,16%;P<0.01)在肿瘤细胞中的磷酸化,并且减少肺巨噬细胞数量,同时在肺癌A549细胞中能减少巨噬细胞向荷瘤肺的浸润,抑制其新生血管生成[32]。
2.5 抑制IL-6的产生
IL-6是多功能的细胞因子,TAMs、T细胞、TAFs及若干肿瘤细胞等都可产生IL-6,它对生物体的分化、代谢、增殖和凋亡等各项生理活动过程都具有调控作用。IL-6的高表达可能会导致正常的组织形态出现恶性转化,导致肿瘤的发生。在氧化偶氮甲烷和葡聚糖硫酸钠诱导的结肠炎相关肿瘤发生的小鼠模型中研究发现,从甘草中提取的异甘草素可通过抑制巨噬细胞中前列腺素E2(prostaglandin E2,PEG2)和IL-6的产生来阻断M2巨噬细胞极化来调节肿瘤的发展[33]。
2.6 上调一氧化氮(nitric oxide,NO)和诱导型一氧化氮合酶(induced nitricoxide synthase,iNOS)表达
从地黄中提取的秦皮乙素通过上调鼠类的巨噬细胞和淋巴细胞中NO和iNOS表达,增加巨噬细胞体内迁移及吞噬功能,诱导脾LAK细胞活性,从而调节小鼠的免疫功能[34],亦可抑制STAT3磷酸化,降低M2巨噬细胞分化中IL-10、MCP-1和TGFβ1表达以增强抗骨肉瘤LM8细胞的活性,其机制与M2巨噬细胞分化对TAMs的调节激活有关[35]。
2.7 其他作用机制
白藜芦醇通过降低人单核巨噬细胞的M2极化来促进抗肿瘤作用。当白藜芦醇和肿瘤条件培养基联合治疗高迁移率族蛋白时,与仅用中药治疗组相比,作为M2表型标记之一的IL-10的分泌、癌细胞中STAT3的活化和肿瘤生长都显著降低[36]。地榆皂苷I/II通过脾中的淋巴细胞增殖、细胞因子分泌增加和TAMAs吞噬能力的激活来刺激免疫系统[37]。
研究显示,从柴胡中提取的柴胡皂苷A和柴胡皂苷D具有独特的免疫调节功能,通过诱发巨噬细胞聚集、游走、吞噬,刺激B淋巴细胞和T淋巴细胞发挥免疫调节作用[38-39]。柴胡皂苷D还可通过提高巨噬细胞的扩散能力和酸性磷酸酶的活性,增强体内免疫细胞的功能发挥免疫调节作用,还可促进IL-2的产生及其受体的表达[40]。然而,研究显示柴胡皂苷A 50 μmol/L可抑制磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/Akt,从而抑制T淋巴细胞的增殖与活化,最终抑制T细胞发挥免疫功能[41],亦有研究表明柴胡皂苷A对动物的胸腺有一定的抑制作用,可使机体的免疫功能下降[42]。
3 对T细胞和NK细胞的调节
T细胞主要分为CD8+T细胞和CD4+T细胞,CD4+T细胞又包括Th1、Th2、Th17和调节性T细胞等。恶性肿瘤细胞能分泌免疫抑制因子,促使CD4+T淋巴细胞减少,CD8+T淋巴细胞增多,CD4+/CD8+下降[43]。临床研究发现,多种中药都能促进T细胞的增殖与分化,改善CD4+T细胞和CD8+T细胞的比例,提高机体抗肿瘤的能力。NK细胞是机体重要的免疫细胞,不仅与抗肿瘤、抗病毒感染和免疫调节有关,而且在某些情况下参与超敏反应和自身免疫性疾病的发生,能够识别靶细胞、杀伤介质。
3.1 抑制IL-12 p70的产生
IL-12 p70作用于NK细胞和T细胞,诱导细胞因子的产生、增殖和细胞毒活性的增加,并发挥重要的促炎功能。花旗松苷1~100 mmol/L能显著抑制细胞因子IL-12 p70的分泌,并阻断DCs对脂多糖和脂磷壁酸的作用,从而抑制DCs介导的免疫反应[44]。
3.2 抑制MCP-1的表达
虽然肿瘤或转基因细胞含有高表达的趋化因子MCP-1,但在体外生长活性并无明显差异,而动物体内的成瘤实验却证实成瘤能力明显下降或消失,肿瘤生长缓慢,而浸润细胞数量可增加2倍以上[45]。单核细胞的浸润过程可被中和MCP-1的抗体阻断,这就导致了肿瘤的形成和生长速度的加快。水飞蓟宾治疗的TRAMP小鼠药效实验表明其能抑制前列腺肿瘤中MCP-1的表达,从而增强NK细胞和细胞毒性T细胞的免疫监视功能[10],还能增加肿瘤浸润性T细胞,延缓肿瘤生长和减少骨髓间充质干细胞的积累,增加T细胞的含量[31]。
3.3 增强IL-2和IFN-γ的分泌
IL-2是重要的免疫调节因子之一,能诱导T淋巴细胞增殖、分化;可激活NK细胞提高其活性;能增强细胞毒性T淋巴细胞的细胞毒性;能激活肿瘤浸润性淋巴细胞,促进其分泌细胞因子、表达对应受体;此外IL-2还能诱导产生肿瘤坏死因子(tumor necrosis factor,TNF)、IFN、细胞集落刺激因子,通过协同作用加强NK细胞活性[46]。IFN-γ为Ⅱ型干扰素,主要由活化的T细胞和NK细胞产生。研究证明IFN-γ具有抑制多种肿瘤细胞生长的能力,尤其是对乳腺癌的治疗有着良好的作用。在BALB/c小鼠中,从穿心莲中提取的穿心莲内酯通过促进T淋巴细胞和NK细胞的增殖来增强IL-2和IFN-γ的分泌,从而抑制肿瘤生长[47]。
3.4 H2O2和Ca2+选择性积累
一些研究已经揭示了在恶性T细胞中用汉黄芩素治疗后产生H2O2和Ca2+超载作为抗肿瘤机制,与正常细胞相比,恶性淋巴细胞产生更高水平的超氧自由基,而汉黄芩素具有将超氧自由基转化为H2O2的能力,导致H2O2在恶性T细胞而不是正常T细胞中选择性积累,从而在恶性细胞中选择性诱导凋亡[48]。
3.5 其他作用机制
T细胞增殖:体外实验证明盐酸小檗碱10~20 μg/mL可轻微增加T细胞对抗原的增殖反应,而质量浓度超过该水平会导致剂量相关性免疫抑制[49];抑制免疫逃逸:儿茶素阻断IFN-γ激活的两面神激酶-蛋白激酶C-delta-STAT1通路,抑制吲哚胺2,3-双加氧酶(indoleamine 2,3-dioxy-genase,IDO)表达,纠正癌细胞免疫逃逸;改善免疫抑制环境:槲皮素可显著降低免疫抑制的调节性T细胞和MDSCs,并且增加DCs上共刺激信号(MHC Ⅱ类和CD86)的水平,表明这些DCs已成熟并被激活,可促进抗肿瘤T细胞活性和诱导细胞因子分泌,如IL-12、IFN-γ[50]。
白藜芦醇下调癌细胞的PI3K/Akt/哺乳动物雷帕霉素靶通路(mammalian target of rapamycin,mTOR)[51-52]。抑制PI3K途径可激活CD8+细胞毒性T细胞活性,增强抗癌免疫[53]。白藜芦醇能够激活免疫细胞,选择性地诱导癌细胞死亡。调节性T细胞在实体瘤中大量存在,在调节免疫肿瘤微环境的稳态中起着关键作用,肿瘤微环境中调节性T细胞数量的增加与患者的生存结果呈负相关[54]。
4 对DCs的调节
肿瘤微环境中的肿瘤浸润性DCs为不成熟的DCs,可以诱导免疫抑制,具有抗原呈递功能紊乱、抑制细胞的内吞噬、异常活动等特点。研究发现中药单体成分可通过不同机制促进DCs成熟,调控DCs的抗原呈递功能和抗肿瘤活性。
4.1 抑制IL-12和TNF-α
IL-12作用于NK细胞和T细胞,诱导细胞因子的产生、增殖和细胞毒活性的增加,并发挥重要的促炎功能。TNF-α在体内外均可对一些肿瘤细胞或细胞系起杀伤作用,大剂量TNF-α可引起恶病质,患者呈进行性消瘦,因而TNF-α又称恶病质素。从水飞蓟中提取的花旗素苷能显著抑制IL-12和TNFα的产生,从而对DCs介导的免疫反应发挥抑制作用[44]。水飞蓟宾通过抑制p38蛋白激酶、细胞外调节蛋白激酶和JNK,对小鼠骨髓DCs的表型和功能成熟产生抑制作用,其介导的抑制脂多糖刺激的CD11c+DCs产生IL-12也可能有助于诱导免疫抑制状态[55]。在体外和体内条件下均证明水飞蓟宾是DCs成熟的有效抑制剂。
4.2 增加共刺激信号水平
共刺激分子具有激活T细胞、赋予T细胞活化的第二信号,并且参与Th细胞极化的作用。槲皮素和丙氨酸内酯联合使用诱导免疫原性细胞死亡释放的高迁移率族蛋白B1(high mobility group box 1,HMGB1)和钙网蛋白来激活DCs,并且极大地增加DCs上共刺激信号(MHC II类和CD86)的水平,从而促进DCs成熟并激活,增加CD4+/CD8+T细胞数量[50]。
5 对MDSCs的调节
MDSCs是骨髓来源的异质性细胞群,主要是由TAMs、中性粒细胞和DCs等不成熟的前体细胞构成,具有很强的免疫抑制作用,其在肿瘤微环境中大量存在,是引起肿瘤免疫逃逸的重要细胞群体[56]。MDSCs在血液中增加,并在肿瘤携带动物的肿瘤微环境中积累,导致癌症中的免疫抑制。研究表明在小鼠乳腺癌4T1细胞模型中,水飞蓟宾能显著抑制肿瘤生长,瘤内细胞生化指标测定显示,水飞蓟宾能降低CCR2在肿瘤浸润MDSCs中的表达,对脾MDSCs中的CCR2表达无影响,因此推测水飞蓟宾通过减少MDSCs的肿瘤趋向性,从而抑制4T1细胞的生长[31]。
6 对VEC的调节
血管生成即新血管的形成,在肿瘤发展的早期是必需的,它对肿瘤的扩张、发展和转移至关重要。血管生成是一个复杂的过程,涉及基底膜的降解、内皮细胞对基质的侵入、内皮细胞增殖、迁移并组织成毛细血管结构[57]。
6.1 减少血管内皮生长因子(vascular endothelial growth factor,VEGF)的分泌
VEGF在血管的形成以及在肿瘤的生长和转移过程中起到重要作用。VEGF是癌症血管生成的关键介质,它刺激新血管的生长,并使肿瘤获得生长所需的营养和氧气,是正常和异常血管生成的关键调节因子[58-59]。儿茶素[60]、苦参碱[61]和氧化苦参碱[62]、白藜芦醇[63]、水飞蓟宾[64-65]、齐墩果酸[66]、熊果酸[67]、鞣花酸[68]、汉黄芩苷[69]、紫草素[70]、柴胡皂苷D[71]、秦皮乙素[35]和积雪草酸[72]等单体成分通过降低VEGFα的RNA和蛋白表达,以及抑制肝细胞生长因子受体/c-Met基因等途径抑制VEGF的表达,从而抑制多种肿瘤细胞的血管生成。
6.2 抑制PI3K/Akt/mTOR信号通路
PI3K/Akt/mTOR信号通路参与多种细胞生物学过程,包括细胞生长、运动、代谢和血管生成以及凋亡[73-74]。近来有研究表明绿原酸[75]、大黄素[76]、苦参碱[77]、汉黄芩素[48]和芹菜素[78]等单体成分能够负向调节PI3K/Akt/mTOR信号通路,在多种水平上抑制VEC的增殖和迁移,并抑制血管的生成。
6.3 抑制MMP-1、MMP-2和MMP-9的表达
MMPs具有降解和重塑细胞外基质的作用,促进肿瘤细胞的侵袭和转移[79]。研究发现,盐酸小檗碱[80]、大黄素[76,81]、水飞蓟宾[65]、槲皮素[82]、木犀草素[30,83]、穿心莲内酯[47]和氧化苦参碱[62]等中药单体成分能够下调MMP-1、MMP-2和MMP-9的表达来抑制VEC的活性,降低微血管密度。
6.4 其他作用机制
癌细胞中IL-8的过表达会促进血管生成,小檗碱通过抑制p38蛋白激酶、ERK1/2和JNK信号通路,在体外和体内均显著降低胃腺癌MGC 803细胞中IL-8的分泌,从而抑制新生血管的生成[84]。从桃儿七的根和根茎中提取的鬼臼毒素通过破坏细胞内微管的稳定性而显著抑制各种癌细胞的生长[85]。从黄连中提取的药根碱在体内和体外抑制了黑色素瘤C8161细胞中血管内皮钙黏蛋白基因的表达,从而抑制血管生成,血管内皮钙黏蛋白是肿瘤血管生成拟态和血管生成的关键蛋白[86]。
天然来源中药单体成分对肿瘤微环境组成细胞的作用机制见表1。

表1 天然来源中药单体成分对肿瘤微环境组成细胞的作用机制Table 1 Mechanism of natural Chinese medicine monomer components on tumor microenvironment cells
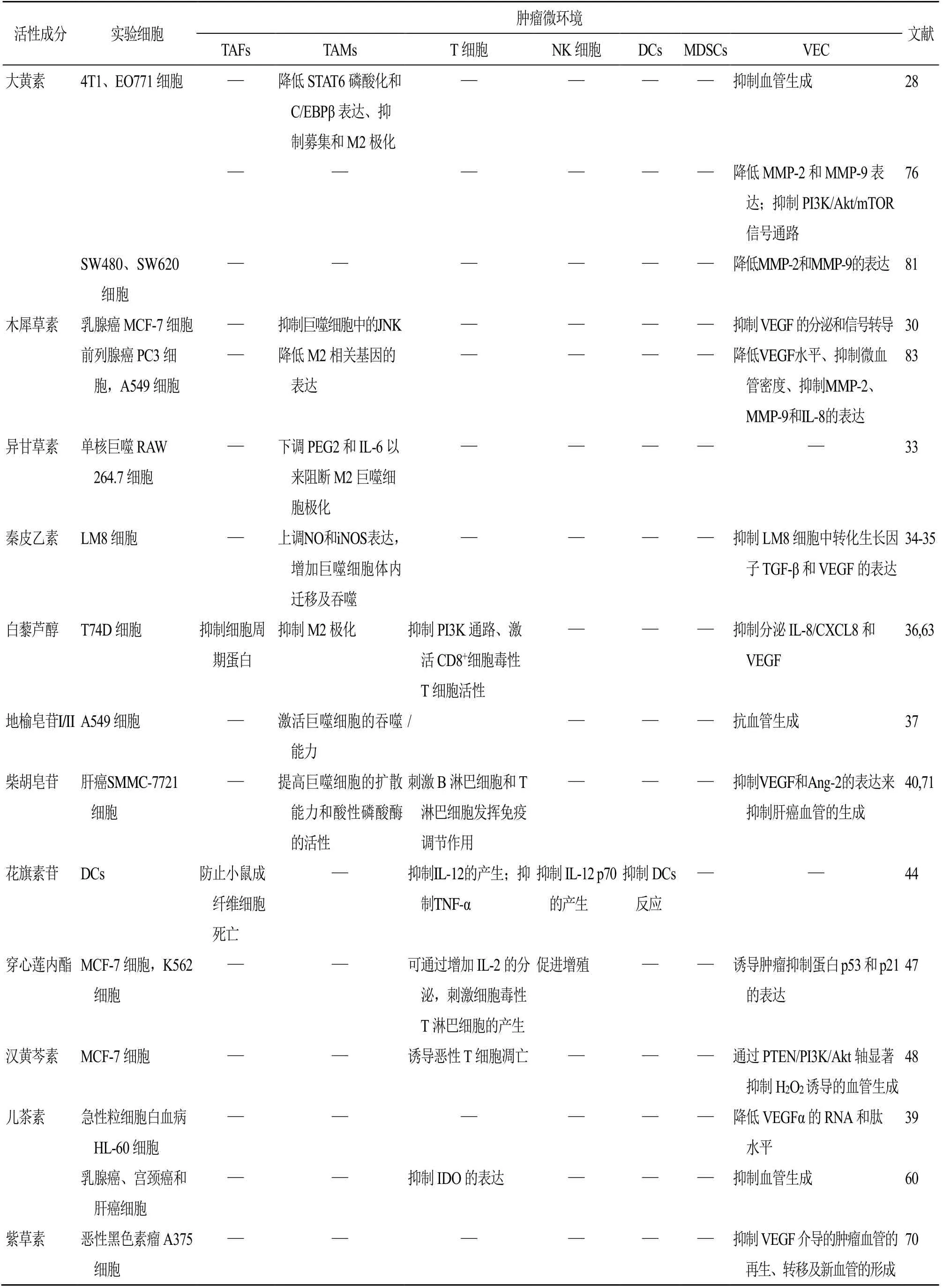
续表1
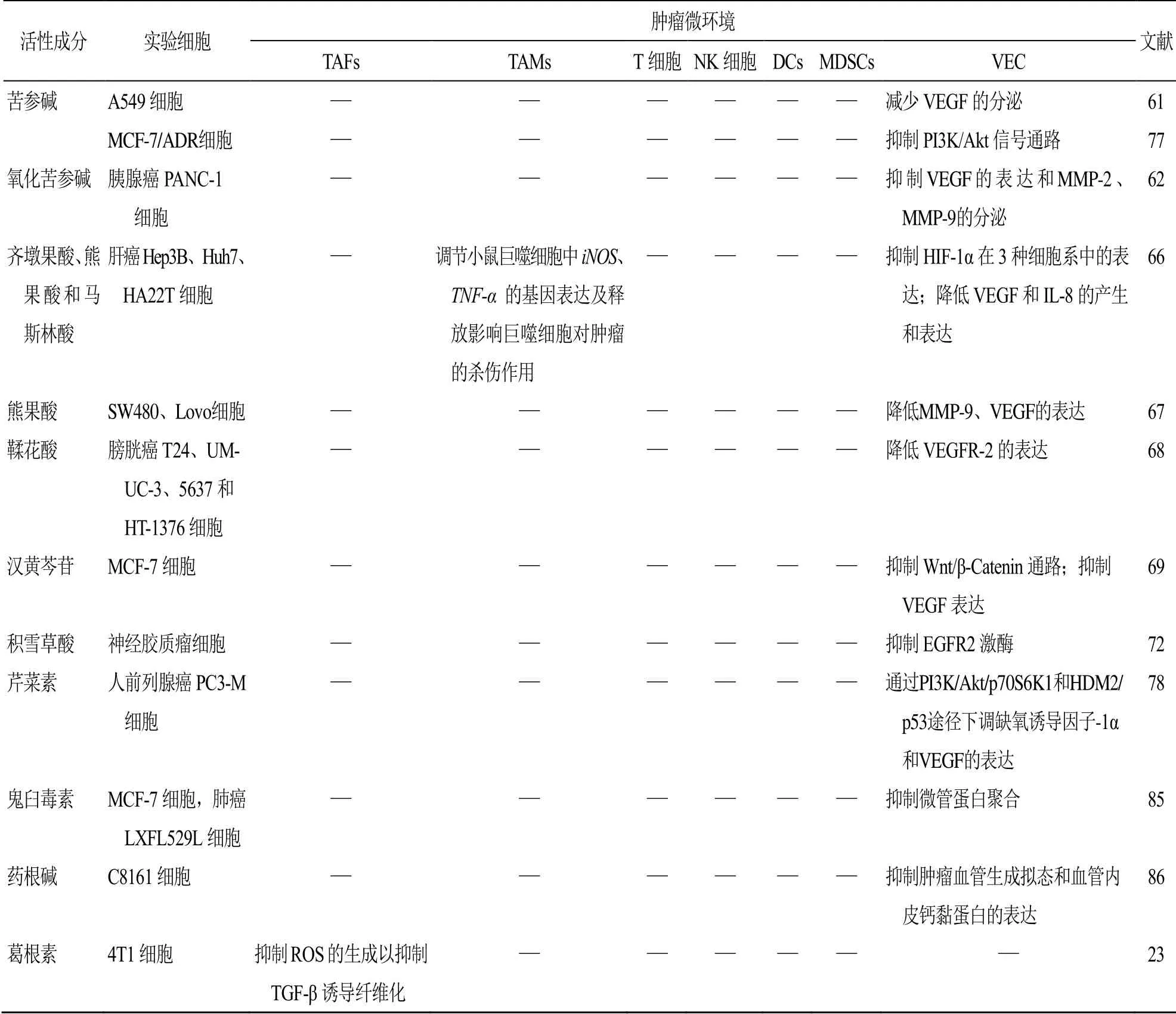
续表1
7 结语
目前通过中药单体成分对肿瘤微环境的调节来抑制肿瘤的发生与发展受到越来越多的关注。不同的中药单体成分具有多种生物学功能,直接或间接地影响肿瘤微环境细胞,大量的体外实验证明中药单体为改善肿瘤免疫及非免疫微环境提供了多种治疗选择,随着中药单体成分以及肿瘤免疫学等相关的研究越来越成熟,肿瘤微环境中的各种相关组分可能会成为未来中药治疗肿瘤的新靶点。
尽管如此,中药单体成分在改善肿瘤微环境研究中仍处于初级起步阶段,存在以下问题:(1)作用机制有待深入研究。有效单体组分抗肿瘤的作用机制需要更深入、全面的研究,特别是其在中药成分结构分类与药理作用相关性、亚细胞水平的作用靶点、对免疫微环境的调节通路[50]等方面;(2)中药配伍优势有待开发。中药药效的发挥,最大的优势在于多成分、多靶点的协同作用,然而目前中药单体的研究大多针对一种成分或该成分与化疗药物联用进行研究,不能充分体现在中医药理论指导下的药物配伍优势,因此不能充分体现单体成分相较于常规化疗药物的优势;(3)成药性有待解决。中药单体成分具有成药性差(难溶性、膜渗透性低、治疗窗窄、稳定性差)、药动学行为不理想(生物利用度低、半衰期短、清除率高)等不足,以上问题严重限制了其临床应用[88];(4)靶向纳米制剂有待开发。靶向纳米制剂具有提高肿瘤部位药物聚集、降低正常组织药物分布,有效靶向至组织、细胞、细胞器的功能[89-90],中药单一或多成分协同包载的靶向纳米制剂的开发有利于进一步提高减毒增效的生物学效应。
利益冲突所有作者均声明不存在利益冲突