天然产物人类免疫缺陷病毒-1(HIV-1)潜伏激活剂的研究进展
王修艺 ,焦莹莹 ,张立伟,李石飞
1.山西大学 分子科学研究所,化学生物学与分子工程教育部重点实验室,山西 太原 030006
2.山西大学 中医药现代研究中心,山西 太原 030006
艾滋病是由人类免疫缺陷病毒(human immunodeficiency virus,HIV)引起的感染性疾病,迄今全球仍有近3700万HIV感染者,占全球人口的0.52%,是现代历史上最严重的传染性疾病之一。目前针对艾滋病的治疗手段主要是高效抗逆转录病毒疗法(highly active antiretroviral therapy,HAART),即采用2种或3种逆转录酶抑制剂和至少1种蛋白酶抑制剂进行联合作用。该疗法可以最大限度地抑制HIV复制,有效降低血浆病毒载量,延长感染者的无症状期,从而延长感染者寿命。然而,HAART疗法不能彻底根除机体内的HIV-1病毒,更不能使感染者的免疫功能恢复正常,临床中也逐渐出现了许多药物毒副作用和耐药毒株[1]。重要的是,停止HAART治疗后,病毒载量将会迅速反弹。这主要是由于有一部分HIV-1感染人体后会稳定持续地存在于一些静息型的CD4+T细胞内,形成潜伏病毒储存库[2-4]。在这些静息型CD4+T细胞中,病毒基因组处于低水平转录状态,几乎没有病毒的产生或仅有极少量病毒产生。而这样的潜伏细胞由于缺乏病毒蛋白,与正常细胞并无区别,所以不会被宿主免疫系统觉察,从而避免了免疫系统以及药物对它的攻击[5]。一旦HAART停止后,这些静息细胞就会被一些抗原或细胞因子活化,重新参与到病毒的复制周期中[6-8]。因此,HIV潜伏感染是艾滋病无法治愈的根本原因。
随着人们对HIV-1潜伏感染的建立及维持机制的深入研究,研究人员提出了“shock and kill”的治疗策略,即通过潜伏感染激活剂(latency reactivation agent,LRA)激活潜伏的HIV使之发生转录,然后与HAART联合使用,并结合细胞的自身免疫监视系统,从而实现清除HIV-1病毒潜伏库的目的(图1)[9-11]。目前已发现报道的LRA主要有组蛋白去乙酰化酶抑制剂(histone deacetylase inhibitor,HDACi)、BRD(bromodomain)蛋白抑制剂、蛋白激酶C(protein kinase C,PKC)激活剂、正性转录延伸因子b(positive transcription elongation factor b,p-TEFb)激活剂、DNA甲基化酶抑制剂(DNA methyltransferase inhibitor,DNMTi)、细胞因子等[11]。尽管已有少数几个明星分子进入临床试验[12],但临床结果并不理想,其原因可能是宿主的免疫响应不足和LRA的体内激活活性不足等。除此之外,LRA普遍能够引起一些毒副作用,如过度激活CD4+T细胞而引起免疫紊乱等,这也是亟待解决的问题[13]。因此,基于“shock and kill”这种治疗策略,筛选安全高效的LRA、发现新的激活机制和作用靶点,是目前艾滋病新药研发的基础和关键问题。
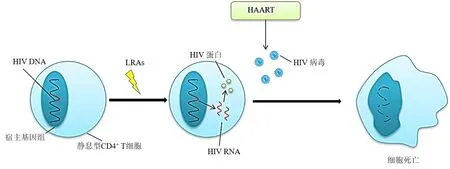
图1 “Shock and kill”治疗策略Fig.1 Treatment strategy of “shock and kill”
天然产物来源广泛,而且结构多样,是LRA的重要来源。此外,天然产物可以克服单靶点药物的局限性从而达到高效的目的。自“shock and kill”策略提出后,目前已从天然产物中发现众多的LRA,其中不乏作用机制多样的天然结构,还有已进入临床的候选分子。因此,本文综述了目前已报道的38个具有激活潜伏HIV作用的天然产物,根据天然产物的结构进行了分类,并对来源、作用机制进行了归纳总结。
1 萜类化合物
1.1 二萜类化合物
1.1.1 惕各烷型二萜 1992年美国癌症研究中心研究人员从南太平洋岛国萨摩亚群岛的马马拉Homalanthus nutans(G.Forst.) Guill.树皮分离得到惕各烷型二萜成分prostratin,并对其进行了抗HIV活性研究,发现其具有显著的活性[14]。其活性主要表现在2个方面:一方面,prostratin通过下调寄主细胞CD4和协同受体协同受体趋化因子(C-X-C基元)受体4 [chemokine (C-X-C motif) receptor 4,CXCR4]、CCR5的表达来抑制HIV病毒侵染,同时促进T细胞分泌HIV病毒抗体,降低感染率;另一方面,prostratin可通过PKC介导的途径活化转录活性核因子κB(nuclear factor κB,NF-κB),使其进入细胞核内激活HIV前病毒DNA的表达,从而可以与HAART疗法联用,从根源上消除HIV潜伏病毒库[15-17]。自prostratin在抗HIV方面显示出双重作用后,惕各烷型二萜以及佛波醇类结构抗HIV活性研究受到了广泛关注[18-20]。更为重要的是,在功能性免疫缺陷的鼠模型研究中显示,与其他佛波醇类化合物不同的是,prostratin不仅能激活胸腺和外周淋巴组织中潜伏病毒的表达,同时还不诱导细胞增殖,不会促进肿瘤形成[14,19]。2008年,Wender等[21]采用半合成方法成功实现从佛波醇5步合成了prostratin,从而在2010年由美国艾滋病研究联盟批准进入I期临床研究。
12-deoxyphorbol-13-phenylacetate(DPP)是一种分离自贝信麒麟Euphorbia poissoniiPax[22]和白角麒麟E.resiniferaO.Berg[23]的佛波酯。DPP在潜伏感染的T细胞中诱导HIV-1的表达,并使它们对病毒包膜糖蛋白的免疫毒素的杀伤敏感。DPP的激活作用比prostratin高出20~40倍,这可能与其亲脂的侧链结构相关[19]。
phorbol 12-myristate 13-acetate(PMA)是来源于青霉菌属Penicillium的佛波酯衍生物,phorbol-12,13-dibutyrate(PDBu)是来源于巴豆油的佛波酯衍生物。研究表明,在HIV潜伏的急性T淋巴细胞白血病Molt-4和Jurkat细胞模型中,PMA和PDBu都能显著诱导HIV-1激活。在Molt-4细胞模型中,PDBu激活HIV-1的作用是PMA的2倍左右。研究发现PMA可以通过诱导与HIV-1长末端重复序列(HIV-1 LTR)增强子区域结合的NF-κB的激活来实现T细胞中HIV-1的表达。而PDBu作用更强的原因可能是其亲水性和低相对分子质量。此外,PDBu在细胞质中可直接作为钙离子的调节剂,参与了多种细胞信号的转导,包括PKC系统的激活[24-25]。
4β-deoxyphorbol 12-tiglate-13-isobutyrate(4βdPEA)是从E.amygdaloidesssp.semiperfoliata(Viv.)Radcl.-Sm.的叶子中分离得到的一种4-脱氧佛波酯衍生物。研究显示,4β-dPEA与其他二萜类的PKC激活剂作用类似,它在HIV复制周期中具有双重作用。在人淋巴瘤MT-2细胞中,10 nmol/L 4β-dPEA可以激活HIV的转录,在白细胞介素(interleukin,IL)-2激活的外周血单核细胞PBMCs中,半数最大效应浓度(median effect concentration,EC50)为2.9 nmol/L,而且半数细胞毒性浓度(median cytotoxic concentration,CC50)均大于10 μmol/L,该转录活性需要依靠丝裂原活化蛋白激酶/细胞外调节蛋白激酶(mitogen-activated protein kinases/extracellular signalregulated kinase,PKCθ/MEK)激活。同时,4β-dPEA还显示出了下调CD4、CXCR4和CCR5受体的作用,但该作用却与PKC/MEK无关。此外研究还发现,4β-dPEA与prostratin联用时,表现为拮抗效果;而与伏立诺他(一种HDACi)联合时,表现为协同作用,4β-dPEA激活潜伏HIV的EC50明显降低[26]。
1.1.2 巨大戟烷型二萜 ingenol-3-angelate(IngB),是从南欧大戟E.peplusL.和绿玉树E.tirucalliL.中分离得到的一种具有抗癌作用的巨大戟二萜衍生物[27]。在急性T淋巴细胞白血病J-Lat A1细胞株中,IngB显示出了对HIV的高效激活作用,并且表现出低细胞毒性。同时,在经过HAART治疗的HIV阳性个体中分离纯化的CD4+T细胞中,IngB也能够显示出激活潜伏HIV的效果。进一步研究表明,IngB的这种激活作用可能是通过激活B细胞的PKCδ-NF-κB途径和直接诱导NF-κB蛋白表达实现的。此外,IngB与溴域及其外域抑制剂JQ1在潜伏的HIV激活作用中表现出了协同激活作用,并且使用IngB后CD4受体和CXCR4共受体均下调,起到了实现在激活潜伏HIV-1的同时还能抑制新一轮的HIV感染[28-29]。
EK-16A是从甘遂E.kansuiS.L.Liou ex S.B.Ho的干燥根中分离出来的一种巨大戟二萜醇衍生物。在激活潜伏HIV-1方面显示出巨大的潜力,且活性比prostratin强200倍。研究表明,EK-16A在能稳定表达HIV-1的人肾上皮C11细胞系模型上激活HIV的EC50值为3.53 nmol/L,CC50值为68.51 μmol/L,选择指数为19 408;在急性T淋巴细胞白血病J-Lat 10.6细胞上激活HIV的EC50为4.06 nmol/L,CC50值94.17 μmol/L,选择指数为23 195;EK-16A均表现出较好的选择性。EK-16A激活作用机制的研究表明EK-16A是一种PKCγ激活剂,PKCγ的激活既能促进NF-κB的转录启动,又能促进p-TEFb信号通路的延长实现潜伏HIV的激活[30]。
1.1.3 瑞香烷型二萜 gnidimacrin最初是从近心格尼迪木Gnidia subcordataMeisn.中分离得到的一种PKC激活剂。它在HIV感染的人T细胞ACH-2和HIV感染的人组织细胞淋巴瘤U1细胞2种模型中激活潜伏HIV的作用至少是prostratin的2000倍,同时还能在浓度低至10 pmol/L上抑制PBMCs细胞中HIV R5病毒的感染,这与其作用于PKCβ从而下调HIV-1协同受体CCR5的作用相关。在患者PBMCs细胞离体模型中,gnidimacrin抗R5活性会被一种PKCβ的抑制剂消除,这是因为gnidimacrin能够通过选择性激活PKCβI和PKCβⅡ进而激活潜伏HIV-1,并特异性地杀伤HIV-1持续感染的细胞[31-33]。
1.1.4 麻风树烷型二萜 Appendino等[34]从冬大戟E.hybernaL.的地上部分中分离出来的麻风树烷型二萜SJ23B,属于PKCα和PKCδ激活剂。在急性T淋巴细胞白血病Jurkat-Lat-GFP细胞株中,SJ23B激活HIV-1基因表达比prostratin至少强10倍。另外,SJ23B可以诱导HIV-1受体CD4、CXCR4和CCR5的表达下降,并在纳摩尔范围内阻止R5和X4病毒在人原代T细胞中的感染[34-35]。
1.1.5 续随子烷型二萜 从E.officinarumLinn.中分离得到的续随子烷型二萜8-methoxyingol 7,12-diacetate 3-phenylacetate是一种通过影响有丝分裂进而激活潜伏HIV-1的天然产物。在向急性T淋巴细胞白血病Jurkat细胞株中转染了由HIV-LTR启动子驱动的含有绿色荧光蛋白(green fluorescent protein,GFP)基因的重组病毒的细胞模型Jurkat-LTR-GFP中,用8-methoxyingol 7,12-diacetate 3-phenylacetate处理后可以导致细胞周期阻滞,表现为G0/G1期的百分比增加。进一步研究发现该化合物浓度相关性地激活HIV-1-LTR启动子,表现出激活潜伏HIV作用[36]。
3,12-di-O-acetyl-8-O-tigloylingol是从帝锦E.lacteaHaw.中分离得到的又一个具有激活HIV潜伏作用的续随子烷型二萜。该化合物在5 μg/mL时能够诱导Jurkat-LTR-GFP的表达高达84.3%。但是这一激活作用,在使用了PKC抑制剂后其激活作用就消失了,这表明该化合物也是通过PKC途径起到的激活作用[37-38]。
二萜类HIV-1潜伏激活剂的化学结构见图2。
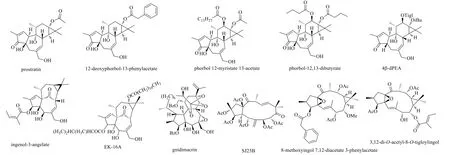
图2 二萜类HIV-1潜伏激活剂的化学结构Fig.2 Chemical structures of diterpenoid HIV-1 latency reactivation agents
1.2 二倍半萜类化合物
alotaketal C、ansellone A、alotaketal D和anvilone A是从一种海绵Phorbassp.中分离得到的二倍半萜类结构。其中alotaketal C在30 μmol/L时会诱导急性T淋巴细胞白血病J-Lat 9.2细胞模型中GFP的表达为(13.8±2.2)%,激活作用最强,是相同浓度下prostratin的2.1倍,但毒性更强[CC50为(11.0±7.8)μmol/L]。此外,加入PKC抑制剂后,alotaketal C的激活作用会被消减85%以上,说明这类二倍半萜的激活潜伏HIV的途径是经过激活PKC所实现的[39]。二倍半萜HIV-1潜伏激活剂的化学结构见图3。
1.3 三萜类化合物
HHODC是从Ocimum labiatum(N.E.Br.) A.J.Paton的新鲜叶片中分离得到的一种乌苏烷型三萜类化合物。通过采集HIV-1感染U1潜伏期细胞模型中的HIV-1 p24抗原发现,HHODC质量浓度分别为2、4、6、8 μg/mL时,诱导患者外周血单核细胞中HIV-1 p24的招募能增加1.3、2.7、4.8、7.3倍。进一步研究发现该化合物的激活作用可能是通过上调IL-2、IL-6、肿瘤坏死因子-α(tumor necrosis factorα,TNF-α)、血清γ干扰素(interferon-γ,INF-γ)等细胞因子的生成进而实现的,但是该化合物不显著抑制HDAC,也不激活PKC[40]。三萜类HIV-1潜伏激活剂的化学结构见图3。
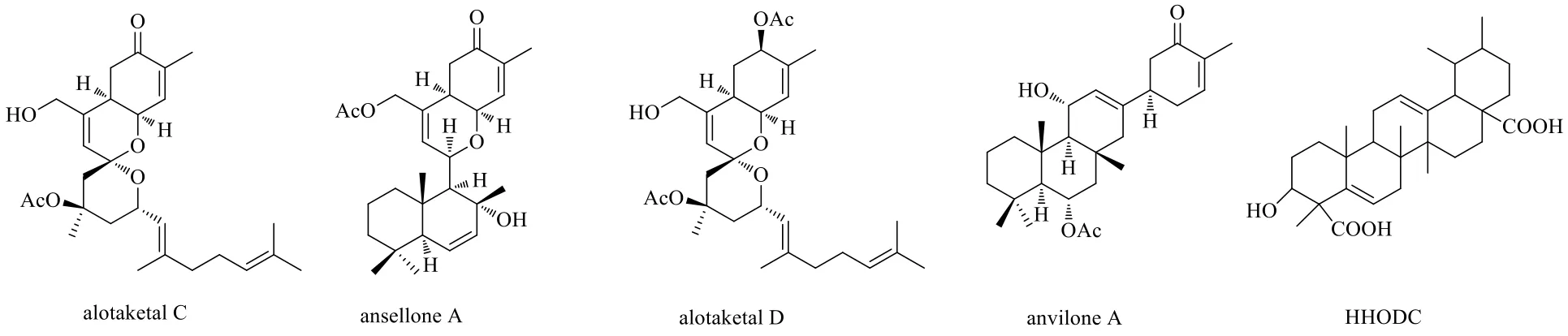
图3 二倍半萜和三萜类HIV-1潜伏激活剂的化学结构Fig.3 Chemical structures of sesterterpenoid and triterpenoid HIV-1 latency reactivation agents
2 生物碱类化合物
morphine是1806年德国化学家从罂粟Papaver somniferumL.的蒴果中分离得到的生物碱,heroin是以吗啡碱为原料合成的化合物。二者浓度高于1 mmol/L时,在ACH-2细胞模型中均显示出了浓度相关的HIV潜伏激活活性。但是它们的激活作用却不是通过阿片受体起作用的,而是由于此类药物的浓度高于1 mmol/L时造成了细胞毒性,从而引起细胞坏死的附带效应,如活性氧的激活和NF-κB信号通路的激活相关[41]。
de Souza Araújo等[42]从柄果林辕木Unonopsis stipitataDiels的叶中分离得到的氧海罂粟碱是一种苄基异喹啉类生物碱。研究表明,该化合物不仅在HIV感染的急性T淋巴细胞白血病J89GFP细胞株、U1和ACH-2这3种细胞模型中具有激活潜伏HIV-1的作用;同时用它处理的来自4个HIV-1患者的CD8+缺失的外周血单个核细胞时,有3个个体表现出了病毒的激活。而且,该化合物在激活病毒的同时不会诱导周身T细胞的激活。进一步研究发现,该化合物是磷脂酰肌醇3-激酶(phosphatidyl inositol 3-kinase,PI3K)的激动剂,能够特异性地作用于p110α亚型,但是对p110β、δ或γ亚型没有特异性,所以该化合物可能是通过PI3K/蛋白激酶B(protein kinase B,PKB/Akt)信号通路激活潜伏HIV-1的[43]。
mitomycin C是从头状链霉菌Streptomyces caespitosus的代谢物中分离得到的一种天然广谱抗癌药物。研究表明,在大鼠RFB HIVl-1和人SVTG HIVI-1这2种细胞系模型中,10 pg/mL mitomycin C可以使它们中的HIV LTR的乙酰转移酶活性表达分别提高77、3.1倍。其机制可能是该化合物通过内源性NF-κB产生超氧自由基介导产生HIV-1 LTR转录激活作用的[44]。
psammaplin A是来源于双海绵体系Poecillastrasp.和Jaspissp.的一种HDACi。研究显示它与prostratin联合治疗可协同增强HIV-1表达,而与帕比司他(一种HDACi)联合治疗时相反,说明psammaplin A是作为HDACi类的潜伏激活剂起作用的,但是psammaplin A是一种比panobinostat激活效果弱的潜伏激活剂[45-46]。
chaetocin是从毛壳菌属Chaetomium的代谢物中分离到的一种组蛋白甲基转移酶抑制剂。研究显示,在J-Lat 15.4细胞系模型中,该化合物以剂量相关的方式激活HIV-1,而且它能够诱导从患者体内分离得到的CD8+缺失的外周血单个核细胞中50%HIV-1表达,对86% HIV-1感染的静息CD4+T细胞中的病毒具有激活作用,最适宜的潜伏激活浓度为90 nmol/L[47-48]。
生物碱类HIV-1潜伏激活剂的化学结构见图4。
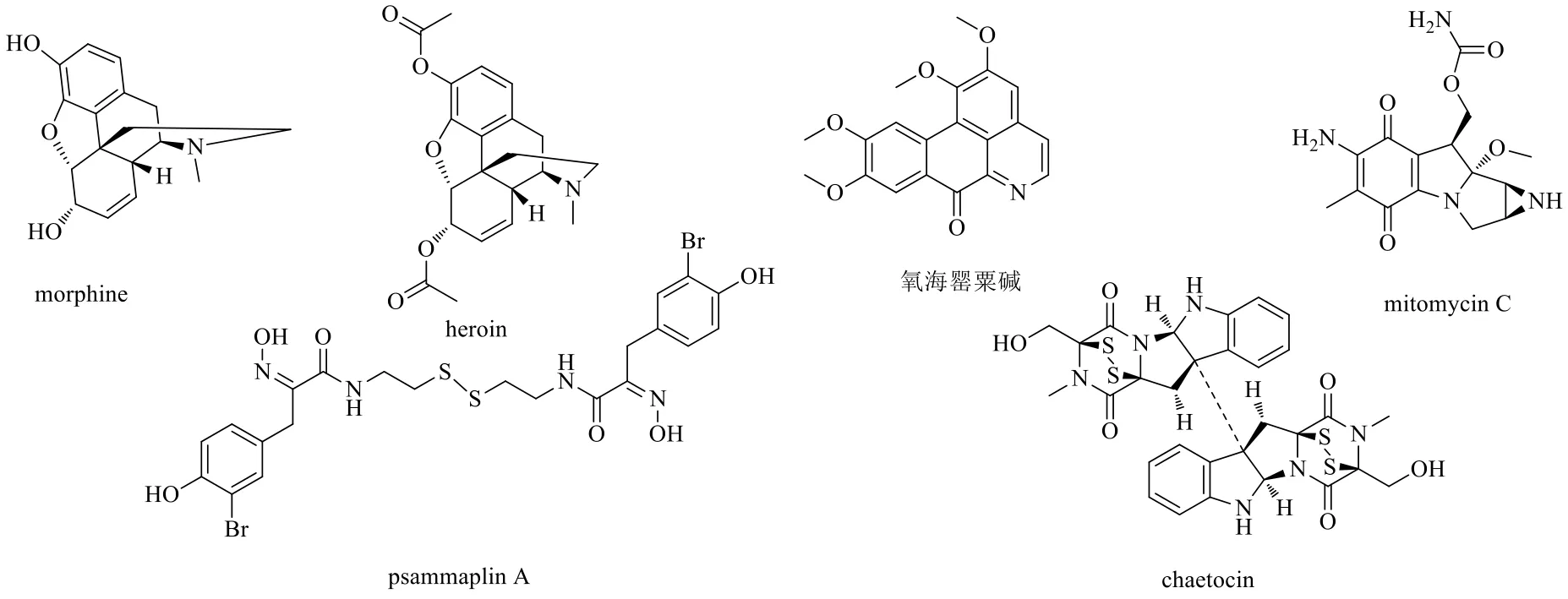
图4 生物碱类HIV-1潜伏激活剂的化学结构Fig.4 Chemical structures of alkaloid HIV-1 latency reactivation agents
3 酚类化合物
3.1 香豆素类化合物
研究表明有些香豆素类化合物可作为有效的非核苷逆转录酶抑制剂,另一些可作为艾滋病毒整合酶或艾滋病毒蛋白酶抑制剂。scoparone是从传统中药滨蒿Artemisia scopariaWaldst.et Kit.中分离得到的香豆素类化合物,它对HIV-1的激活与NF-κB信号通路相关。hymecromone也是香豆素类化合物。研究显示,在C11细胞模型中,scoparone和hymecromone的剂量分别从300 μmol/L增加到600 μmol/L,可以观察到HIV-1的表达分别从17.11%上升到30.51%和从5.96%上升到12.94%;在J-Lat A10.6细胞中分别显示从13.29%上升到25.32%和从5.44%上升到10.38%。它们是浓度相关性地激活潜伏病毒的,且这种激活不会引起周身T细胞活化[49]。
3.2 多酚类化合物
nordihydroguaiaretic acid、curcumin和1-cinnamoyl-3,11-dihydroxymeliacarpin分别是从三齿拉雷亚灌木Larrea tridentate(Sessé & Moc.ex DC.) Coville叶、姜黄Curcuma longaL.根茎和楝Melia azedarachL.叶片中分离得到的多酚类化合物。研究显示它们三者的共同特点是具有免疫调节作用,其中nordihydroguaiaretic acid在U1潜伏期细胞模型中通过上调细胞中的p24抗原来增加活性氧的产生实现潜伏期HIV-1的激活。curcumin能与HIV蛋白酶和整合酶相结合,在μmol/L级别就可以抑制HIV整合酶,抑制反式转录激活因子(trans activator of transcription,TAT)蛋白活化,抑制TAT-1蛋白的乙酰化和HIV的复制,增强HIV-1持续感染细胞的抗逆转录病毒活性,可以调节许多转录因子、细胞因子、蛋白激酶、黏附分子、氧化还原状态和与炎症有关的酶,在治疗感染HIV患者时有双重作用。1-cinnamoyl-3,11-dihydroxymeliacarpin通过调节细胞因子(IL-6、TNF-α)实现潜伏期HIV-1的激活[50-53]。
3.3 黄酮类化合物
REJ-C1G3是从虎杖Polygonum cuspidatumSieb.et根茎中分离出来的原花青素三聚体化合物。实验显示,REJ-C1G3在Jurkat T A2细胞中对HIVLTR GFP的表达呈现时间和浓度相关性,但激活效果远不如prostratin。进一步研究发现REJ-C1G3对病毒的激活是和Tat蛋白的激活相关的。在Jurkat T细胞中,REJ-C1G3能诱导细胞7SK小核核糖核蛋白(small nuclear ribonucleoproteins,snRNP)释放p-TEFb,进而激活Tat来增强潜伏HIV-1的转录活性[54]。
原花青素C1是从可可Theobroma cacaoL.中分离出的一种原花青素三聚体结构。实验显示,该化合物同样能够在Jurkat T A2显示出激活潜伏HIV的作用,具有浓度相关性,但激活效果远不如PMA。进一步研究发现,原花青素C1的激活作用是依赖于NF-κB和丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)的激活实现的。但是该化合物的激活作用并不会被PKC抑制剂所拮抗,说明该化合物的激活不是依赖于蛋白激酶C[55]。
酚类HIV-1潜伏激活剂的化学结构见图5。
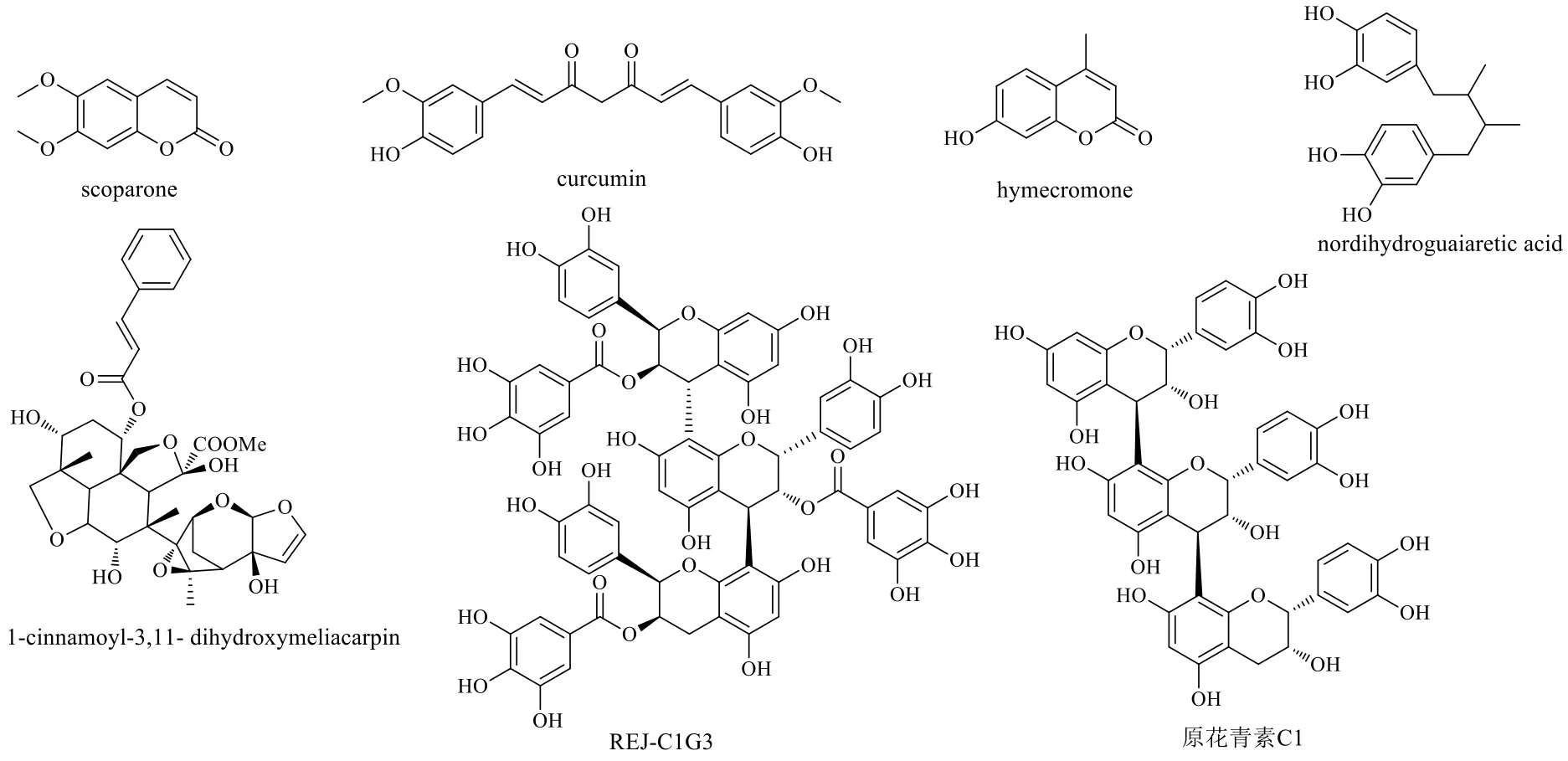
图5 酚类HIV-1潜伏激活剂的化学结构Fig.5 Chemical structures of phenolic HIV-1 latency reactivation agents
4 其他
其他类化合物主要包括肽类、大环内酯类、固醇类、多不饱和脂肪酸类和羧酸衍生物类化合物,化学结构见图6。

图6 其他类HIV-1潜伏激活剂的化学结构Fig.6 Chemical structures of other HIV-1 latency reactivation agents
4.1 肽类化合物
apicidin是从镰刀菌Fusarium pallidoroseum(Cooke) Sacc.的代谢物中分离得到的一种新型类环状四肽,是一种寄生虫和抗原生物活性的抗生素类物质,属于HDACi。在J-Lat 10.6细胞中,apicidin的浓度0.25~1 μmol/L,GFP表达的细胞百分比7.5%~24.9%,表现为浓度相关性,且apicidin在1 μmol/L时表现出最高的病毒再激活活性。此外,该化合物与prostratin联用能够起到协同激活潜伏HIV-1的效果。研究显示apicidin可能是通过增加JLat 10.6细胞中HIV-1 LTR中单一核小体(nuc-1)的H3和H4的乙酰化水平来诱导HIV-1再激活的[56-58]。
romidepsin是从紫色色杆菌Chromobacterium violaceumBergonzini代谢物中分离得到的环肽类结构,属于HDACi。研究表示,对6名已接受抗逆转录病毒疗法治疗的成年人患者iv romidepsin 5 mg/m2,1次/周。持续3周后,6名患者中HIV-1转录和血浆的HIV-1 RNA明显增加(从<20 copy/mL增加到46~103 copy/mL)。但也有研究表明,该化合物对外周血单个核细胞和CD4+T细胞中HIV的感染具有显著的抑制作用,会显著地削弱静息CD4+T细胞的增殖和活力,预示该化合物不太可能激活潜伏的T细胞库[59-60]。
4.2 大环内酯类化合物
Oura等[61]从结节链霉菌Streptomyces nodosusTrejo中发现了大环内酯结构amphotericin B,它是一种抗真菌药物。研究显示在HIV潜伏感染的单核细胞/巨噬细胞系THP89GFP模型中,amphotericin B能起到激活潜伏感染HIV-1的效果。amphotericin B不能直接刺激J89GFP等T细胞表现出激活活性,但是当T细胞与THP89GFP细胞共培养时,该化合物表现出对这些细胞中HIV-1的反式激活诱导活性[62-63]。
bryostatin 1最初是从海洋生物草苔虫Bugula neritinaL.中分离出来的大环内酯结构,后来发现细菌共生生物Candidatus Endobugula sertula也能产生。研究显示,在Jurkat-LAT-GFP细胞模型中,该化合物通过激活PKC途径,激活MAPKs和NF-κB通路,并与HDACi协同作用来激活潜伏HIV-1。同时,bryostatin 1还可以通过下调HIV-1共受体CD4和CXCR4的表达来阻止易感细胞中HIV-1的从头感染起到双重作用。更重要的是,该化合物可以下调外周血T细胞中CD4表达但不诱导T细胞增殖。该化合物的激活效果可以达到prostratin的25~1000倍,已经批准进入治疗HIV的药物临床研究[63-67]。
debromoaplysiatoxin和aplysiatoxin是从2种海绵Poecillastrasp.和Jaspissp.中分离得到的大环内酯类结构,属于PKC激活剂。研究显示,在J-Lat 8.4细胞模型中,aplysiatoxin在比prostratin浓度低900倍时可以达到与prostratin相似的激活效果,EC50为(0.011±0.003)μmol/L;debromoaplysiatoxin的活性比prostratin强19.2倍,EC50为(0.52±0.02)μmol/L,这2种化合物在HIV-1激活活性浓度范围内对细胞没有实质性的毒性作用。此外,二者与panobinostat联用激活潜伏HIV-1时表现出协同作用,与prostratin联用时表现为拮抗作用[45-46]。
4.3 固醇类化合物
1α,25-dihydroxyvitamin D3(vitD3)是所熟知的一类广泛存在于鱼类、动物肝脏类、果蔬、谷物等食品中的维生素。453 HIV-luc绿色荧光报告基因对宫颈癌HeLa细胞进行瞬时转染后,75 nmol/L vitD3处理后能产生50% GFP诱导,并且呈现剂量相关性,其作用机制依赖于维生素D受体[68]。
4.4 多不饱和脂肪酸类化合物
花生四烯酸是一种从鱼油中提取的多不饱和的必需脂肪酸,广泛存在于自然界。花生四烯酸处理后人原核细胞中氯霉素酰基转移酶报告基因在HIV-1 LTR的控制下被强烈诱导表达,表现出激活潜伏HIV作用。但是,花生四烯酸却没有直接激活潜伏HIV-1,原因是通过脂氧合酶和环氧合酶途径的抑制剂抑制了花生四烯酸对HIV-1 LTR的激活,表明这一激活效果应该是它的代谢物起到了激活作用。此外,鱼油中其他n-3脂肪酸如二十碳五烯酸在对氯霉素酰基转移酶报告基因激活中却没有表现出激活作用。以上数据表明,花生四烯酸激活潜伏HIV的机制可能存在其他方式[69]。
4.5 羧酸衍生物类化合物
trichostatin A是从吸水链霉菌Streptomyces hygroscopicus的代谢物中分离得到的一个羧酸衍生物,具有抗菌作用。1 μmol/L和300 nmol/L trichostatin A分别处理THP89GFP和J89GFP细胞系模型后,HIV-1的潜伏激活效果分别为82%、34%[70-71]。
5 结语
迄今为止已报道具有激活潜伏HIV作用的天然产物主要有38个,结构类型涉及到萜类、黄酮类、生物碱类等,其分类、来源以及机制见表1。许多化合物均表现出了高效低毒的激活作用,其中化合物prostratin和bryostatin 1均已进入临床研究。这不仅预示着“shock and kill”策略的可行性,更是彰显了天然产物能作为HIV潜伏激活剂来源的重要证据。天然产物结构多样,来源丰富,不同母核结构的化合物作用机制不同,母核相同的也会因为取代基不同而表现出不同的激活活性。有些天然产物,如prostratin、gnidimacrin等表现出了在激活潜伏病毒的同时还表现出抑制周围靶细胞再感染的活性,为实现艾滋病的功能性治愈提供了有效方法,也为后续寻找治疗艾滋病的药物提供了科学依据。可见,天然产物应该成为艾滋病潜伏激活剂发现的重要源泉,为艾滋病药物的研发提供重要的思路和途径。
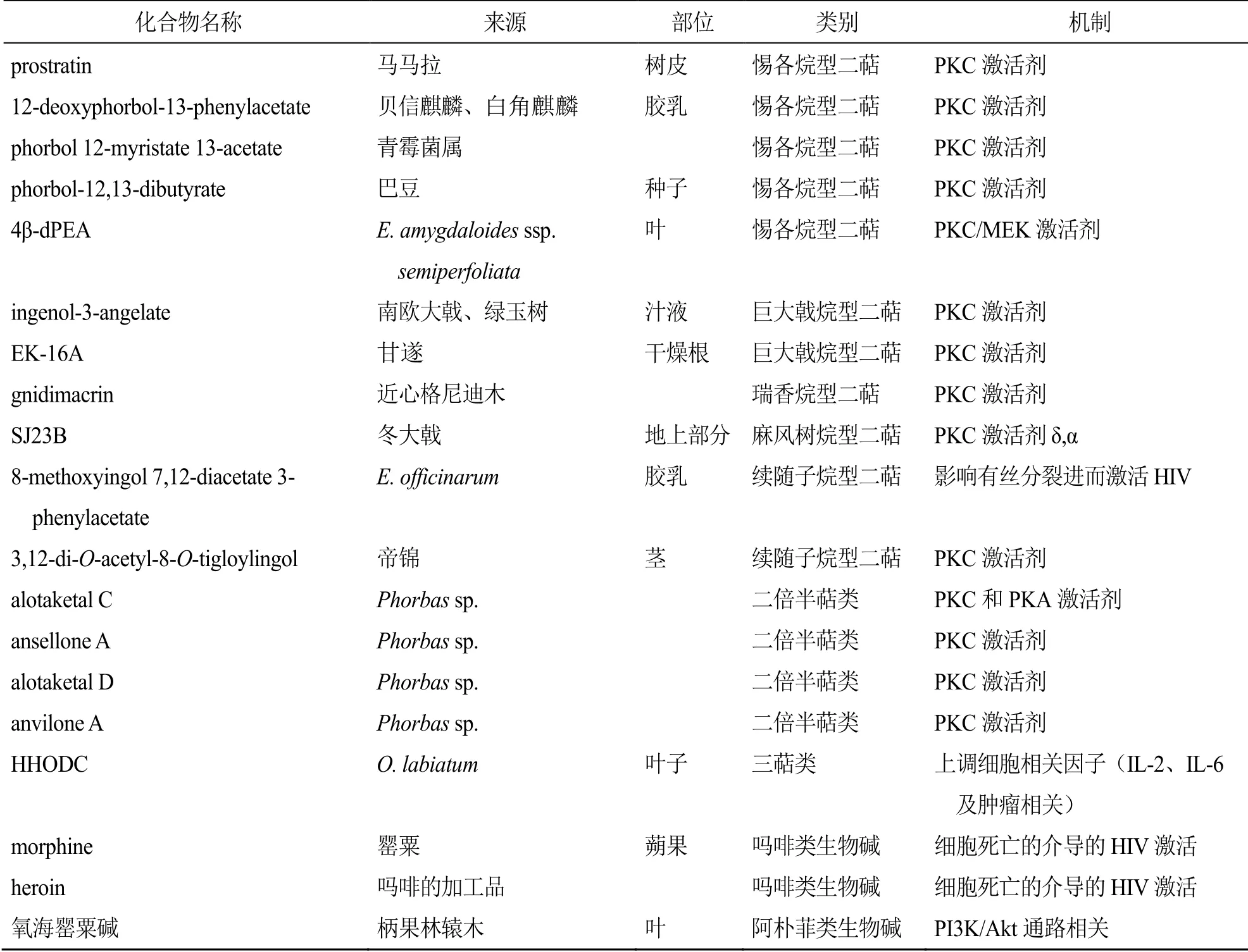
表1 天然产物HIV-1潜伏激活剂的分类、来源以及机制Table 1 Classification, origin and mechanism of natural product HIV-1 latency reactivation agents
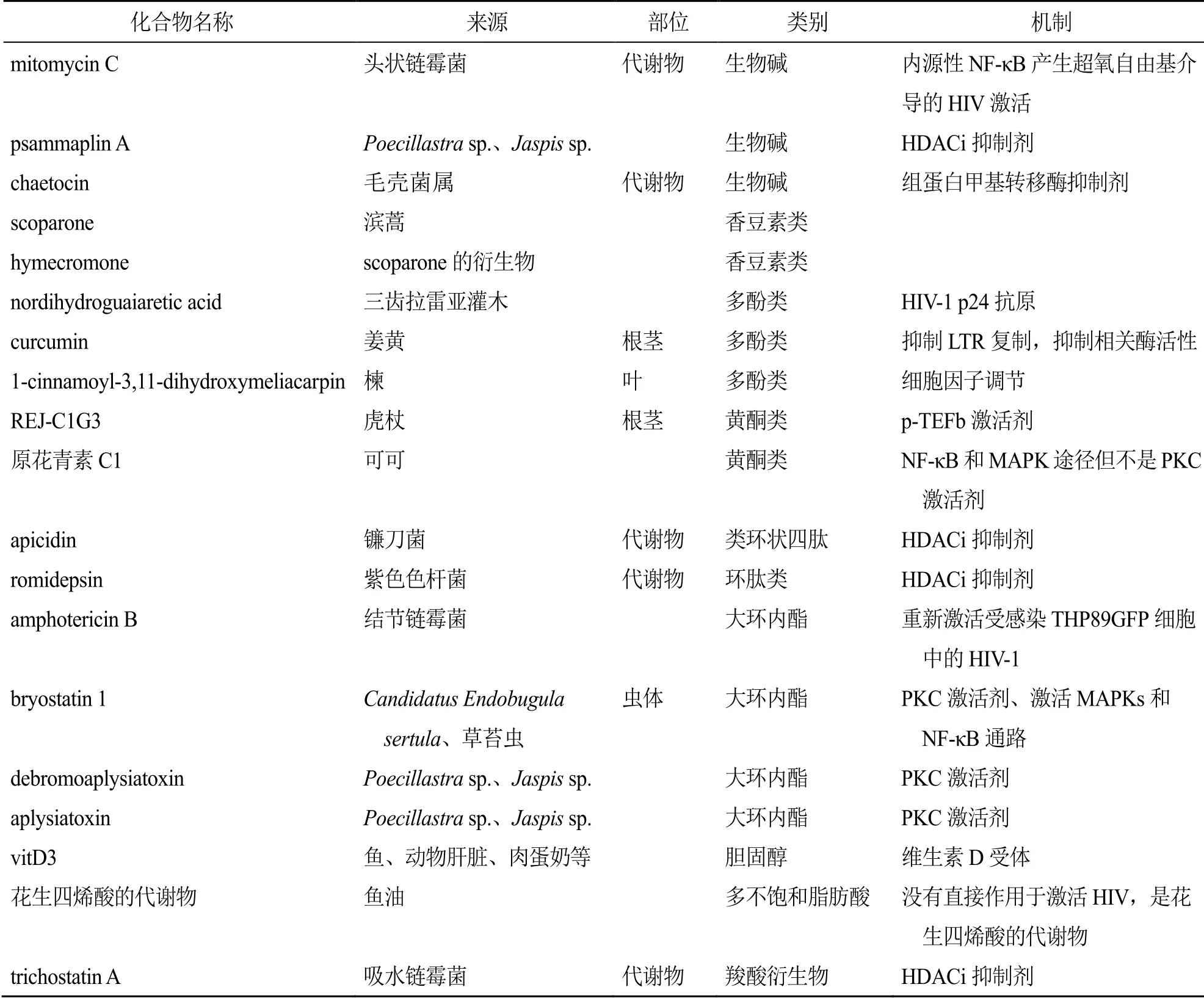
续表1
当然,不可否认的是研究中仍然面临着巨大的问题与挑战。时至今日报道的诸多天然产物来源的HIV-1潜伏激活剂仍无法做到完全激活患者体内的病毒储库。而且这些激活作用的发现主要停留在细胞层面,动物层面的研究难度相对较大,有关报道也较少,需要更多的动物模型和临床科学数据。此外,天然产物激活潜伏HIV的作用机制研究不够深入,尽管已报道了众多天然产物HIV潜伏激活剂,但是从表1中可以发现,其作用机制主要围绕PKC激活等经典途径。众所周知,PKCs是一类重要的激酶,有16种亚型,分为经典型、新型和非经典型。研究表明不同的PKC亚型在细胞中存在不同功能,甚至同一PKC亚型在不同生物种属中可以表现出不同甚至相反的作用[72]。这或许就是作为PKC激活剂的prostratin和bryostatin 1,虽然已进入临床研究多年,但目前仍无任何报道的原因。
即便如此,我们仍然相信在艾滋病药物的研发上,尤其是在HIV潜伏激活剂的发现上,天然产物具有独特的优势和成功的可能。其一,天然产物结构多样,来源丰富,这些丰富的结构在治疗艾滋病药物的发现上具有天然的优势;其二,多样的天然产物结构带来多样的药效作用,这些药效作用往往会起到多样的作用机制和特殊的作用靶点。
利益冲突所有作者均声明不存在利益冲突