外泌体与卵巢癌耐药及治疗的关系研究进展
何玲玲 孙亮亮 俞晓雲 李睿彦 王海琳
卵巢癌(ovarian cancer,OC)是全球女性最具威胁生命的恶性肿瘤之一,在女性常见恶性肿瘤中位居第七,癌症相关死亡中位居第八位,5年生存率低于45%[1]。由于卵巢位于骨盆内,位置隐匿,早期无症状,导致大多患者确诊时为晚期,即使初诊时行手术治疗联合足疗程化疗,多数患者仍在两年内复发,复发患者由于经历多次化疗而对化疗药物耐药是导致治疗失败的主要原因[2]。化疗耐药与细胞信号通路在分子水平上的激活有关,明确OC耐药发生的分子机制并进行靶向干预,可能是克服OC耐药并改善患者预后的有效途径。外泌体(Exosomes)是由多种细胞分泌的具有脂质双层膜结构的微囊,大小在40~150 nm[3]。外泌体含有多种生物活性物质,如核酸、蛋白质和脂质,它通过释放生物活性物质,与受体细胞膜融合或细胞表面受体结合,在细胞间的信息交流中起着重要作用。研究表明,外泌体与多种肿瘤细胞和肿瘤微环境中细胞间化疗耐药的传递过程有关,如乳腺癌、前列腺癌、OC等[4]。外泌体参与肿瘤的发生发展,影响肿瘤的耐药性,在临床上具有作为肿瘤标志物、治疗靶点及药物纳米载体的潜在临床应用价值[5]。本文综述外泌体参与OC耐药的机制及其在靶向治疗中的价值,为今后OC靶向治疗的研究提供新思路。
1 外泌体与OC
卵巢肿瘤细胞及其微环境均与肿瘤的进展和转移密切相关。肿瘤微环境由肿瘤细胞与非肿瘤细胞、细胞外基质、细胞因子及胞外囊泡组成。缺氧是促进上皮性肿瘤扩散的关键因素。卵巢肿瘤本质上处于缺氧微环境中,缺氧可以通过上调Rab27a、下调Rab7、溶酶体相关膜蛋白1和2(LAMP1/2)、神经氨酸酶(NEU1)以及促进溶酶体的分泌表型增加卵巢癌外泌体的释放[6]。存在于OC微环境中的外泌体通过与受体细胞膜相互作用参与OC的发生发展、转移、免疫反应和化疗耐药[7]。
1.1 外泌体调控肿瘤微环境 OC不同于其他恶性肿瘤的是具有一个特定的肿瘤微环境,腹水在OC扩散中起着重要作用[8]。>1/3的OC患者确诊时伴有腹水,几乎复发患者均有腹水[9]。恶性腹水富含细胞因子、生长因子及各种促炎和免疫抑制因子,共同形成促进肿瘤生长的微环境,并介导对化疗药物的耐药[10]。腹水中的外泌体通过信号转导在此过程中发挥了关键作用。Cho等[11]证明OC来源的外泌体可以诱导脂肪间充质干细胞(adipose mesenchymal stem cells,AMSC)表现出肿瘤相关成纤维细胞(CAF)的典型特征,并通过增加转化生长因子-β(transforming growth factor,TGF-β)的分泌激活SMAD依赖性途径和非SMAD依赖性途径从而促进肿瘤进展及侵袭。此外,外泌体中的miRNA通过调节基因表达在OC进展中发挥作用。OC来源的外泌体可以将miR-222-3p转移到巨噬细胞,通过SOCS3/STAT3通路诱导肿瘤相关巨噬细胞(tumor-associated macrophages,TAMS)产生,促进OC细胞增殖、血管生成、免疫抑制、侵袭及转移[12,13]。总之,OC来源的外泌体参与肿瘤微环境的调控,从而促进肿瘤进展。
1.2 外泌体调节肿瘤免疫反应 肿瘤细胞与免疫细胞在肿瘤微环境中的动态相互作用参与了OC化疗耐药及肿瘤进展。肿瘤来源的外泌体通过几种不同的机制抑制免疫系统。腹水来源的外泌体可被单核细胞摄取,激活TOLL样受体(TLR)依赖的信号通路,诱导IL-1β、TNF-α、IL-6等细胞因子分泌增加,从而导致免疫抑制[14]。此外,肿瘤来源的外泌体可以促进免疫抑制性细胞的分化来增强免疫抑制,包括骨髓源性抑制细胞(MDSC)、TAMS和调节性T细胞(Tregs)。MDSC可以负性调控抗原的加工和呈递,促进免疫抑制因子的分泌,抑制免疫应答[15,16]。外泌体还可通过Fas/FasL诱导T细胞凋亡或通过NKG2D配体下调NK细胞活性[17,18]。外泌体对肿瘤微环境中免疫细胞的调节是相当复杂的,了解它们相互作用的机制能为肿瘤的治疗提供一种新视野。
2 外泌体参与OC耐药的机制
目前,化疗耐药是肿瘤治疗面临的主要挑战,阐明肿瘤发生和耐药的分子机制对研究肿瘤治疗新策略至关重要。外泌体参与OC耐药的机制包括传递耐药相关miRNA至受体细胞调节基因表达、通过药物转运蛋白减少细胞内药物浓度和诱导上皮-间质转化(EMT)来诱导化疗耐药。
2.1 外泌体通过转移耐药相关miRNA诱导OC耐药 近年来外泌体中的microRNA(miRNA) 在OC耐药中的作用备受关注。miRNA是由19-25个核苷酸组成的短链非编码RNA,能调节靶基因的转录后沉默,在OC耐药中发挥重要作用。外泌体在细胞间传递耐药相关miRNA诱导化疗耐药。Au Yeung等[19]研究表明癌症相关脂肪细胞(CAA)和CAF来源的外泌体高度表达miR-21,并通过抑制凋亡蛋白酶激活因子1(AFAP1)抑制OC细胞凋亡,并且通过靶向TGF信号通路间接上调基质金属蛋白酶1(MMP-1),这可能导致OC细胞侵袭能力增加,诱导OC细胞化疗耐药。研究表明,缺氧的OC细胞引导巨噬细胞募集并诱导其成为TAM样表型,它释放的外泌体富含miR-233,并可转移到共培养的OC细胞中,同时增强肿瘤细胞的耐药性及恶性表型,miR-233在体内外均通过PTEN-PI3K/AKT途径促进OC细胞的耐药性,并且外周循环中miR-233 的水平与OC的复发密切相关[20]。此外,OC细胞表达的miR-433通过下调细胞周期蛋白依赖性激酶6(CKD6)和诱导细胞衰老来促进OC细胞对紫杉醇的耐药性[21]。Guo等[22]研究表明CAF分泌的外泌体富含miR98-5p,它可以通过靶向抑制细胞周期蛋白依赖性激酶抑制剂1A(CDKN1A)的表达抑制细胞凋亡,并介导OC细胞对顺铂的耐药性。当然,外泌体中的某些microRNA能够降低肿瘤细胞对化疗药物的耐药性。Liu等[23]研究表明对顺铂耐药的OC细胞来源的外泌体中的miR-30a-5p在体内外均能通过下调SOX9表达,增加OC细胞的凋亡从而增强细胞对顺铂的敏感性,而耐药OC细胞中的miR-30a-5p表达明显降低,因此含有miR-30a-5p的外泌体可能是OC耐药的一个新的治疗靶点。可以看出,外泌体中的miRNA对OC化疗耐药的调控是极其复杂的,除了上述miRNA外,外泌体中的其他miRNA也可能参与了OC的化疗耐药,需要进一步的实验来阐明它们参与耐药的分子机制。
2.2 外泌体通过输出转运蛋白诱导OC耐药 外泌体中除了miRNA外还有多种蛋白质,已有研究证明蛋白质与OC耐药的关系,提示外泌体可以通过输出转运蛋白来诱导OC耐药。药物代谢分子和某些蛋白质由肿瘤细胞产生的外泌体释放到细胞外环境。Safaei等[24]的研究发现铂耐药的OC细胞释放的外泌体中铂含量是铂敏感细胞的2.6倍,同时铂耐药细胞分泌的外泌体释放更多的顺铂输出转运蛋白如耐药相关蛋白2(MRP2)、铜离子转出蛋白A(ATP7A)、铜离子转出蛋白B(ATP7B)和LAMP1。通过蛋白质组学分析发现Ca2+和磷脂结合膜联蛋白家族的成员Annexin a3在铂耐药OC细胞系中明显增加,它可能通过阻止细胞对铂的摄取或累积介导OC耐药,Annexin a3的分泌可能与胞吐作用及外泌体的释放有关,并且表达较高水平Annexin a3的OC细胞分泌更多的外泌体[25,26]。
P-糖蛋白(p-gp)是由多药耐药基因1(MDR-1)编码的170 kDa的蛋白,参与多种肿瘤的耐药。P-gp通过促进细胞内药物的排出降低细胞内药物浓度介导化疗耐药。Zhang等[27]研究表明在膜结合蛋白水平上,p-gp通过微囊的细胞间转移实现在人OC细胞间“共享”。与野生型亲本系相比(A2780/WT)相比,紫杉醇耐药的人OC(A2780/PTX)更容易形成并释放含有更多p-gp的微囊。微囊以时间和剂量依赖性方式与化疗敏感的A2780/WT细胞结合,微囊介导的p-gp转移致受体细胞(A2780/WT)对阿霉素和紫杉醇耐药性均提高5倍。微囊和外泌体均属于细胞外囊泡,外泌体p-gp已被证明可以诱导乳腺癌的耐药,因此外泌体也可能通过转移p-gp诱导OC耐药[28]。此外,外泌体中也富含甲基转移酶(DNMT1),它在DNA复制和修复过程维持全基因组的甲基化中有着重要作用,DNA的甲基化通过调节基因表达参与肿瘤耐药。Cao等[29]用顺铂处理SKOV3细胞,未暴露于外泌体的SKOV3细胞的凋亡率明显高于暴露组,而外泌体抑制剂GW4869能恢复耐药细胞的敏感性。综上所述,肿瘤微环境中的外泌体可以通过携带各种输出转运蛋白诱导OC耐药。
2.3 外泌体通过诱导EMT诱导OC耐药 EMT是指从上皮细胞到间质细胞的转化,EMT可赋予细胞转移和侵袭的能力,包括获得干细胞特征、减少细胞凋亡,促进免疫抑制。EMT是肿瘤免受细胞毒药物作用的耐药机制之一[30]。Crow等[31]用耐药OC A2780的衍生细胞产生的外泌体处理A2780细胞,结果显示上皮性标志物dystroglycan、E-cadherin和上皮细胞粘附分子(EpCAM)表达明显下降,而间充质标志物paladin、TWIST、和Vimentian明显上调。Li等[32]研究表明CAF分泌的外泌体中TGFβ1明显上调,并通过激活SMAD信号通路促进卵巢肿瘤的EMT,增加OC的耐药性及侵袭性。Yew等[33]研究发现表皮形态发生素(Epimorphin)可以逆转OC的EMT,使OC细胞可以从间质表型转化为上皮表型,从而增强对一线化疗药物的敏感性。总之,外泌体通过诱导肿瘤细胞产生EMT的细胞形态学特征参与OC化疗耐药,逆转EMT可能可以提高OC细胞的敏感性。见图1。
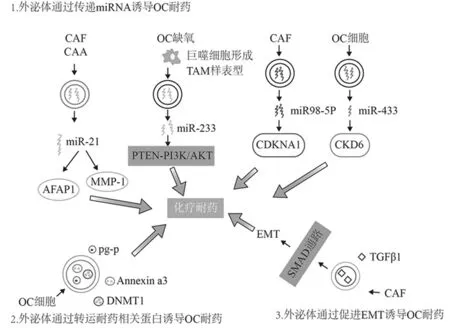
图1 外泌体诱导OC耐药的机制
3 外泌体在OC耐药患者治疗中的临床价值
外泌体通过多种生物学机制影响肿瘤的发生发展。随着人们对外泌体在肿瘤发生发展中的作用的了解,人们正在研究和开发外泌体在OC治疗领域的应用,如调节外泌体的分泌、利用外泌体增强抗肿瘤免疫、利用外泌体的归巢效应以及将外泌体作为运输药物的载体,这些研究为OC患者的治疗带来了新的希望。
3.1 调节外泌体的产生及释放 外泌体与肿瘤的发生和发展密切相关,在OC的治疗中,有多种靶向外泌体或利用外泌体的选择。近年来利用外泌体进行治疗的研究主要集中在肿瘤微环境中细胞产生的外泌体的功能上。CAF来源的外泌体可以抑制OC胞凋亡并通过TGF信号通路促进OC细胞的侵袭、迁移和耐药[19],因此,抑制肿瘤微环境中CAF释放外泌体可用于治疗OC。研究表明,用肿瘤坏死因子样弱凋亡诱导剂(TWEAK)处理的巨噬细胞来源的外泌体通过上调miR7的表达抑制OC受体细胞中EGFR/AKT/ERK1/2信号通路进而抑制OC的转移,提示TWEAK刺激的巨噬细胞产生的外泌体miR7在OC的治疗中有良好的应用前景[34]。可以看出,不同细胞来源的外泌体对肿瘤进展过程中的调节作用是不同的,调节肿瘤微环境中不同细胞分泌的外泌体释放可能是治疗OC的有效途径。见表1。

表1 通过调节肿瘤微环境中的外泌体治疗OC的途径
3.2 利用外泌体促进OC的治疗
3.2.2 外泌体作为运输药物的载体:目前,化疗仍然是治疗肿瘤的主要方式。化疗药物的给药方式和耐药机制一直是肿瘤化疗领域的研究热点。过去开发的用于肿瘤治疗的靶向药物控释系统,包括脂质体和纳米颗粒聚合物,增加了给药特异性,减少了药物降解并延长了药物释放时间。但这些药物运输载体能引起严重副作用,包括器官毒性和免疫反应。化疗耐药是肿瘤患者的常见死亡原因。改进化疗药物的给药方式和克服化疗耐药是治疗肿瘤的关键方式。近年来,作为天然纳米颗粒的外泌体被用作载有合成化学药物或特定重组分子的药物运输载体。与现有药物运输载体相比,外泌体作为药物运输载体的优势是有较低的免疫原性和毒性,较高的循环和组织稳定性以及固有的归巢能力[43]。Zhang等[44]用脐带血单核M1巨噬细胞来源的外泌体负载顺铂分别处理铂敏感A2780细胞和铂耐药A2780/DDP细胞,结果显示铂敏感A2780细胞和铂耐药A2780/DDP细胞的细胞毒性作用分别提高1.4倍和3.3倍;用脐带血M2来源的外泌体负载顺铂处理上述两种细胞,结果显示M2巨噬细胞来源的外泌体使顺铂对铂敏感A2780细胞和铂耐药A2780/DDP细胞的细胞毒性作用分别提高1.4倍和1.7倍,可以看出,无论OC耐药性如何,负载顺铂的脐带血M1来源的外泌体能有效提高顺铂的细胞毒性,这种作用可能是由外泌体在肿瘤细胞中的优先累积和M1巨噬细胞对肿瘤细胞的杀伤作用介导的。
通过簇状规则间隔短回文重复序列(CRISPR)相关的核酸内切酶(Cas)9进行基因编辑是抗肿瘤研究中的重要工具 ,有必要开发一种能有效的将其运送至细胞的载体。Kim等[36]研究表明与上皮细胞来源的外泌体相比,肿瘤来源的外泌体能选择性地在SKOV3异种移植小鼠的卵巢肿瘤中积聚,携带CRISPR/Cas的肿瘤来源的外泌体能抑制聚ADP核糖聚合酶-1(PARP-1)的表达,从而诱导OC细胞的凋亡。此外CRISPR/Cas介导的基因编辑对PARP-1的抑制增强了OC细胞对顺铂的敏感性。虽然多种植物提取物在各种癌症中有抗肿瘤作用,但由于缺乏有效的运输载体而限制了其临床应用。有研究表明外泌体作为运输浆果花色苷的载体,可以提高该药在治疗OC方面的生物利用度,有效抑制OC的生长[45]。总的来说,外泌体作为运输治疗药物的载体能明显提高药物对OC的治疗效果,为OC患者的治疗带来了新的希望。
3.2.3 利用外泌体对癌细胞的归巢效应促进OC治疗:卵巢癌分泌的外泌体通过免疫抑制、血管生成、基质细胞重塑和癌基因重新编程诱导转移前生态位的形成。转移前生态位是肿瘤在广泛转移前分泌的外泌体所形成的微环境[46]。利用外泌体对原代癌细胞的归巢作用可以作为OC治疗的靶点。De la Fuente等[47]研究表明将OC腹水来源的外泌体嵌入到工程生物材料中并植入到小鼠腹腔,能产生模拟的人工转移前生态位。该模拟转移前生态位能有效的从腹水中招募游离OC细胞,从而阻止OC细胞向正常的盆腔脏器转移,显著提高生存率。可以看到,这种靶向技术将会是未来肿瘤治疗研究的新领域。
OC严重威胁女性健康,早期诊断困难、转移率高和化疗耐药是导致患者预后差的主要原因。外泌体作为肿瘤微环境中信号转导的载体,在OC的发生发展、耐药及免疫抑制中起着重要作用。外泌体通过转移耐药相关miRNA、药物输出转运蛋白及诱导EMT促进OC的化疗耐药。了解不同细胞来源的外泌体在OC耐药及其发展过程中发挥作用的分子学机制,有助于我们在OC治疗中开发针对外泌体的靶向治疗的新方法,比如抑制OC来源的外泌体释放、利用外泌体携带的TAA增强机体的免疫反应、利用外泌体的归巢效应和外泌体天然纳米颗粒的特性作为药物运输的载体。
——外泌体与老年慢性疾病相关性的研究进展

