长江江豚健康评价体系研究
戴彩姣,唐 斌,郝玉江,王克雄,龚 成,袁军法
长江江豚健康评价体系研究
戴彩姣1,唐 斌2,郝玉江2,王克雄2,龚 成3*,袁军法3*
(1. 华中农业大学水产学院,湖北省水生动物病害防控工程技术研究中心,武汉 430070;2. 中国科学院水生生物研究所,武汉 430072;3. 长江天鹅洲白鱀豚国家级自然保护区,石首 434400)
长江江豚()是目前生活在我国长江流域中仅有的鲸类动物,了解其种群的生理和健康状况对于该物种的保护具有重要指导意义。利用2002—2015年湖北长江天鹅洲白鱀豚国家级自然保护区与鄱阳湖长江江豚省级自然保护区共计136头次长江江豚的体检数据,统计分析了包括血液学和血液生化54个临床指标,结合行为学指标,构建了基于行为与生理健康两个维度的长江江豚健康评价体系,并评估天鹅洲保护区内圈养长江江豚“天天”的健康状况。结果表明,长江江豚的白细胞计数(WBC)、血小板计数(PLT)以及谷草转氨酶(AST)等多个临床指标的生理参数区间同陆生哺乳动物及其他近缘种存在较大差别,显示长江江豚物种的特异性。“天天”的体检结果显示其肝功能、血脂等指标异常。研究结果为长江江豚的健康状况评估和养护提供了科学依据。
长江江豚;血液学;血液生化;健康评价体系
长江江豚()隶属于鲸目(Cetacea)、齿鲸亚目(Odontoceti)、鼠海豚科(Phocoenidae)、江豚属(),是长江流域仅剩的一种小型淡水鲸类动物,主要分布在长江中下游干流及洞庭湖和鄱阳湖两大型通江湖泊中[1]。由于各种人类活动的影响,自20世纪90年代初开始,其种群数量一直呈加速下降趋势[2]。1996 年长江江豚被世界自然保护联盟(International union for conservation of nature, IUCN)物种红色名录列入“濒危物种”[3],2013 年被调整为“极危”物种。根据国家林业和草原局、农业农村部发布了2021年第3号公告[4],长江江豚已经被列为国家一级保护动物,实施最严格的保护和管理。据2017年调查数据显示,长江江豚种群数量约1012头,种群快速衰退趋势得到一定遏制,但保护形势依然严峻[5]。
关于长江江豚,在种群生态学[6-7]、繁殖生理 学[8-9]、生物声学[10]、保护遗传学以及行为学[11-14]等多个学科开展了相关研究,为长江江豚的养护提供了科学依据。随着长江江豚的种群数量趋于稳定,其健康状况应是下一步关注的焦点。但因缺乏长江江豚物种的健康标准,多参考陆生哺乳动物或其他近缘种的标准,给长江江豚的健康评估、疾病诊断及保育工作带来诸多不便。血液常规检查和生化分析一直是动物健康评价的基础。Nabi等通过探究年龄、性别、季节以及位置等因素对长江江豚血液学与血液生化指标的影响,已证实栖息地环境与生物生殖状态对长江江豚的生理值有影响[15-16],但长江江豚健康状况评价体系尚未建立。
本研究利用天鹅洲迁地保护区与鄱阳湖就地保护区共计136头次长江江豚的体检数据,采用医学统计学方法计算健康长江江豚血液学与血液生化指标生理参数区间,尝试建立基于行为健康与生理健康的长江江豚的健康评价体系,为长江江豚的健康管理提供依据。
1 材料与方法
1.1 数据来源
利用“声驱网捕法”捕捞湖北长江天鹅洲白鱀豚国家级自然保护区与江西鄱阳湖长江江豚省级保护区内的长江江豚群体[17],Nabi等总结了有关动物追踪、处理和采血的详细信息[18-20]。血样采集后保存于4 ℃,2 h内送医院完成检测。长江江豚的体检原始数据来源于中国科学院水生生物研究所鲸类生物学课题组,原始记录中有明显异常的长江江豚个体数据在分析前剔除。
1.2 监测指标
身体质量指标包括体重、体长和身体质量指数(body mass index,BMI)。
血液指标包括长江江豚血液白细胞数(WBC)、中性粒细胞数(Neut)、淋巴细胞数(Lymph)、嗜酸细胞数(Eosino)、单核细胞数(Mono)、嗜碱细胞数(Baso)、红细胞数(RBC)、血红蛋白(HGB)、红细胞压积(HCT)、平均红细胞体积(MCV)、平均血红蛋白含量(MCH)、平均血红蛋白浓度(MCHC)、红细胞体积分布宽度标准差(RDW-SD)、红细胞体积分布宽度变异系数(RDW-CV)、血小板数(PLT)、血小板分布宽度(PDW)、血小板平均体积(MPV)、血小板积压(PCT)、中性粒细胞百分比(Neut%)、淋巴细胞百分比(Lymph%)、嗜酸细胞百分比(Eosino%)、单核细胞百分比(Mono%)和嗜碱细胞百分比(Baso%),共23项指标。
血液生化指标包括谷丙转氨酶(ALT)、总胆红素(T-BILI)、直接胆红素(D-BILI)、间接胆红素(I-BILI)、总蛋白(TP)、白蛋白(ALB)、球蛋白(GLB)、白蛋白/球蛋白(ALB/GLB)、总胆汁酸(TBA)、谷氨酰转移酶(GGT)、碱性磷酸酶(ALP)、尿素氮(BUN)、尿酸(UA)、血清肌酐(Cr)、总胆固醇(TC)、甘油三脂(TG)、高密度脂蛋白(HDL-C)、低密度脂蛋白(LDL-C)、谷草转氨酶(AST)、肌酸激酶(CK)、肌酸激酶同工(CK-MB)、乳酸脱氢酶(LDH)、血清α羟丁酸脱氢酶(a-HBDH)、血糖(Glu)以及电解质:钾(K)、钠(Na)、氯(Cl)、钙(Ca)、磷(P)、镁(Mg)和铁(Fe)等。
1.3 数据处理
使用SPSS 19.0(SPSS Inc,Chicago)统计学软件进行统计及检验分析。参照王文琪等血液指标数据的统计方法对数据进行预处理:依据拉依达准则,剔除每一项监测指标的异常值。若某个测量值d的残差d(1≤≤n)满足|d|>3S时,便剔除该数值[21]。
采用偏度系数和峰度系数检验方法,对长江江豚身体质量指数、血常规与生化各指标进行正态分布分析。如果数据符合正态分布,直接用于计算生理值范围;若数据不符合正态分布,但通过平方根法、对数转换法等变换后服从正态分布,仍用正态分布法估计生理值范围。
参考临床医学统计学方法,采用正态分布法估计各指标生理值[22],以95%置信区间作为指标统计的生理范围[23]。根据各项指标的生理学意义确定长江江豚各生理指标取单侧或双侧阈值。以平均数±标准差表示各指标的均值。针对样本间差异性比较,先对组间数据进行方差齐性检验,满足方差齐性条件(>0.05 )时采用独立样本t检验比较组间差异;否则采用Mann-Whitney U 检验比较组间差异。
1.4 健康评价体系构建
参考陆生哺乳动物的健康评价体系,通过行为观察和血液学分析,提出长江江豚基于行为健康和生理健康的健康评价体系。通过文献研究归纳长江江豚的行为谱,归纳为28种本能性行为与17种社会性行为[24]。本研究将易于观察的游泳行为、摄食行为和呼吸行为作为长江江豚的行为健康评价指标。将身体质量指数(body mass index,BMI)、血常规、肝功能、肾功能、心肌损伤、心脑血管、电解质及血糖用于评价长江江豚的生理健康。
本研究收集了279头次长江江豚体长与体重数据,利用长江江豚生长规律模型(♂=114.44580.1410与♀ =116.25190.0947,其中代表体长,为年龄)计算江豚年龄[8]。进而分年龄和性别统计长江江豚的身体质量指数(体重/体长2,kg·m-2),以95%置信区间统计其生理范围。参照《中国成人超重和肥胖症预防控制指南》[25],结合仝云云等对异常型窄脊江豚体型参数的设定[26],按照BMI生理值范围的1.3倍建立长江江豚BMI肥胖标准。以生理值为中心,低于生理值范围则视为“偏瘦型”,生理值上限至肥胖值之间范围定义为“超重型”,肥胖值以上个体均视为“肥胖型”。
本研究利用136头次长江江豚血液学数据,以正态分布法统计血常规等指标的生理值范围,将偏离生理范围值的指标定义为异常,结合行为等指标综合评价长江江豚的健康状况。
1.5 圈养江豚“天天”的健康评估
“天天”为雄性14龄豚,自2008年起,以网箱(=225 m2,=7 m)圈养于长江天鹅洲故道中,人工定时定点投喂。于2019年12月实施常规体检,检查指标同前所述。
2 结果与分析
通过对长江江豚日常行为的监测和已有体况检查数据的统计,结合文献研究,从行为健康与生理健康两个维度出发,建立了长江江豚的健康评价指标体系,并初步评价了保护区内圈养长江江豚的健康状况。
2.1 行为健康
2.1.1 游泳行为 长江江豚是一种喜近岸分布的小型鲸类动物,其主要栖息于离岸100~300 m的近岸带,栖息于水深3~9 m的水域,分布密度随水深的增加而减小,长江江豚对于流速和透明度无明显的选择性[27]。长江江豚好集群,往往2~3头以上个体聚集在一起。长江江豚生性活泼、胆小[28]。异常游泳行为包括离群独游、活跃性显著降低,亦或是其他异常行为,如主动撞击渔船等。
2.1.2 摄食行为 长江江豚主要以小型淡水鱼类为食。在摄食过程中,其典型的动作发生为集群个体分开行动,以不同的方向出水并潜入,呼吸间隔较短,响声较大。异常摄食行为包括食欲与捕食能力显著降低、体重下降超过10%等[29-30]。
2.1.3 呼吸行为 长江江豚呼吸行为是指头露出水面,打开呼吸孔吸进空气,闭合呼吸孔进入水中的过程。环境、活动水平和生理状态可影响长江江豚呼吸频率。通常长江江豚平均呼吸间隔为12~20 s[31-32]。异常呼吸行为包括呼吸间隔时间异常、呼吸有杂音、呼吸音粗砺、“点头”呼吸和“垂直上浮”呼吸等[33-34]。
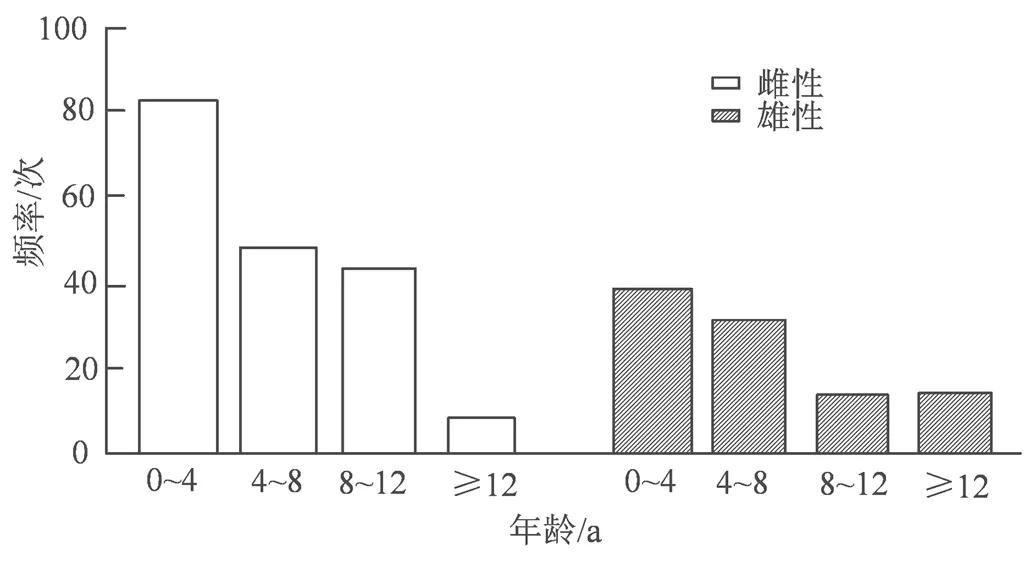
图1 各年龄段江豚出现频率
Figure 1 Frequency of estimated age in collected Yangtze finless porpoise
2.2 生理健康
2.2.1 身体质量指数 按照长江江豚生长模型推算279头次长江江豚的年龄分布,结果如图1所示。通过SPSS单因素协方差分析,发现0~4龄、即性成熟前,雌雄个体间的BMI无显著差异(=0.401>0.05),性成熟后雌雄个体的BMI则存在显著性差异(=0<0.05)。因此按性成熟前个体、性成熟后雌性个体和雄性个体分组,分别计算其BMI的生理值范围。结果显示,性成熟前,长江江豚BMI的生理值范围为16.33~25.66 kg·m-2,BMI≤16.32 kg·m-2视为偏廋,25.67~27.29 kg·m-2视为超重,BMI≥27.30 kg·m-2为肥胖。性成熟后,雌性长江江豚BMI的生理值范围为18.04~29.51 kg·m-2,BMI≤18.04 kg·m-2为偏瘦,BMI 在29.52~30.90 kg·m-2为超重,BMI≥30.91 kg·m-2属于肥胖。雄性长江江豚BMI的生理值范围为16.13~26.18 kg·m-2,BMI≤16.12 kg·m-2则被认为过轻,26.19~27.40 kg·m-2为超重,BMI≥27.5 kg·m-2属于肥胖(表1)。

表1 长江江豚肥胖标准

表2 长江江豚与其他哺乳类血常规指标生理值范围
注: *表示长江江豚与其他哺乳类动物存在明显差异。下同。
2.2.2 血常规 长江江豚血常规共涉及23项指标,包括白细胞计数及分类、红细胞计数与血红蛋白和血小板计数等(表2)。白细胞及分类常用于监测机体的各种感染及其危害程度。长江江豚WBC的生理值范围为3.39~12.34×109·L-1。WBC分类检查结果与 WBC 计数有同等重要作用。从计数来看,中性粒细胞生理值范围为1.17~7.01×109·L-1,淋巴细胞为0.29~3.03×109·L-1,单核、嗜酸与嗜碱细胞均在0~1×109·L-1之间。RBC及HGB测定常用来判断贫血及其严重程度。长江江豚RBC生理值范围为4.11~6.19×1012·L-1,HGB为138.82~192.98 g·L-1。MCV、MCH与MCHC是3项鉴别贫血性质的筛选指标,MCV在79.02~112.73 fL之间;MCH在28.65~36.82 pg之间;MCHC在295.44~398.06 g·L-1之间。红细胞体积分布宽度(RDW)是反映红细胞体积大小以及均匀程度的参数,统计分析发现长江江豚红细胞体积分布宽度标准差(RDW-SD)与红细胞体积分布宽度变异系数(RDW-CV)生理值范围分别为40.16~60.15 fL与11.76%~17.23%。血小板(PLT)对机体的止血功能极为重要,长江江豚血小板计数变动范围为68.07~219.29×109·L-1。血小板积压PCT受血小板平均体积(MPV)与血小板分布宽度(PDW)的影响,长江江豚PCT在0.1%~0.23%之间,与人无明显差异。
2.2.3 肝功能 肝功能包括谷丙转氨酶(ALT)等十二项指标(表3)。ALT与AST水平是肝细胞损伤的重要评价指标,长江江豚ALT变动范围为21.37~53.88 U·L-1,AST 则在167.93~235.43 U·L-1之间。胆红素(BILI)通常在实质肝病和胆道梗阻状态下会升高,长江江豚T-BILI生理值范围为0~5.81 μmol·L-1。总胆汁酸(TBA)是胆固醇在肝脏中代谢的最终产物,能特异性反映肝脏排泄情况。长江江豚TBA的范围为0~11.25 μmol·L-1。长江江豚总蛋白(TP)在58.97~86.65 g·L-1之间。长江江豚白蛋白(ALB)的范围为35.60~49.60 g·L-1,浓度升高常见于严重失水,浓度降低可见于肝和肾疾病。球蛋白(GLB)是由机体免疫器官产生,血清球蛋白水平能反映肝脏部分功能。15.34~41.00 g·L-1为长江江豚GLB的生理值范围,肝脏炎症时可导致GLB偏高。谷氨酰转移酶(GGT)广泛分布于肝细胞浆和肝内胆管上皮中,当肝脏过度合成或胆汁排出受阻时,血清中的GGT升高。长江江豚GGT在18.13~62.30 U·L-1之间波动。此外,碱性磷酸酶(ALP)也常用于肝胆系统疾病的诊断,长江江豚ALP的生理值范围为18.18~292.58 U·L-1。

表3 长江江豚与其他哺乳类肝功能指标生理值范围
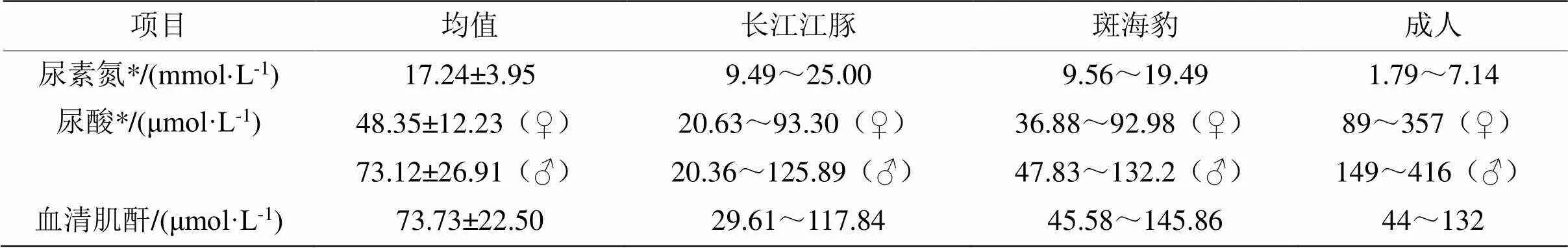
表4 长江江豚与其他哺乳类肾功能指标生理值范围

表5 长江江豚与其他哺乳类心肌损伤指标生理值范围
2.2.4 肾功能指标 一般以尿素氮(BUN)、尿酸(UA)与血清肌酐(Cr)3项作为肾功能监测指标,用于急慢性肾炎、肾病、尿毒症和肾衰竭等疾病的检查(表4)。BUN是机体蛋白质代谢的主要产物,由肝脏产生,经肾脏排出,长江江豚BUN范围为9.49~25.00 mmol·L-1。长江江豚的UA存在明显的雌性差异(<0.05),雌性长江江豚UA的均值为(48.35±12.23) μmol·L-1,变动范围在20.63~93.30 μmol·L-1之间;雄性均值为(73.12±26.91) μmol·L-1,范围为20.36~125.89 μmol·L-1。血清肌酐(Cr)则与肾小球滤过功能的损害程度有关,Cr升高意味着肾功能的损害。长江江豚的均值为(73.73±22.50 )μmol·L-1,变动范围为29.61~117.84 μmol·L-1。
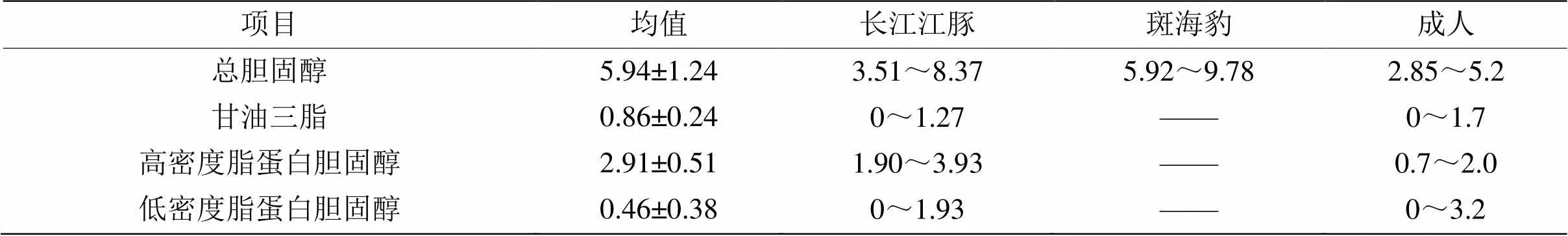
表6 长江江豚与其他哺乳类心脑血管健康指标生理值范围
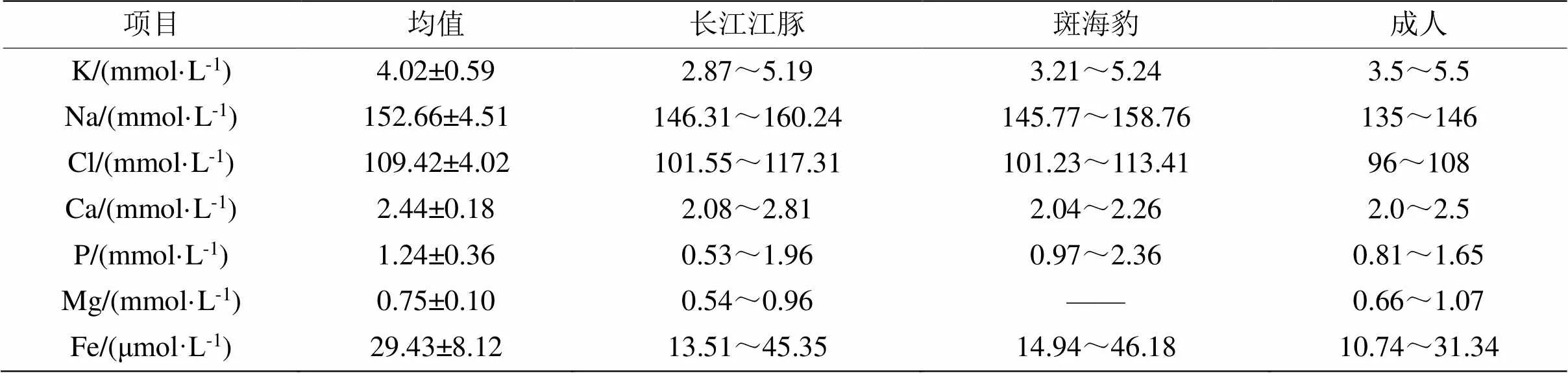
表7 长江江豚与其他哺乳类血清电解质指标生理值范围

表8 江豚“天天”健康评估表
2.2.5 心肌损伤 临床中一般以谷草转氨酶(AST)、肌酸激酶(CK)及其同工酶(CK-MB)、乳酸脱氢酶(LDH)与血清α羟丁酸脱氢酶(a-HBDH)等作为心肌损失的监测指标(表5)。长江江豚AST的生理值范围在167.93~235.43 U·L-1之间,心肌细胞受损时其血清浓度可升高。临床上常测定CK用于判断骨骼肌和心肌细胞是否损伤,肌酸激酶同工酶(CK-MB)更具特异性与敏感性。长江江豚CK与CK-MB的生理值范围分别为75.49~186.35 U·L-1、42.16~219.50 U·L-1,同人和其他陆生哺乳类接近。LDH增高主要见于心肌梗死,长江江豚LDH的变动范围为98.84~345.50 U·L-1。血清α羟丁酸脱氢酶(a-HBDH)作为LDH辅助指标,范围在47.28~378.27 U·L-1之间。
2.2.6 心脑血管健康 总胆固醇、甘油三脂、高密度脂蛋白胆固醇和低密度脂蛋白胆固醇,是心脑血管健康的重要指标(表6)。血脂异常可导致冠心病等动脉粥样硬化性心血管疾病。长江江豚总胆固醇(TC)的生理值范围为3.51~8.37 mmol·L-1,TC升高,动脉中易形成硬化的斑块,造成动脉迅速堵塞,致使急性心肌梗塞。甘油三脂(TG)偏高易造成血液粘稠,血脂在血管壁沉积,增加动脉粥样硬化、冠心病和心肌梗死等疾病的风险。长江江豚TG范围在0~1.27 mmol·L-1之间。高密度脂蛋白胆固醇(HDL-C)能促进外周组织中胆固醇的消除,防止动脉粥样硬化,其含量与动脉管腔狭窄程度呈显著的负相关。长江江豚HDL-C的变动范围为1.90~3.93 mmol·L-1。低密度脂蛋白胆固醇(LDL-C)是运输胆固醇到肝外组织的主要运载工具,长江江豚LDL-C在0~1.93 mmol·L-1之间。
2.2.7 血清电解质 血清电解质共7个指标(表7),长江江豚血清钾(K)的生理值范围为2.87~5.19 mmol·L-1,长期摄入不足、呕吐或腹泻可导致血钾偏低,易出现肌无力、消化功能障碍等现象,血钾偏高可使心动过缓、心律不齐,严重时可造成心脏骤停。长江江豚血钠(Na)的变动范围为146.31~160.24 mmol·L-1,低于146 mmol·L-1可认为该豚有低血钠危险,极易出现软弱无力、游动过缓等症状。血清氯(Cl)在调节酸碱平衡、渗透压和水分布方面起重要作用,长江江豚Cl的生理值范围为101.55~117.31 mmol·L-1。长江江豚血清钙(Ca)的范围为2.08~2.81 mmol·L-1,参与肌肉收缩、凝血过程,组成骨骼和牙齿等重要生理功能。长江江豚血清磷(P)在0.53~1.96 mmol·L-1之间,其异常同横纹肌溶解、磷摄入过多、溶骨性疾病、甲状旁腺功能低下或高钙血症相关。血清镁(Mg)的生理值范围为0.54~0.96 mmol·L-1,Mg增高可能存在慢性肾炎、尿毒症隐患。血清铁(Fe)变动范围为13.51~45.35 μmol·L-1,缺铁性贫血或感染等可降低其浓度,但机体患有肝炎时,肝脏贮存铁释放和转运铁蛋白合成障碍,Fe升高。
2.2.8 血糖 血糖(Glu)是机体能量的重要来源,机体血糖产生与消耗处于动态平衡的状态,并维持在一个相对稳定的水平。在糖尿病、慢性胰腺炎、心肌梗塞、甲状腺和肾上腺功能亢进中常见Glu病理性升高。葡萄糖代谢异常、严重肝病、肾上腺、甲状腺功能减退和慢性营养不良时均可使Glu浓度降低。统计分析显示长江江豚血糖的均值为(7.35±1.20)mmol·L-1,血糖生理值范围在4.98~9.72 mmol·L-1之间。
2.3 圈养江豚的健康评估结果
应用上述指标体系,初步评估了圈养长江江豚“天天”的健康状况。“天天”为雄性14龄豚,观察发现其活跃度较高且行为无异常。日食量占体重的11%左右,摄食状态较佳。平均呼吸间隔为18 s,符合正常水平。
生理健康方面,BMI为26.40 kg·m-2,属于超重型。血常规检测中单核细胞百分比为6.7%,明显超出正常范围(0.62%~3.23%)。肝功能监测指标中,谷丙转氨酶(ALT)为84.00 U·L-1,谷草转氨酶(AST)为249.00 U·L-1,均高于长江江豚正常值范围。胆红素(BILI)三项则均低于正常水平。肾功能监测指标中的尿酸(UA)为18 μmol U·L-1,低于正常范围。总胆固醇(TC)与高密度脂蛋白胆固醇(HDL-C)均高于正常水平(表8)。其他检测指标正常。
3 讨论与结论
世界卫生组织(WHO)关于人类健康的定义是:“健康不仅是没有疾病或病痛,而且是一种躯体上、心理上和社会上的完好状态”,包括生理健康、心理健康和社会适应良好3个方面[35]。动物健康是指动物机体生理机能正常,即各功能器官发育良好、功能正常且具有良好的生产效能[36]。本研究基于行为健康和生理健康,建立长江江豚的健康评价体系,可用于长江江豚的健康评估和管理,反映种群的健康水平,为长江江豚的养护提供依据。
身体质量指数(BMI)是人群健康评价常用的指标,可反应个体健康状况。BMI过高,罹患癌症、心脏病、呼吸道疾病和糖尿病的风险会增加[37]。2017年仝云云等将BMI列为长江江豚体型参数,并参照人类 BMI等判断肥胖的方法和标准,判定某异常型窄脊江豚属肥胖体型[26]。本研究尝试将BMI指标引入长江江豚的健康评估体系,统计分析显示性成熟前后的个体存在显著差异(表1)。按照人体肥胖与正常BMI的比值1.3倍建立长江江豚BMI肥胖标准。食物摄入过多和营养摄入失衡是长江江豚肥胖的重要原因,圈养长江江豚易发生。长江江豚偏瘦则可能与渔业资源不足和环境质量下降造成的江豚食物短缺有关[38]。监测长江江豚BMI指标不仅能反映豚类个体的健康状况,其群体水平也可反映长江江豚食物安全与环境安全等问题。
先前研究显示,血液学和血液生化指标受到动物营养健康、生殖周期、渔业资源和栖息地利用等影响[39-40]。在鲸豚类动物中,如瓶鼻海豚()、白鲸()、斑点海豚()和长江江豚,栖息地都可通过饮食影响其血脂[41-42]。本研究按照独立样本t检验分析发现,鄱阳湖保护区(PL)与天鹅洲保护区(TZO)两处江豚胆固醇(TC)存在显著性差异(=0.001<0.05),其生理值范围分别为4.00~6.56 mmol·L-1(TCPL)和4.05~8.31 mmol·L-1(TCTZO),但两者均在本研究设定的生理范围内(3.51~8.37 mmol·L-1)。这些结果说明栖息地会造成血脂等相关指标的波动,但不会影响其健康状况的评价。Nabi等认为长江江豚的HCT和MCHC受性别影响[15-16](<0.05),本研究的t检验分析结果也证实两者具有显著性差异(<0.05)。但从范围分布来看,HCT%(♀)为33.43%~63.44% ,HCT%(♂)为38.19%~58.67%,整体为35.88%~61.06%;MCHC(♀)为282.19~391.02 g·L-1,MCHC(♂)为289.22~400.64 g·L-1,整体为295.44~398.06 g·L-1。雌雄群体的HCT和MCHC生理值范围有交叉,且差别较小。为简化长江江豚的健康评价体系,长江江豚的HCT和MCHC未按性别分组统计。在其他鲸类中,年龄会显著影响电解质[43],长江江豚Ca 和P浓度受年龄影响显著[15-16],统计分析不同年龄段江豚Ca和P浓度,发现0~4龄与4~8龄江豚Ca浓度具有显著性差异(=0.017<0.05),0~4龄和4~8龄的血清Ca生理值范围分别为2.18~2.84 mmol·L-1和2.06~2.77 mmol·L-1,两者均与整体范围2.08~2.81 mmol·L-1相差无几,无需按年龄分组计算。指标亦如此。
比较长江江豚、成人及其他水生哺乳动物的血液学临床指标的生理值范围发现,长江江豚同其他鲸豚类动物虽有着或远或近的亲缘关系,但生理值范围具有物种的特异性。如长江江豚白细胞计数(WBC)略低于斑海豹,但明显高于成人,并且其嗜酸细胞百分比(Eosino%)生理值范围明显高于斑海豹与成人。斑海豹血红蛋白(HGB)生理值分布范围最广,长江江豚次之,成人最小。肝功能监测指标中,长江江豚AST浓度范围为167.93~235.43 U·L-1,远高于成人(4~40 U·L-1)以及亲缘关系更近的斑海豹(24.26~139.47 U·L-1),可能与AST的器官分布有关。与陆生哺乳动物不同,部分水生哺乳动物AST也存在于肌肉、肾脏和其他器官中[44]。此外,长江江豚T-BILI(0~5.81μmol·L-1)与斑海豹(0.51~5.24μmol·L-1)持平,但与成人(3.4~20.5 μmol·L-1)存在较大差异,长江江豚与斑海豹的尿素氮(BUN)正常范围明显高于成人,尿酸(UA)则较低。
人和动物健康体系是由影响人和动物健康的多种因素相互作用、相互影响而构成的复杂多维系统。目前已提出基于生理健康、心理健康、行为健康和社会健康4个维度的人体健康评价体系。麋鹿、大熊猫等保护动物已建立基于营养状况指标、免疫学指标、内分泌指标以及寄生虫感染为主要内容的健康评价体系。本研究从行为健康与生理健康两个维度出发,构建了长江江豚的健康指标评级体系,可较好反映长江江豚个体的健康状态。食物丰度是影响长江江豚种群数量的最主要因素,完整的肠黏膜组织、平衡的肠道菌群及健全的肠道免疫功能是长江江豚健康生长的重要保障,有必要在长江江豚的健康评价体现中增加胃肠道健康相关的指标,如通过ELISA等方法测定血清中肠脂肪酸结合蛋白、脂多糖的含量来反映肠粘膜的完整性。
总而言之,本研究构建了基于行为健康与生理健康两个维度的长江江豚健康评估体系,可为长江江豚的健康管理及养护提供科学依据。
[1] 张先锋, 刘仁俊, 赵庆中, 等. 长江中下游江豚种群现状评价[J]. 兽类学报, 1993, 13 (4): 260-270.
[2] MEI Z G, ZHANG X Q, HUANG S L, et al. The Yangtze finless porpoise: On an accelerating path to extinction?[J]. Biol Conserv , 2014, 172: 117-123.
[3] BAILLIE J , GROOMBRIDGE B , GIMENEZ D M , et al. 1996 IUCN red list of threatened animals[M]. Gland, Switzerland, International Union for Conservation of Nature and Natural Resources IUCN, 1996.
[4] 国家林业和草原局,农业农村部. 国家林业和草原局农业农村部公告(2021年第3号)(国家重点保护野生动物名录) [EB/OL].[2021-02-01] http://www. forestry.gov. cn/ main/3457/20210205/122612568723707.html.
[5] HUANG J, MEI Z G, CHEN M, et al. Population survey showing hope for population recovery of the critically endangered Yangtze finless porpoise[J]. Biol Conserv, 2020, 241: 108315.
[6] 张晓可,刘凯,万安,等.安庆西江浮游动物群落结构及江豚生存状况评估[J].水生生物学报,2018,42(2):392-399.
[7] 杨光,周开亚,高安利,等.江豚生命表和种群动态的研究[J].兽类学报,1998,18(1):2-8.
[8] 张先锋. 江豚的年龄鉴定、生长和生殖的研究[J]. 水生生物学报, 1992, 16(4): 289-298.
[9] 张长群, 郑杨, S PLATTO, 等. 人工饲养长江江豚的同性性行为和自慰行为[J]. 兽类学报, 2015,35(3): 241-252.
[10] 王丁. 长江江豚声信号及其声行为的初步研究[J]. 水生生物学报, 1996, 20 (2):127-133.
[11] 徐信荣, 陈炳耀, 王炼, 等. 北部湾沙田水域中华白海豚和江豚的同域分布格局及时空变化[J]. 兽类学报, 2012,32(4): 325-329.
[12] 高安利, 周开亚. 中国水域江豚外形的地理变异和江豚的三亚种[J]. 兽类学报, 1995,15(2):81-92.
[13] 裴丽丽, 章纬菁, 卢佳, 等. 长江江豚TRAIL基因的克隆、体外表达及生物学功能分析[J]. 生物工程学报, 2016,32(5): 610-620.
[14] JIA K T, LIN W Z, GUI D, et al. Molecular evidence reveals the distinctiveness of Indo-Pacific finless porpoises () in the Pearl River Estuary and insights into genus Neophocaena's origin[J]. Mar Biol , 2014, 161(8): 1919-1930.
[15] NABI G, HAO Y J, ROBECK T R, et al. Physiological consequences of biologic state and habitat dynamics on the critically endangered Yangtze finless porpoises (ssp.) dwelling in the wild and semi-natural environment[J]. Conserv Physiol, 2018, 6(1): coy072.
[16] NABI G, ROBECK T R, HAO Y J, et al. Hematologic and biochemical reference interval development and the effect of age, sex, season, and location on hematologic analyte concentrations in critically endangered Yangtze finless porpoise (ssp.)[J]. Front Physiol, 2019, 10: 792.
[17] HUA Y. Live capture of the Chinese river dolphin lipotes by the noise of small motor boats and the seine [J]. Acta Hydrobiologica Sinica,1987,11(1):99-100.
[18] NABI G, HAO Y, ZENG X, et al. Hematologic and biochemical differences between two free ranging Yangtze finless porpoise populations: The implications of habitat[J]. PLoS One, 2017, 12(11): e0188570.
[19] NABI G, HAO Y J, ZENG X Y, et al. Assessment of Yangtze finless porpoises () through biochemical and hematological parameters[J]. Zoological Studies,2017, 56(31):1-11.
[20] NABI G, HAO Y J, MCLAUGHLIN R W, et al. The possible effects of high vessel traffic on the physiological parameters of the critically endangered Yangtze finless porpoise (ssp.)[J]. Front Physiol, 2018, 9: 1665.
[21] 王文琪.馆养海豚的饲养、疾病防治研究及海洋哺乳动物环境标本库的建立[D].青岛:中国科学院海洋研究所, 2001.
[22] 马斌容, 医学统计学[M].5版.北京:人民卫生出版社,1990:267.
[23] DE SWART R L, ROSS P S, VEDDER L J, et al. Haematology and clinical chemistry values for harbour seals () fed environmentally contaminated herring remain within normal ranges[J]. Can J Zool, 1995, 73(11): 2035-2043.
[24] 陈燃, 魏垚麟, 吴亮, 等. 基于PAE编码系统构建的半自然条件下长江江豚行为谱[J]. 兽类学报, 2015,35(1): 40-47.
[25] 中华人民共和国卫生部疾病控制司. 中国成人超重和肥胖症预防控制指南[M]. 北京:人民卫生出版社, 2006.
[26] 仝云云,唐斌,唐文乔,等. 异常型窄脊江豚的体型参数及肝脏组织学分析[J].上海海洋大学学报, 2017, 26(6): 21-30.
[27] 肖建强, 王丁. 人工饲养环境下长江江豚的行为谱的构建[J]. 水生生物学报, 2005, 29 (3): 253-258.
[28] 蒋文华, 于道平. 半自然水域中母仔长江江豚呼吸行为的初步观察[J]. 动物学杂志, 2006, 41 (4): 97-99.
[29] 游立新, 何虎, 张晓可, 等. 汇流区投放鱼饵对江豚觅食行为的影响[J]. 水生态学杂志, 2015,36(6): 66-71.
[30] 于道平, 蒋文华, 韩德民. 长江江豚对人工投食适应过程的观察[J]. 兽类学报, 2007, 27 (4): 365-369.
[31] 王丁, 赵庆中, 王克雄, 等. 长江圈养和饲养池中江豚行为的几点观察[J]. 水生生物学报, 1997, 21(4): 306-311.
[32] XIAO J Q, WANG K X, WANG D. Diurnal changes of behavior and respiration of Yangtze finless porpoises (asiaeorientalis) in captivity[J]. Zoo Biol , 2005, 24(6): 531-541.
[33] 郭政, 赵庆中, 张先锋. 长江江豚感染铜绿假单胞菌肺炎的诊治[J]. 兽类学报, 2007, 27(1): 86-91.
[34] 刘振国, 董金海, 李鲁, 等. 宽吻海豚急性铜绿假单胞菌感染的治疗研究[J]. 中国水产科学, 2000, 7(2): 123-125.
[35] 刘勇.人类健康层次性新观点的提出及亚健康的归属和WHO健康定义的缺陷[J].慢性病学杂志,2010,12(1):4-6.
[36] DIERAUF L, GULLAND F. CRC handbook of marine mammal medicine (health, disease, and rehabilitation, second edition) U.S. federal legislation governing marine mammals[J]. Immunology, 2001,16(37):741-766.
[37] 刘玉玺. BMI指数应用进展[J]. 科学大众, 2009, 5(1): 152.
[38] 樊明宁, 张亚, 唐文乔, 等. 长江江豚一例腹壁肌间巨型囊肿的组织学分析[J]. 水生生物学报, 2016,40(1): 198-202.
[39] PETHYBRIDGE H, DALEY R K, NICHOLS P D. Diet of demersal sharks and chimaeras inferred by fatty acid profiles and stomach content analysis[J]. J Exp Mar Biol Ecol , 2011, 409(1/2): 290-299.
[40] KIM S L, TINKER M T, ESTES J A, et al. Ontogenetic and among-individual variation in foraging strategies of northeast Pacific white sharks based on stable isotope analysis[J]. PLoS One, 2012, 7(9): e45068.
[41] ASPER E D, CORNELL L H, DUFFIELD D A, et al. Hematology and serum chemistry values in bottlenose dolphins[M]//The Bottlenose Dolphin. Amsterdam: Elsevier, 1990: 479-486.
[42] COOK R A, MICHAEL K S, ELLEN S D. Circulating levels of vitamin E,cholesterol, and selected minerals in captive and Wild BelugaWhales ()[J]. J Zoo Wildlife Med,1990,21(7): 65-69.
[43] KASAMATSU M, HASEGAWA K, WAKABAYASHI I, et al. Hematology and Serum Biochemistry Values in Five Captive Finless Porpoises () [J]. J Vet Med SCI, 2012,74(10):1319-1322.
[44] WOJICK K R, ERICMILLERMURRAY E. FowlerFowler's zoo and wild animal medicine, current therapy, volume 7, elsevier, St. Louis[J]. J Exot Pet Med , 2012, 21(2): 190-191.
Study on the health evaluation system of Yangtze finless porpoise ()
DAI Caijiao1, TANG Bin2, HAO Yujiang2, WANG Kexiong2, GONG Cheng3,YUAN Junfa3
(1. College of Fisheries, Huazhong Agricultural University, Hubei Engineering Research Center for Aquatic Animal Diseases Control and Prevention, Wuhan 430070; 2. Institute of Hydrobiology, the Chinese Academy of Sciences, Wuhan 430072; 3. Tian-e-zhou National Reserve for Lipotes Vexillifer, Shishou 434400)
The Yangtze finless porpoise () is the only cetaceans that lives in the Yangtze River. Understanding the physiology and health of Yangtze finless porpoise may provide important information for the protection of this species. In this study, we statistically analyzed 54 hematology parameters and blood chemistry parameters from total of 136 Yangtze finless porpoises in the Tian-e-zhou Baiji National Nature Reserve in Hubei Province and the Poyang Lake Provincial Reserve in Jiangxi Province. The health evaluation system of Yangtze finless porpoise was constructed based on the behavioral and physiological health, and was further used to assess the physical condition of "Tiantian", a captive Yangtze finless porpoise maintained in the net cage in Tian-e-zhou National Reserves. The results showed that the blood parameters of WBC, Blood platelet (PLT), and aspartate aminotransferase (AST) of Yangtze finless porpoise were significantly different from those of terrestrial mammals and other related species. And Tiantian presented with abnormalities of hepatic indices and hyperlipidemia. These results provide scientific basis for assessment and conservation of Yangtze finless porpoise.
Yangtze finless porpoise; hematologic test; blood biochemical indices; health evaluation system
S941; S966.8
A
1672-352X (2021)03-0403-09
10.13610/j.cnki.1672-352x.20210706.009
2021-7-7 10:45:05
[URL] https://kns.cnki.net/kcms/detail/34.1162.S.20210706.1642.018.html
2020-08-23
香港海洋公园保育基金项目(AW03-1819)资助。
戴彩姣,硕士研究生。E-mail:2118572414@qq.com 唐 斌,博士研究生。E-mail:tangbin@ihb.ac.cn
袁军法,博士,副教授。E-mail:jfyuan@mail.hzau.edu.cn 龚 成,高级工程师。E-mail:tianezhou @sohu.com

