池塘和稻田养殖克氏原螯虾肠道微生物对比分析
李 飞,刘士力,卞玉玲,郑建波,程 顺,贾永义,迟美丽,顾志敏
池塘和稻田养殖克氏原螯虾肠道微生物对比分析
李 飞,刘士力,卞玉玲,郑建波,程 顺,贾永义,迟美丽,顾志敏*
(浙江省淡水水产研究所,农业农村部淡水渔业健康养殖重点实验室,浙江省淡水水产遗传育种重点实验室,湖州 313001)
为探究池塘和稻田养殖模式下克氏原螯虾肠道微生物组成的差异,采用16S rRNA高通量测序方法分析了对两种养殖模式下克氏原螯虾肠道的微生物多样性和群落结构。结果显示,所有样品共检出2 007个种水平上的分类操作单元(operational taxonomic units, OTU),归属于37个门,其中池塘养殖克氏原螯虾的肠道微生物有1 260个OTU,稻田养殖克氏原螯虾的肠道微生物有1 840个OTU,两种模式下克氏原螯虾的肠道微生物共同的OTU有1 093个;两种模式下的肠道微生物优势菌均为厚壁菌门,其中池塘模式中占比67.40%,稻田模式中占比为32.69%;对两种模式的克氏原螯虾肠道微生物进行Alpha多样性分析显示,池塘养殖克氏原螯虾肠道微生物多样性的Shannon、ACE和Chao指数均低于稻田养殖克氏原螯虾肠道微生物的指数,差异均达到极显著的水平;物种差异分析显示,在门水平上有21个门差异达到显著水平,其中有12个门差异达到极显著水平;在OTU水平上,有364个OTU差异达到显著水平,其中有106个OTU差异达到极显著水平。研究表明,池塘和稻田养殖克氏原螯虾肠道微生物在物种组成上、多样性上都存在明显差异,针对两种模式的养殖管理应有所区分,由于池塘模式下肠道微生物多样性较低,因此,需要更多地注重虾类健康状况动态,加强管理。
池塘;稻田;克氏原螯虾;肠道微生物
克氏原螯虾(),俗称小龙虾,原产于北美地区,经过多年的发展,目前已成为我国重要的淡水养殖虾类之一[1],据《中国小龙虾产业发展报告(2020)》,2019年,我国小龙虾养殖总产量达208.96 万t,养殖总面积达1 929 万亩,小龙虾养殖业产值约710 亿元,养殖面积和养殖产量再创新高[2]。然而,在克氏原螯虾养殖过程中,由于其免疫系统仅有天然免疫而不具有获得免疫,使得其抵抗外部环境和病源等免疫能力较差,病害或大规模死亡也常有发生,也成为制约产业健康可持续发展的关键因素之一。
与其他动物相类似,水生动物的肠道微生物与其健康有着密切关系,肠道菌群在宿主的代谢、生长和免疫等方面发挥着重要作用,是维持动物健康的必要因素,而水生动物的遗传背景、饲养环境和饲料组分均可以显著影响其肠道微生物的结构组成[3-4]。线粒体16S rRNA序列经常被用于系统发育和遗传多样性研究[5],由于其中的可变区一般具有菌种特异性,随着高通量测序技术的发展被广泛运用于肠道微生物领域的研究。克氏原螯虾的养殖发展至今已形成了池塘主养、稻虾共生(轮作)、虾蟹混养和藕田养殖等多种养殖模式,对于不同的养殖模式,其生长环境、饵料投喂和养殖管理都会存在不同之处,需要针对性地开展研究。因此,本研究选择池塘和稻田养殖两种较为主流的克氏原螯虾养殖模式,采用16S rRNA高通测序方法对相应模式下的克氏原螯虾肠道微生物组成和多样性进行对比分析,以期更深入地了解克氏原螯虾的养殖模式,为下一步进行针对性管理、模式优化和病害防治等方面提供指导。
1 材料与方法
1.1 采样地点与时间
池塘养殖与稻田养殖的克氏原螯虾均采集自安吉县梅溪草滩家庭农场,取样时间为2020年8月18日。稻田养殖的克氏原螯虾用地笼取样于稻田环沟,稻田面积约1 hm2,稻田中的水稻于2020年7月4日采用人工插秧的方式进行插秧,插秧的株行距为中间25 cm×20 cm,四周30 cm×30 cm,环沟宽2~3 m,环沟水深50~60 cm;池塘养殖的克氏原螯虾用地笼取样于池塘,池塘面积约500 m2,水深60~70 cm。样品采集后,迅速带回实验室进行肠道取样。肠道取样时,用无菌剪刀和镊子将克氏原螯虾肠道内容物从前往后挤压进无菌离心管,每尾虾的肠道内容物作为一个样品,其中池塘养殖的样品有6个,编号为test1_1、test1_2、test1_3、test1_4、test1_5和test1_6,稻田养殖的样品有4个,编号为test2_1、test2_2、test2_3和test2_4。所有样品干冰保存备用。
1.2 DNA提取、16S rRNA基因扩增和高通量测序
DNA提取、16S rRNA基因扩增和高通量测序委托上海美吉生物医药科技有限公司进行。收到样品后,按照FastDNA® Spin Kit(MP Biomedicals,美国)提取试剂盒进行DNA抽提,提取后,首先利用NanoDrop2000对DNA的纯度和浓度进行检测,用1% 琼脂糖凝胶电泳(电压5 V/cm,时间为20 min)对DNA完整性进行检测。样品初步检验合格后,进行16S rRNA PCR扩增。引物对应区域为16S V3~V4区,上游引物序列为338F(5'-ACTCC TACGGGAGGCAGCAG-3')和下游引物序列为806R(5'-GGACTACHVGGGTWTCTAAT- 3')。PCR扩增采用TransGen AP221-02: TransStart Fastpfu DNA Polymerase,20 μL反应体系:5×FastPfu缓冲液 4 μL、2.5 mmol·L-1dNTPs 2 μL、5 μmol·L-1上游引物0.8 μL、5 μmol·L-1下游引物0.8 μL、FastPfu 聚合酶0.4 μL、BSA0.2 μL和DNA模板10 ng,补ddH2O至20 μL。PCR反应参数:95 ℃ 3 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 45 s,27个循环;72 ℃延伸10 min。PCR扩增采用的是ABIGeneAmp9700型PCR仪。扩增完成后的PCR 产物用2%琼脂糖凝胶电泳检测PCR产物,PCR产物目的条带大小正确,浓度合适后,进行后续的构建PE文库(NEXTFLEX Rapid DNA-Seq Kit)和Illumina测序(Miseq PE300平台)。
1.3 数据处理与分析
1.3.1 数据优化处理 对测序获得的原始数据,首先根据PE reads之间的overlap关系,将成对的reads进行拼接,同时对序列质量和拼接效果进行质控过滤(使用的软件为FASTP0.20.0和FLASH1.2.11),再对数据进行标准化处理,从而使各样本在相同序列水平上进行对比,具体来说是按照各样本中最低序列的数量将所有样本的序列数随机抽取至统一数据量,即抽平。标准化后每个样本的有效序列数为33 621个,用于进行后续分析。
1.3.2 数据分析方法 得到优化序列后,运用Uparse(7.0.1090)将OTU(operational taxonomic units)代表序列在97%的相似水平下聚类分析;运用RDP classifier(2.11)对每条序列进行物种分类注释,然后与Silva(132)数据库比对,设置比对阈值为70%。运用mothur(version v.1.30.1)软件,采用Chao、Shannon、ACE和Simpson等指数进行Alpha多样性分析,并运用统计学T检验的方法检测两组之间的指数值是否具有显著性差异。选择97%相似度的OTU,利用mothur计算不同随机抽样下的Alpha多样性指数,利用R语言工具制作稀释曲线图,同时进行物种VENN图分析和群落组成分析。运用各样本的群落丰度数据,检测不同组微生物群落中表现出的丰度差异的物种,评估观察到的差异的显著性。
2 结果与分析
2.1 测序深度分析结果
经优化,本试验共测序获得424 272个序列,平均每个样本获得42 427.2个序列,其中有效序列为399 515个,平均每个样本获得有效序列39 951.5个,有效序列数目占原始序列数目的94.16%(表1)。采用对序列进行随机抽样的方法,以抽到的序列数与它们所能代表各分类学水平的数目构建稀释性曲线进行分析,结果表明,稀释曲线趋向平坦,说明测序数据量合理,本次测序数据量足够(图1)。

表 1 数据优化处理结果

图1 不同样本OTU水平的稀释曲线图
Figure 1 Dilution graph of different samples on OTU level
2.2 OTU聚类和物种组成分析
所有样品共检出2 007个OTU,其中稻田养殖克氏原螯虾的肠道微生物有1 840个OTU,池塘养殖克氏原螯虾的肠道微生物有1 260个OTU,稻田养殖克氏原螯虾的肠道微生物和池塘养殖克氏原螯虾的肠道微生物共同的OTU有1 093个(见图2),归属于37个门(Phylum)、102个纲(Class)、230个目(Order)、352个科(Family)、601个属(Genus)和1 003个种(Species)。对所有样品的OTU进行主成分分析表明,池塘养殖和稻田养殖克氏原螯虾的肠道微生物中的物种组成比较明显地分别归为相应的分组(图3)。

图2 克氏原螯虾肠道微生物OTU韦恩图
Figure 2 OTU Venn diagram of the intestinal microbiotal community of red swamp crayfish

图3 肠道微生物OTU水平的主成分分析
Figure 3 Principal component analysis of intestinal microbiota on OTU level
将所有样本中相对丰度小于2%的物种归为其他,图4为个样本在门分类水平的细菌群落组成图。通过对池塘养殖和稻田养殖的样本群落组成比例分别取均值,从门水平上看,池塘养殖克氏原螯虾肠道中厚壁菌门占67.40%,蓝细菌门占18.21%,变形菌门占5.01%,放线菌门占5.21%,绿弯菌门占1.27%,其他占2.91%;稻田养殖克氏原螯虾肠道中厚壁菌门占32.69%,蓝细菌门占21.61%,变形菌门占20.94%,放线菌门占15.66%,绿弯菌门占2.89%,其他占6.21%。

图4 不同样本在门分类水平的细菌种群丰度图
Figure 4 The bacterial population abundance diagram of different samples on phylum level
2.3 肠道微生物多样性分析
对池塘养殖和稻田养殖克氏原螯虾肠道微生物进行Alpha多样性分析表明,池塘养殖克氏原螯虾肠道微生物的Shannon、ACE和Chao多样性指数分别为2.58±0.50、1 044±83.78和940.67±196.17,稻田养殖克氏原螯虾肠道微生物的Shannon、ACE和Chao多样性指数分别为4.66±0.42、1 551±82.46和1 547.7±67.43,运用T检验检测两组之间的多样性指数差异显著性检验表明,值均小于0.01,达到极显著的水平。

表2 肠道微生物多样性分析及对比
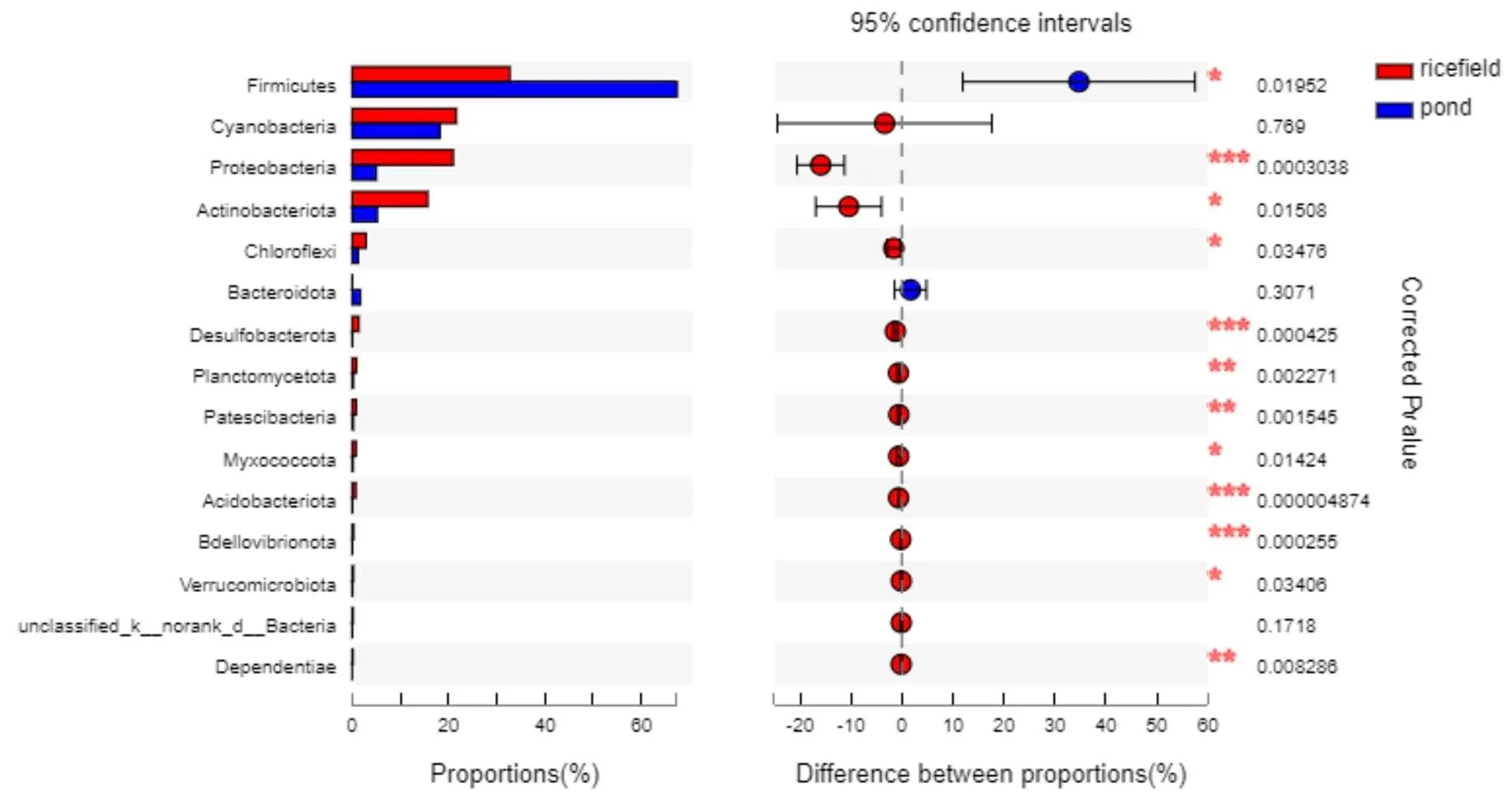
图5 均值总和前15在门水平差异显著性检验
Figure 5 Significance tests of the first 15 mean summations on phylum level

图6 均值总和前15在OTU水平差异显著性检验
Figure 6 Significance test of the first 15 of the summation of mean values on OTU level
2.4 物种差异分析
采用T检验对两组样本的门水平和种水平的组成进行差异分析,结果表明,在门水平上有21个门差异达到显著水平,其中有12个门差异达到极显著水平;在OTU水平上,有364个OTU差异达到显著水平,其中有106个OTU差异达到极显著水平。
3 讨论与结论
3.1 不同养殖模式下克氏原螯虾肠道微生物组成存在差异和相似之处
与其他动物相类似,目前的研究表明水生动物的遗传背景、饲养环境、饲料组分均可以显著影响其肠道微生物的结构组成。张美玲等对生活在不同盐度环境中的尼罗罗非鱼及凡纳滨对虾的肠道微生物组成进行研究表明,盐度可以显著影响水生动物肠道微生物的组成[1]。李倩等对池塘内循环水养殖下和普通池塘养殖的太湖鲂鲌肠道微生物组成情况研究表明,池塘内循环水养殖模式中的太湖鲂鲌肠道微生物多样性和菌群的均一性相对于普通池塘养殖模式均降低,优势菌群所占比例发生较大改变[6]。赵月季等对不同养殖模式下凡纳滨对虾肠道菌群影响研究表命名,淡水池塘养殖模式和高位池养殖模式的肠道细菌群落的丰富度、Shannon index和均匀度均显著高于海水池塘养殖模式和生物絮团养殖模式,4种养殖模式的肠道微生物群落结构存在显著差异[7]。本研究对两种养殖模式下的克氏原螯虾肠道微生物组成分析得出,无论是各种微生物的组成比例,还是微生物的多样性,都存在显著性差异,在门水平上有21个门差异达到显著水平,其中有12个门差异达到极显著水平,在OTU水平上,有364个OTU差异达到显著水平,其中有106个OTU差异达到极显著水平;在微生物多样性方面,两种模式下的Shannon、ACE和Chao多样性指数差异达到极显著的水平。之所以两种模式下的克氏原螯虾肠道微生物会存在显著差异,是因为两种模式下的克氏原螯虾生长环境存在很大的不同,其中稻田养殖模式下因为水稻的种植和管理为克氏原螯虾提供了更为丰富和多样的饵料、微生物和水质环境。两种模式下的克氏原螯虾肠道微生物也存在相似的地方,在所有检测出的2 007个OTU中,稻田养殖克氏原螯虾的肠道微生物和池塘养殖克氏原螯虾的肠道微生物共同的OTU有1 093个;从门水平上看,两种模式的优势菌也均为厚壁菌门、蓝细菌门、变形菌门占、放线菌门和绿弯菌门,但所占的比例在不同养殖模式下存在较大差异。
3.2 克氏原螯虾肠道微生物组成对养殖指导作用
肠道微生物与养殖生物的健康有着密切的关系,肠道菌群在宿主的代谢、生长和免疫等方面发挥着重要作用,是维持动物健康的必要因素[1-2,8]。肠道细菌群落的指示类群可用于评估对虾的健康状况,Xiong等[9]采用Illumina Miseq 高通量测序技术对对虾养殖水体和对虾肠道分析发现,对虾肠道中细菌群落的动态变化与对虾疾病的严重程度密切相关,同时也采用了指示物种来指示对虾的健康状态,并且指示物种能够区分样品的来源和健康状态。吴金凤等[10]研究61个敏感物种在健康塘和发病塘水样、健康和发病对虾肠道样品4 个组别间展现了清晰的差异,认为这些敏感物种相对丰度的改变可能作为评价对虾健康状态的一个生物学指标,可提高对对虾病害发生概率的预测能力。张立强等[8]对健康和患病克氏原螯虾肠道微生物群落结构和多样性分析表明,患病组的优势菌为变形菌门,对照组肠道微生物的优势菌为厚壁菌门,患病组变形菌门的占比显著高于对照组,Simpson指数提示,患病组的生物多样性较对照组显著下降。本研究对两种模式下的克氏原螯虾肠道微生物研究结果与张立强等对健康组(对照组)中的优势菌结果一致,优势菌均为厚壁菌门。本研究结果表明,池塘养殖模式下的克氏原螯虾肠道微生物多样性低于稻田养殖模式下的多样性,差异达到极显著水平,因此,根据其他已有研究结果推断,池塘养殖模式下的克氏原螯虾可能会比稻田养殖模式下的克氏原螯虾更容易患病,因此,针对这两种不同的养殖模式需要具有不同的养殖管理模式和强度。
[1] 顾志敏. 小龙虾无公害安全生产技术[M]. 北京: 化学工业出版社, 2018.
[2] 农业农村部渔业渔政管理局,全国水产技术推广总站,中国水产学会.中国小龙虾产业发展报告(2020)[M].北京:中国农业出版社,2020.
[3] 张美玲, 杜震宇.水生动物肠道微生物研究进展[J].华东师范大学学报(自然科学版),2016(1):1-8.
[4] ZHANG Y, LI Z, KHOLODKEVICH S, et al. Effects of cadmium on intestinal histology and microbiota in freshwater crayfish ()[J]. Chemosphere, 2020, 242: 125105.
[5] 刘士力, 贾永义, 迟美丽,等. 浙江3个河川沙塘鳢群体线粒体16SrRNA基因序列的研究[J]. 基因组学与应用生物学, 2018, 37(11):4742-4748.
[6] 李倩, 郭建林, 王雨辰, 等. 池塘内循环流水养殖下太湖鲂鲌(翘嘴鲌(♀)×三角鲂(♂))肠道微生物群落变化的研究[J].海洋与湖沼,2020,51(2):364-370.
[7] 赵月季,郭海朋,张德民. 不同养殖模式对凡纳滨对虾肠道微生物群落的影响[J].水产学报,2021, 45(2): 221-234
[8] 张立强, 李媛, 邓平, 等. 健康和患病克氏原螯虾肠道微生物群落结构和多样性分析[J].水产科技情报, 2020, 47(1): 37-40.
[9] XIONG J B, WANG K, WU J F, et al. Changes in intestinal bacterial communities are closely associated with shrimp disease severity[J]. Appl Microbiol Biotechnol , 2015, 99(16): 6911-6919.
[10] 吴金凤, 熊金波, 王欣,等. 肠道菌群对凡纳滨对虾健康的指示作用[J].应用生态学报,2016,27(2):611-621.
Comparison of intestinal microbiota ofin pond and ricefiled culture patterns
LI Fei,LIU Shili, BIAN Yuling , ZHENG Jianbo,CHENG Shun, JIA Yongyi , CHI Meili, GU Zhimin
(Key Laboratory of Freshwater Aquatic Animal Genetic and Breeding of Zhejiang Province,Key Laboratory of Healthy Freshwater Aquaculture, Ministry of Agriculture and Rural Affairs, Zhejiang Institute of Freshwater Fisheries, Huzhou 313001)
To explore the differences of intestinal microbiota of red swamp crayfish () in pond and ricefield culture patterns, microbiota diversity and community composition of red swamp crayfish from the above two patterns were studied by using the 16S rRNA high-throughput sequencing technology. The results showed that there are 2 007 OTUs(Operational taxonomic units) in total in all the tested samples, which belong to 37 phylums, there are 1 260 OTUs in the intestinal micorbiota of red swamp crayfish in pond, and 1 840 OTUs for the rice field pattern, and there are 1 093 OTUs which exist in both patterns. The first dominant phylum of the two culture patterns is the same”, i.e. Firmicutes, which occupies 67.40% in pond culture and 32.69% in ricefiled culture respectively. The Alpha diversity of the two patterns is extremely different(<0.01), the diversity of the pond culture is lower than that of the ricefield culture,which could be showed by the Shannon、ACE and Chao indexes. The intestinal microbiota compositions of the two patterns are different in different levels, on phylum level, there are 21 phylums significantly different(<0.05), in which 12 phylums are extremly different(<0.01), on OTU level, there are 364 OTUs significantly different(<0.05), in which 106 OTUs are extremly different(<0.01). The results indicated that there are obvious difference in both composition and diversity of intestinal microbiota in pond and ricefield culture patterns, therefore, there should be some difference in the management during culture. As the diversity in the pond pattern is lower, thus, more attention should be paid to, and the management should be strenthened.
pond; ricefield; red swamp crayfish; intestinal microbiota
S966.12
A
1672-352X (2021)03-0423-06
10.13610/j.cnki.1672-352x.20210706.001
2021-7-7 11:35:20
[URL] https://kns.cnki.net/kcms/detail/34.1162.S.20210706.1640.002.html
2020-09-25
湖州市公益性技术应用研究(重点)(2018GZ11)资助。
李 飞,副研究员。E-mail:lifeibest1022@163.com
顾志敏,研究员。E-mail:guzhimin2006@163.com

