不同来源蝉棒束孢遗传异质性研究
陈名君,鲁林琴,林 俨,刘玉军,谢继宇
不同来源蝉棒束孢遗传异质性研究
陈名君1,鲁林琴1,林 俨1,刘玉军2,谢继宇1
(1. 安徽农业大学微生物防治省重点实验室,合肥 230036;2. 安徽省科学技术研究院,合肥 230031)
蝉棒束孢是一种昆虫病原真菌,也是传统的中药材料,广泛分布于世界各地。利用ISSR-PCR分子标记技术对采集自不同地理位置的42株蝉棒束孢遗传异质性进行分析,9个引物共得到141个特异性条带,其中多态位点比率为94.7%。从种群水平上来看,宣城敬亭山种群(Pop A)的遗传多样性最高,达到81.6%,安徽石台县种群(Pop F)的遗传多样性最低,只有27.0%。其中种群内遗传多样性()为0.216 8,Nei 基因分化系数()为0.276 3,不同地方的种群间的平均基因流()较大,为1.309 8。研究表明,蝉棒束孢遗传谱系是随机分布的,与地理来源没有明显的相关性,不同地理来源的种群间较高水平的基因交流是种群遗传变异的主要原因。
蝉棒束孢;ISSR分子标记;遗传结构;遗传异质性
蝉棒束孢(Miquel)是寄生于蝉若虫后形成的虫菌复合体,俗称蝉花,属于子囊菌门()肉座菌目()虫草科()棒束孢属()一种真菌[1]。是一种昆虫病原真菌型中药,具有很好的药用价值。从古自今,很多书中都记载了蝉棒束孢作为中国著名的中药,具有多方面的药用价值[2]。现代中医学发现,蝉花对慢性肾衰竭等多种疾病有明显疗效[3-4]。蝉棒束孢在我国主要分布于长江以南各省份,在竹林、阔叶林和针、阔叶混交林都有分布[5]。作为昆虫病原真菌,蝉棒束孢可侵染同翅目()[6]和鳞翅目()[7]等多种昆虫,具有良好的生物控制效果。
蝉棒束孢世界广布,产地众多,在生境、形态、化学成分和核酸水平等多个层次都具有多样性[1]。李建平等[8]研究了不同居群蝉棒束孢的形态多样性,研究发现蝉棒束孢形态特征在居群内个体间变异丰富;何亚琼等[9]研究了人工培养柞蚕蝉花不同部位的代谢组差异,结果发现柞蚕蝉花不同部位的代谢物显著不同,其虫体表面菌丝次生代谢产物较多。张胜利等[10]研究了引起蝉若虫地方病的蝉棒束孢种群遗传结构,结果表明3个地方病种群均表现出较高的遗传多样性。ISSR分子标记技术具有引物设计容易、操作简单、多态性好、可重复性高等优点[11]。张海燕等[12]利用ISSR分子标记分析了江西省6个地区90株金龟子绿僵菌的种群遗传结构,可将研究的菌株分成3个来源复杂的分支。但关于不同地理来源的蝉棒束孢遗传异质性的研究鲜见报道,故作者希望通过本研究来为今后研发利用蝉棒束孢提供理论依据。
1 材料与方法
1.1 菌株及其培养
供试的42株蝉棒束孢菌株来自11个不同地点,对各菌株的编号、采集地点和寄主等信息详见表1。
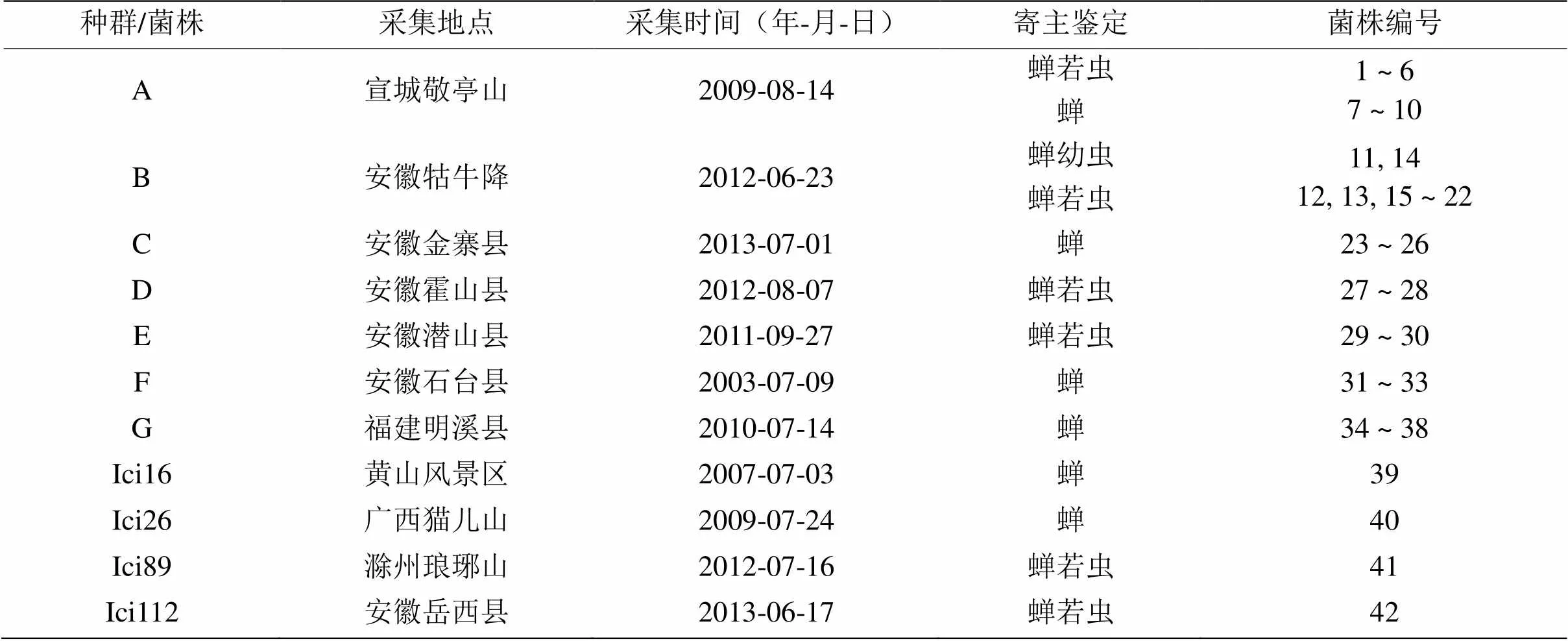
表1 供试蝉棒束孢菌株的采集地点、采集时间、寄主、编号
将蝉棒束孢菌株接种于SDAY(葡萄糖40 g、蛋白胨10 g、酵母粉10 g、琼脂20 g、蒸馏水1 000 mL)培养基上,在25 ℃的培养箱中培养14 d左右,记录菌落颜色、形状和质地。待产孢后,显微镜下观察产孢结构及分生孢子形态和大小,并拍照记录。
1.2 菌株DNA提取和ISSR扩增
将供试菌株接种于铺有玻璃纸的SDAY培养基上,于25 ℃恒温培养箱中培养3 d,待长出大量菌丝后用CTAB法提取总DNA[13]。
ISSR引物筛选及ISSR-PCR扩增,参考张胜利等[10]方法,所用引物如表2所示。
1.3 ISSR数据分析
根据电泳图谱的迁移率不同来识别多态性条带,利用BandScan V5.0软件进行电泳条带迁移率分析,把同一迁移率的带看为公共带,分别记为“1”(代表显性基因)和“0”(代表隐性基因)。多态位点百分率()、Shannon信息多样性指数、实际观察等位基因数和有效等位基因数()、遗传分化系数等分析方法参考文献[14]。利用NTSYSpcversion2.10e软件进行遗传相似系数与遗传距离分析,并通过非加权法(UPGMA)对数据矩阵进行聚类及主坐标分析[15]。

表2 ISSR扩增所用引物及其核苷酸序列
2 结果与分析
2.1 蝉棒束孢形态和显微特征
蝉棒束孢孢梗束直立,简单或近顶部不规则分枝,常棒状,从覆被寄主蝉的白色至淡黄色菌丝体长出,近顶部由于产生分生孢子呈粉状或丛卷毛状,乳白色至淡黄褐色[16]。在SDAY培养基上,菌落生长速度较快,菌落正面莲子白到浅黄色,绒毛状,表面有明显轮纹;约7 d左右产孢,14 d时大量产孢,菌落呈粉状;培养后期表面有水珠渗出。菌丝管状,有隔,壁光滑,粗约0.9~2.1 μm。分生孢子梗分支,呈轮状,粗约1.1~2.1 μm,其上2~5个瓶梗成轮状排列。瓶梗基部多为球形膨大,向上形成粗约0.5 μm的颈部。瓶梗向基式产生分生孢子链,分生孢子柱形、单胞、壁光滑、无色、透明、多对称、少弯曲,大小为3.5~6.5 μm × 1.5~3.5 μm。

1和2. 蝉棒束孢标本;3. 菌落正面;4. 产孢结构,5和6. 成熟孢子;标尺 Bar = 10 μm。
Figure 1 Morphological and microscopic characteristics of

表3 供试引物及其扩增特性
注:表中数值为平均值±标准差。下同。
2.2 不同采集地蝉棒束孢遗传异质性分析
2.2.1 蝉棒束孢ISSR扩增产物的多态性 由表3可以看出,以本次实验所筛选出的9个ISSR扩增引物对42株蝉棒束孢菌株的ISSR-PCR扩增反应,均能得到清晰、结果稳定的条带。不同的引物扩增出来的条带数量不一样,可见ISSR引物对蝉棒束孢菌株的特异性不同。本实验一共扩增得到141个特异性条带,平均每个引物扩增15.5个条带。9个引物扩增的条带的平均多态性为94.7%,其中引物M10扩增的条带多态性最低(84.2%),5个引物M8、P10、P12、P18和P19 的多态性高达100%。平均基因多样性指数范围为0.20~0.33,Shannon 信息指数范围为0.32~0.49。图2为引物M11的ISSR-PCR图谱。
2.2.2 蝉棒束孢地方遗传多样性分析 结合表1,根据实验数据结果分析(表4),42株蝉棒束孢从种群水平上看,遗传多样性从大到小依次是:宣城敬亭山种群(Pop A)最高,达到81.6%,其次是安徽牯牛降76.6% (Pop B),再次是福建明溪县61.0% (Pop G)、安徽金寨县49.7% (Pop C)、安徽霍山县39.7% (Pop D)和安徽潜山市37.6% (Pop E),安徽石台县种群(Pop F)的种群遗传多样性最低,只有27.0%。

图2 引物M11的ISSR-PCR图谱
Figure 2 ISSR-PCR profiles ofsamplesby primer M11
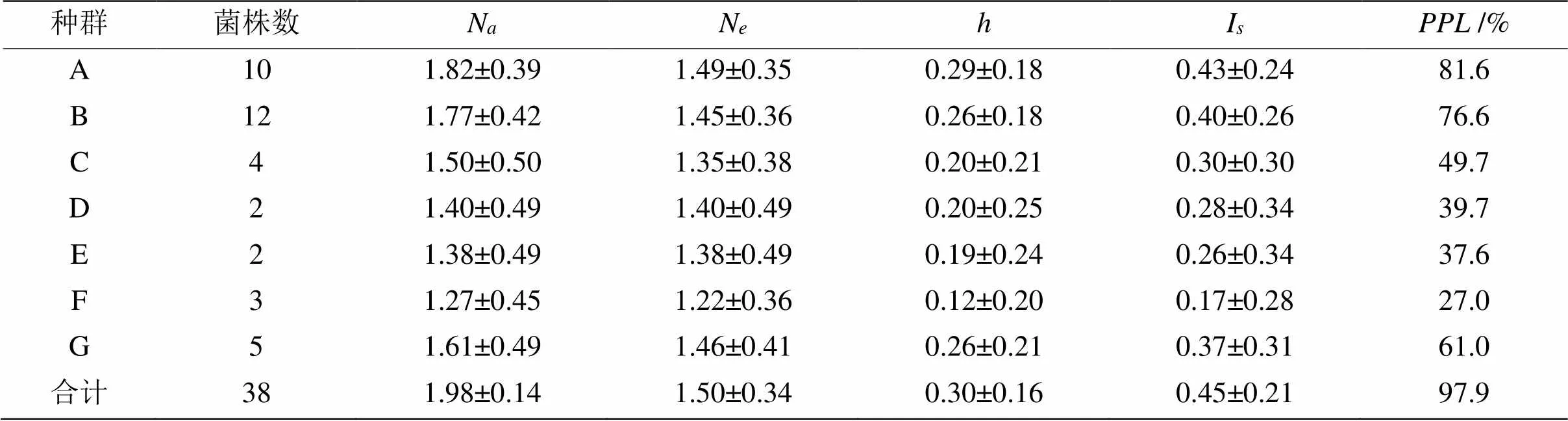
表4 不同地理来源蝉棒束孢遗传多样性分析
:观察等位基因数;:有效等位基因数;:基因多样性指数;I:Shannon信息指数;:多态位百分率。
2.2.3 UPGMA聚类分析 采用UPGMA法分析不同采集地蝉棒束孢菌株遗传相似系数。结果(图3)显示,其相似系数在0.56~0.94之间,具有很高的遗传异质性。本实验以0.75处为分界线,将42株蝉棒束孢菌株的聚类图分为了8个分支。分支Ⅰ包括采集自宣城敬亭山菌株编号1、2、4、7和10;采集自安徽牯牛降菌株编号12、16、18、19、20、21和22;采集自安徽金寨菌株编号25;采集自安徽霍山菌株编号27;采集安徽潜山菌株编号30;采集自福建明溪菌株编号34和36和采集自安徽岳西菌株编号为42,共18个菌株。分支Ⅱ只有采集自黄山风景区菌株编号39的1个菌株。分支Ⅲ包括采集自宣城敬亭山菌株编号5和8;采集自牯牛降菌株编号17;采集自安徽金寨县菌株编号23、24和26;采集自安徽石台菌株编号31、32和33;采集自福建明溪菌株编号37和38 和采集自滁州琅琊山菌株编号41共12个菌株。分支Ⅳ为采集自牯牛降菌株编号为11的1个菌株。分支Ⅴ为采集自宣城敬亭山菌株编号为6和9;采集自福建明溪菌株编号35和采集自广西猫儿山菌株编号为40,共4个菌株。分支Ⅵ有采集自牯牛降菌株编号13、14和15和采集自安徽霍山菌株编号为28,共4个菌株。分支Ⅶ只有采集宣城敬亭山菌株编号为3的1个菌株。分支Ⅷ只有采集自安徽潜山菌株编号为29的1个菌株。由图3可见,部分采集地蝉棒束孢的亲缘关系较近,聚为一群,其中采集自安徽牯牛降菌株编号18和19菌株相似系数最大,可见它们的亲缘关系最近。但总体来看,42株蝉棒束孢并没有完全根据地理位置聚集,各个种群的谱系分布是随机的,这说明了蝉棒束孢种群间存在较少的遗传变异。

图3 基于遗传相似系数的UPGMA聚类图
Figure 3 The UPGMA clustering map based on genetic similarity coefficient
2.2.4 蝉棒束孢种群遗传分化的比较分析 用POPGENE 32 计算出的遗传变异结果(表5)显示:蝉棒束孢种群间存在一定程度的遗传分化,7个种群的遗传多样性为0.299 6,其中种群内遗传多样性()为0.216 8,基因分化系数()为0.276 3,表明有27.63%的遗传变异存在于种群之间,有72.37%的遗传变异存在于种群内部,种群间的遗传分化要小于种群内部的分化[17]。不同地方的种群间的平均基因流()较大,为1.309 8。可见蝉棒束孢从不同地理位置分散出去而导致不同种群之间基因交流的频率较大,从而导致蝉棒束孢种群遗传分化程度与地理位置没有一定的关联性。
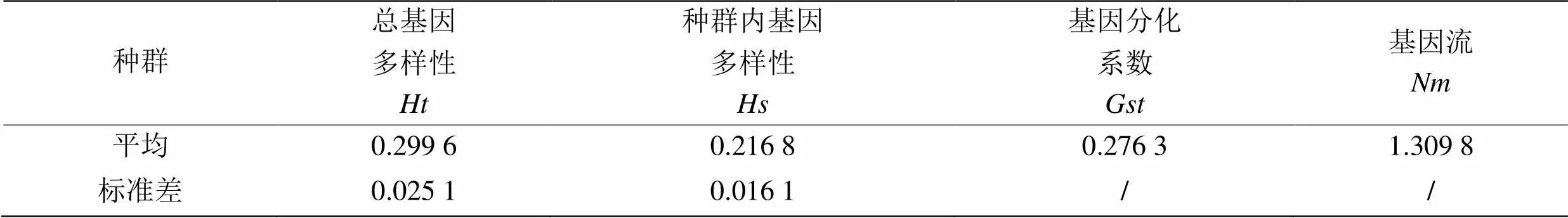
表5 蝉棒束孢种群基因多样性Nei’s分析
: 总基因多样性;: 种群内基因多样性;: 基因分化系数;: 基因流。
3 讨论与结论
蝉棒束孢(蝉花)是我国传统的名贵中药材,在我国已有至少1 500多年的应用历史[18]。然而长期以来,蝉花的分类学地位几经变动,常与一些相近种相混淆,导致其分类状态比较混乱,严重限制其开发利用,目前已有多位学者致力于梳理修正其正确的分类地位[1]。蝉棒束孢全球广布,其产地、生境、形态众多,呈现出较为丰富的多样性。其野外标本形态特征呈现一定的多样性,多数蝉棒束孢孢梗束从寄主头部直立长出,简单或近顶部不规则分枝,常棒状,偶有头状,多数为乳白色至淡黄褐色;寄主多为蝉若虫,偶见蝉成虫。遗传异质性和遗传分化是物种保护的基础,物种在自然进化过程中,遗传异质性越高,遗传变异越丰富,说明物种对环境的适应力越强,反之则对环境的适应力越弱[19]。一个物种或种群所包含的遗传多样性越高,它对环境的适应能力就越强。本实验通过ISSR-PCR分子标记技术对采集自不同地理位置的42株蝉棒束孢进行遗传异质性分析。结果共扩增出141个特异性条带,9个引物扩增的条带平均多态性为94.7%,其中5个引物扩增的条带多态性高达100%。可见,ISSR-PCR分子标记技术是研究蝉棒束孢遗传异质性的一种高效方法。
根据不同采集地,将42株蝉棒束孢划分为不同的种群。从种群水平上分析,其中宣城敬亭山种群(Pop A)的遗传异质性最高,达到81.6%,安徽石台县种群(Pop F)的种群遗传多样性最低,只有27.0%。可见,部分蝉棒束孢种群遗传异质性较低,这可能与人为活动频繁、生态环境破坏严重有关。因此,需要对该种群进行人为保护,促进该种群与其他种群的基因交流。利用UPGMA法分析不同采集地蝉棒束孢菌株遗传相似系数,42株蝉棒束孢并没有完全根据地理位置聚集,各个种群的谱系分布是随机的,这说明了蝉棒束孢种群间存在较少的遗传变异。蝉棒束孢种群间存在一定程度的遗传分化,7个种群的遗传多样性为0.299 6,其中种群内遗传多样性()为0.216 8,基因分化系数()为0.276 3。不同地方的种群间的平均基因流()较大,为1.309 8。可见蝉棒束孢从不同地理位置分散出去而导致不同种群之间基因交流的频率较大,蝉棒束孢遗传变异和地理来源没有相关性,这一结论与张胜利等[10]研究结果一致。本次实验探究了不同采集地蝉棒束孢的遗传异质性以及种群结构,阐明蝉棒束孢种群内和种群间的遗传异质性和基因流等信息,警示人们在合理利用蝉棒束孢的同时,应该重视对环境的保护,减少对自然环境的破坏,保护蝉棒束孢的遗传多样性,维持自然平衡。
[1] 李建平, 张铁, 曾文波. 蝉花虫草分类地位及其遗传多样性研究进展[J]. 中国食用菌, 2019, 38(11): 1-5, 16.
[2] 胡海燕. 蝉棒束孢(蝉拟青霉)的遗传多样性研究[D]. 贵阳: 贵州大学, 2009.
[3] 陈以平. 陈以平学术经验拮英, 龙华医院名医临症录[M]. 上海: 上海中医药大学出版社, 2010.
[4] 李增智, 陈祝安, 陈以平. 国宝虫草金蝉花[M]. 合肥: 合肥工业大学出版社, 2014.
[5] 卫亚丽, 杨茂发, 邹晓, 等. 蝉棒束孢菌的生物学活性研究进展[J]. 贵州农业科学, 2014, 42(12): 142-148.
[6] 邹晓, 刘爱英, 梁宗琦. 紫外线诱变蝉拟青霉对白粉虱致病性的影响(Ⅰ)[J]. 菌物研究, 2004, 2(4): 35-39.
[7] 陈祝安, 黄基荣, 许益伟, 等. 蝉拟青霉防治菜粉蝶幼虫试验[J]. 生物防治通报, 1990, 6(3): 131-133.
[8] 李建平, 张铁, 曾文波. 蝉花居群形态变异式样[J]. 中国食用菌, 2018, 37(3): 64-69.
[9] 何亚琼, 彭凡, 赵铖, 等. 人工培养柞蚕蝉花不同部位的代谢组差异[J]. 微生物学通报, 2021, 48(2): 480-492.
[10] 张胜利, 于士军, 栾丰刚, 等. 引致蝉若虫地方病的蝉棒束孢种群遗传结构[J]. 应用生态学报, 2017, 28(5): 1679-1686.
[11] 崔学强, 唐璇, 黄昌艳, 等. 基于ISSR标记的卡特兰种质资源遗传多样性分析[J]. 西南农业学报, 2020, 33(7): 1383-1388.
[12] 张海燕, 张扬, 何万存, 等. 江西省萧氏松茎象栖境内绿僵菌的种群遗传异质性[J]. 江西农业大学学报, 2017, 39(2): 286-294.
[13] WANG S B, MIAO X X, ZHAO W G, et al. Genetic diversity and population structure among strains of the entomopathogenic fungus,, as revealed by inter-simple sequence repeats (ISSR)[J]. Mycol Res, 2005, 109(12): 1364-1372.
[14] 陈名君, 黄勃, 刘玉军, 等. 马尾松纯林中球孢白僵菌种群的遗传异质性[J]. 应用生态学报, 2010, 21(10): 2627-2634.
[15] ROHLF F J. NTSYS-pc: Numerical taxonomy and multivariate analysis system, vision 2.1, user guide[M]. New York: Exeter Software, 2000.
[16] 曾文波, 常衬心, 李建平, 等. 蝉棒束孢显微形态变异式样[J]. 微生物学报, 2017, 57(3): 350-362.
[17] 齐永霞, 陈方新. 玉米根际球孢白僵菌群体遗传多样性的ISSR分析[J]. 植物保护, 2018, 44(3): 67-73.
[18] (南朝宋)雷斅撰著. (清)张骥补辑. 施仲安校注. 雷公炮灸论[M]. 南京: 江苏科学技术出版社, 1985
[19] 余金凤, 陈正启, 周汐, 等. 云南变绿红菇的遗传多样性与群体遗传分化研究[J]. 食药用菌, 2020, 28(3): 178-184.
Study on genetic heterogeneity offrom different sources
CHEN Mingjun1, LU Linqin1, LIN Yan1, LIU Yujun2, XIE Jiyu1
(1. Anhui Provincial Key Laboratory of Microbial Control, Anhui Agricultural University, Hefei 230036;2. Anhui Academy of Science and Technology, Hefei 230031)
is a kind of entomopathogenic fungus and a traditional Chinese medicinal material, which is widely distributed in the world. By the method of ISSR-PCR, the genetic heterogeneity of 42isolates from different collection sites was analyzed. A total of 141 loci were obtained with 9 ISSR primers, and the percentage of polymorphic loci was 94.7%. From the level of population, the genetic heterogeneity of Jingting Mountain population (Pop A) was the highest (81.6%), while the genetic heterogeneity of Shitai County population (Pop F) was the lowest (27.0%). The gene diversity () within the population was 0.216 8, Nei’s gene differentiation coefficient () was 0.276 3, and the average gene flow () was 1.309 8. The results suggested that the genetic heterogeneity ofis randomly distributed, and there is no obvious correlation with geographical origin. The high level of gene exchange among populations from different geographical origins is the main reason for the genetic variation of the population.
; ISSR molecular marker; genetic structure; genetic heterogeneity
S476.12
A
1672-352X (2021)03-0452-06
10.13610/j.cnki.1672-352x.20210706.020
2021-7-7 9:56:58
[URL] https://kns.cnki.net/kcms/detail/34.1162.S.20210706.1659.040.html
2020-10-12
2019年省级大学生创新创业训练计划项目,安徽农业大学2020年度研究生创新基金项目(2020ysj-21)和合肥市博士后工作站科研活动经费项目(2018HFB021)共同资助。
陈名君,副教授。E-mail:chenmingjun2005@126.com

