低乙醛啤酒酵母风味优势菌株的选育
官 钰,刘春凤,李 崎,贺秀丽,谢 鑫,郭立芸,王金晶*
低乙醛啤酒酵母风味优势菌株的选育
官 钰1, 2,刘春凤1, 2,李 崎1, 2,贺秀丽3,谢 鑫3,郭立芸3,王金晶1, 2*
(1. 江南大学生物工程学院,工业生物技术教育部重点实验室,无锡 214122;2. 江南大学生物工程学院,酿酒科学与工程研究室,无锡 214122;3. 北京燕京啤酒股份有限公司技术中心,啤酒酿造技术北京市重点实验室,北京 101300)
啤酒发酵过程中的乙醛主要由啤酒酵母代谢产生,其含量极大地影响啤酒的风味和品质。目前已有大量研究通过选育啤酒酵母来降低啤酒中乙醛含量,但由于大部分采用了分子手段或不符合食品安全条件的方式,尚未真正投入到啤酒的实际生产应用中去。本研究中,以啤酒企业提供的啤酒酵母YJ为出发菌株,经过常压室温等离子体诱变(Atmospheric and room temperature plasma, ARTP)处理,双硫仑平板初筛,摇瓶发酵复筛,获得了遗传稳定性和发酵稳定性良好的低产乙醛诱变菌株S48,进而在啤酒工厂进行100 L小试的发酵验证。结果发现,与出发菌株相比,诱变菌发酵的啤酒样品中乙醛含量降低了23.69%,其酒精度有所提高,苦味质、总酸和双乙酰含量更低,主要风味物质无较大差异,醇酯比及感官分析结果更加协调。
酵母;乙醛;ARTP;双硫仑;啤酒
乙醛是影响啤酒风味组成和风味稳定性最重要的醛类化合物,同时也是酒精饮料中引起人类致癌的物质之一[1-2]。啤酒中乙醛含量过高时会带来不愉快的青苹果味、青草味和氧化味等,造成消费者口感的不协调,进一步引起“上头”等不适生理反应[3-4]。另外,乙醛也是啤酒中许多低阈值成分的前体,如双乙酰和乙偶姻[5]。一般优质成熟的工业啤酒中乙醛含量在2~10 mg·L-1[6]。
在啤酒的发酵和成熟过程中,啤酒酵母是乙醛的主要来源[7]。葡萄糖代谢所产生的丙酮酸,一部分转化为乙酰辅酶A进入TCA循环,另一部分经丙酮酸脱羧酶催化生成乙醛[8]。乙醛可以在乙醇脱氢酶的作用下生成乙醇,或在乙醛脱氢酶的作用下生成乙酸,从而进一步被代谢消耗[9]。抑制剂在菌种筛选的过程中有着广泛的应用,双硫仑能有效抑制乙醛脱氢酶的活性,利用双硫仑-乙醇平板能够有效筛选到具有高乙醛脱氢酶活性的酵母菌[10]。
常压室温等离子体诱变(Atmospheric and room temperature plasma,ARTP)是近年来利用在大气压下产生的,温度在25~40 ℃之间,具有高活性粒子浓度的等离子体射流的新型诱变技术,具有操作简便、设备简单、条件温和、安全性高及诱变快速等优良特性[11-12]。对啤酒酵母等真菌的诱变会比常规的紫外诱变效果更加明显,且诱变菌能够被用于食品行业的生产[13]。本研究以双硫仑作为抑制剂结合ARTP诱变技术,对燕京啤酒提供的出发菌株进行诱变和筛选,以期获得发酵性能优良的低产乙醛的啤酒酵母菌株,并能成功投入工业啤酒生产的应用。
1 材料与方法
1.1 材料
1.1.1 菌株 啤酒酵母()YJ,啤酒企业提供;啤酒酵母()S48 ARTP诱变获得。
1.1.2培养基 麦汁培养基:14 ºP麦汁(糖化料水比为1∶4,糖化过程为:48 ℃, 30 min → 63 ℃, 60 min → 72 ℃, 30 min → 78 ℃, 10 min。
双硫仑-乙醇培养基(g·L-1):乙醇,20;双硫仑,0.000 4;(NH4)2SO4,5;KH2PO4,1;NaCl, 0.1;MgSO4·7H2O,0.1;CaCl2,0.1;酵母膏,0.1;121 ℃灭菌 20 min。
酵母培养基(g·L-1):酵母浸出粉,10;蛋白胨,20;葡萄糖,20;115 ℃灭菌15 min。
乙醛培养基(g·L-1):(NH4)2SO4, 5;KH2PO4, 1;NaCl,0.1;MgSO4·7H2O,0.1;CaCl2,0.1;酵母膏,0.1;121 ℃灭菌 20 min,加乙醛0.1(膜过滤除菌后,加入灭菌后的培养基中)。
1.1.3试剂 麦芽,中粮集团有限公司;酵母浸出粉、蛋白胨和琼脂粉,生工生物工程(上海)股份有限公司;无水葡萄糖、无水乙醇、(NH4)2SO4、KH2PO4、NaCl、MgSO4·7H2O和CaCl2国药集团化学试剂有限公司;乙醛(色谱纯),阿拉丁试剂(上海) 有限公司;3-庚酮(色谱纯),Sigma-Aldrich公司;双硫仑,Alorich化学试剂公司;Alcohol Dehydrogenase Assay Kit,Bio Vision公司;乙醛脱氢酶(ALDH)活性检测试剂盒,上海索莱宝生物科技有限公司。标准溶液包括乙醛和3-庚酮等。
1.1.4 仪器与设备 超净台(SW-CJ-2FD),苏净集团安泰公司;高压灭菌锅(HVE-50),日本Hirayama公司;紫外可见分光光度计(UV-2000),尤尼柯(上海)仪器有限公司;显微镜(CX21FS1) ,日本Olympus公司;阿贝折光仪,上海豫光仪器有限公司;顶空气相色谱仪(GC-2010),日本岛津(Shimadzu)公司;ARTP—II型常压室温等离子体诱变系统,无锡源清天木生物科技有限公司;台式冷冻离心机(5804 R),德国Eppendoff公司;磁力搅拌器(81-2) ,上海司乐仪器有限公司;生化培养箱(SPX-250),上海跃进医疗器械有限公司;电热恒温水浴锅(HHS) ,生化培养箱(BSP-250)上海博讯实业有限公司医疗设备厂。
1.2 方法
1.2.1 啤酒发酵 用接种环挑取啤酒酵母菌株于10 mL 14 ºP麦汁试管中,28 ℃培养36 h后转接1 mL菌液于100 mL 14 ºP麦汁三角瓶中(随发酵体系的增大,种子液的培养量适当增加),28 ℃培养36 h后放置22 ℃恒温沉降6 h,再转入15 ℃恒温培养箱静置6 h,取适量酵母泥接种至准备好的麦汁三角瓶中,接种量约为1×107CFU·mL-1。摇匀后塞上发酵栓,用无菌水液封发酵栓后11 ℃发酵7 d。
1.2.2 ARTP诱变选育 从斜面上取啤酒酵母于10 mL酵母培养基(YPD)试管中活化,36 h后转接1 mL菌液于100 mL YPD三角瓶中培养至对数生长中期。取适量菌液于EP管中12 000 r·min-1离心1 min,弃上清后用生理盐水洗涤,12 000 r·min-1离心1 min后重复洗涤离心1次,用生理盐水稀释至OD600为1,再将其进一步稀释10倍。
将10 μL稀释好的菌液均匀涂布在ARTP载片上,以高纯的氦气作为ARTP的工作气源,设置电源功率100 W,气体流量10 SLM固定不变,调整好每个载片的诱变时间,等离子照射处理后将载片投入含有生理盐水的EP管中,加入适量YPD液体培养基,28 ℃震荡培养1 h后涂布于相应的平板上。
1.2.3 乙醛驯化 将诱变菌于10 mL YPD培养基中活化24 h后,取200 μL加入10 mL乙醛培养基中,18 ℃,180 r·min-1摇床培养72 h后取1 mL菌液至新一批乙醛培养基中继续驯化,如此重复,持续转接驯化。
1.2.4 乙醛含量的测定 采用顶空气相色谱法测定啤酒发酵液中乙醛的含量[14]。将发酵液离心后取上清,在顶空瓶中分别添加4 mL发酵液,1 mL 30 mg·L-1的3-庚酮内标和1.8 g NaCl。检测条件为:FID检测器温度为250 ℃;色谱柱初始温度40 ℃,以10 ℃·min-1的速度升至180 ℃。
1.2.5 发酵液的理化指标检测 酒精度、原浓、发酵度、苦味值、双乙酰、残糖、总酸和pH等发酵液基本理化指标的检测均参照国标(GB/T4928- 2008)啤酒分析方法进行检测[15]。
1.2.6 酵母细胞乙醛脱氢酶以及醇脱氢酶的酶活测定 发酵过程中,酵母细胞内的乙醛脱氢酶酶活以及醇脱氢酶酶活采用相应的试剂盒进行检测,测定方法详见Alcohol Dehydrogenase Assay Kit、Bio Vision、乙醛脱氢酶(ALDH)活性检测试剂盒及索莱宝的使用说明。
2 结果与分析
2.1 ARTP诱变
将对数生长中期的啤酒酵母YJ进行ARTP诱变选育,结果(图1)显示,随着离子束照射时间的增长,酵母细胞的存活率迅速下降:当照射时间达到80 s以上时,酵母细胞存活率为零;处理时间为45 s左右,致死率为88.7%。因此我们选定啤酒酵母YJ进行ARTP诱变的照射处理时间为45 s。
采用点样法确定双硫仑对YJ的致死浓度,结果(图2)显示,在梯度浓度的双硫仑抑制剂平板上从左至右点样,菌液浓度分别为107、106、105和104。ARTP诱变过程中,原始涂布于载片的菌液浓度为106,诱变结束后10 μL菌液在生理盐水中稀释至1 000 μL体系,菌液体系浓度降低为104。图2(b)中平板上点样浓度为104时,区域几乎已无菌种生长,达到抑制剂所需的致死率要求。最终选择双硫仑浓度0.3 mg·L-1为诱变菌筛选平板的抑制剂浓度。

图1 ARTP诱变啤酒酵母YJ存活率曲线
Figure 1 Survival curve of beer yeast YJ after ARTP mutagenicity

注:图(a)、(b)和(c)中的平板双硫仑浓度分别为0.1、0.3和0.5 mg·L-1。
Figure 2 The growth of disulfiram gradient plates by spotting method
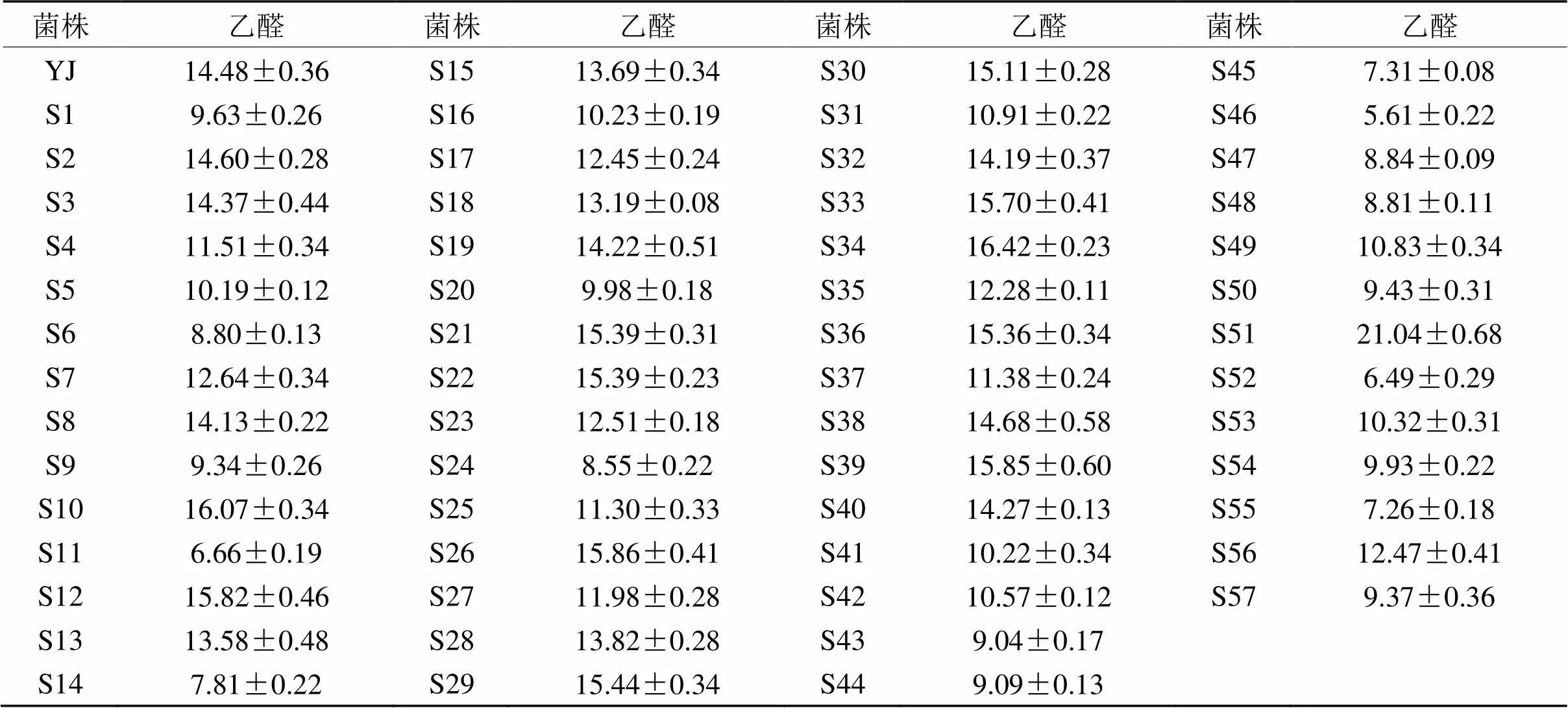
表 1 250 mL 14 ºP麦汁三角瓶中菌种的产乙醛情况
将啤酒酵母菌株YJ在ARTP仪上诱变处理45 s后,培养1 h左右,稀释涂布在抑制剂浓度为0.3 mg·L-1的双硫仑-乙醇平板上,28 ℃培养5 d后,随机选取了57株诱变菌进行发酵验证。
2.2 三角瓶发酵实验
2.2.1 250 mL三角瓶发酵实验 将ARTP诱变获得的57株诱变菌株以及出发菌株YJ接入250 mL 14 ºP麦汁三角瓶中进行第1批发酵筛选实验,在11 ℃恒温培养条件下发酵7 d,结束后取样,采用顶空气相色谱法测定啤酒发酵液中乙醛的含量,每组两个平行样品,所得结果数据如表1所示。与出发菌株YJ发酵液中乙醛含量检测结果相比,57株诱变菌株中,有44株菌株乙醛产量低于出发菌株,诱变菌株的正向突变率较高,约为77%。
2.2.2 500 mL三角瓶发酵实验 选取表1中发酵液乙醛含量较低的的10株诱变菌株(S6、S11、S14、S24、S45、S46、S47、S48、S52和S55)以及出发菌株YJ接入含有14 ºP麦汁的500 mL三角瓶进行第2批发酵筛选,相同条件发酵结束后取样检测发酵液乙醛含量,结果如图3(a)所示。第2批发酵实验的10株诱变菌株中,有8株诱变菌株的乙醛产量低于出发菌株,其中诱变菌株S47和S48的乙醛产量最低。
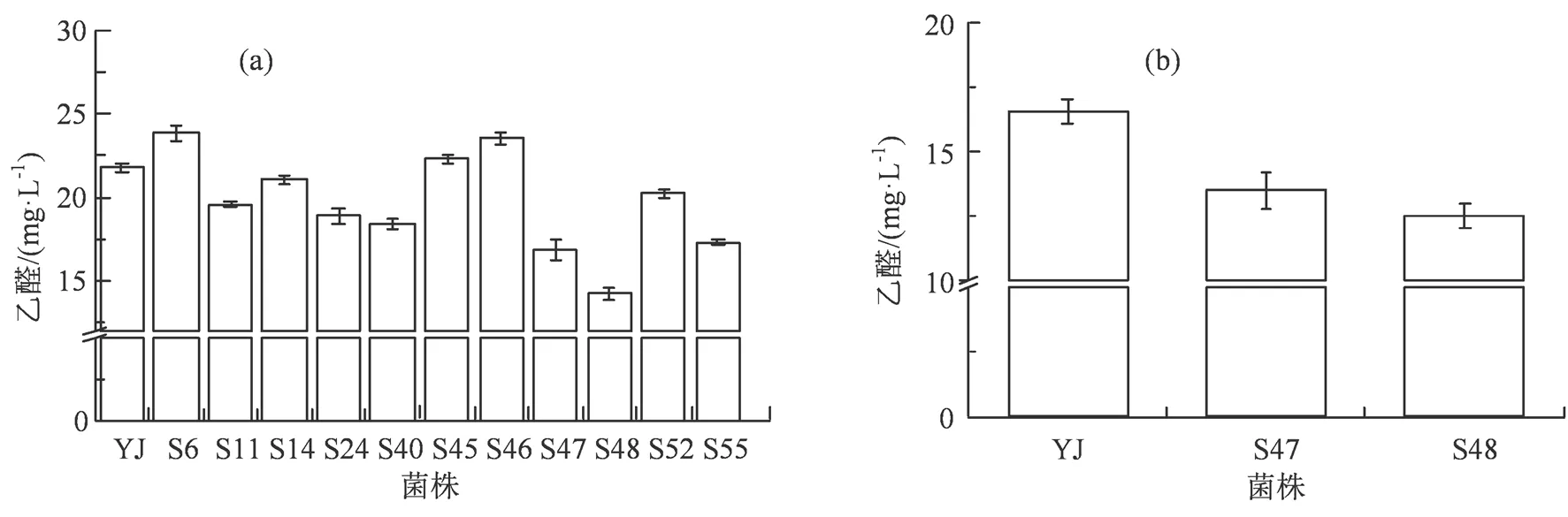
图3 500 mL(a)以及3 L(b)三角瓶发酵产乙醛情况
Figure 3 Acetaldehyde production of 500 mL 14 ºP wort (a) and 3 L 14 ºP wort (b) fermentation

表2 3次三角瓶发酵筛选实验中YJ与S48的产乙醛情况对比

表3 成品酒理化指标检测结果(贮酒9 d)
2.2.3 3 L三角瓶发酵实验 研究进一步选取S47以及S48进行第3批3 L 14 ºP麦汁三角瓶发酵实验,结果如图3(b)所示,诱变菌株S47和S48的发酵液中乙醛含量较出发菌株分别降低了18.50%和24.37%。因此,最终选择诱变菌株S48进行工厂小试。
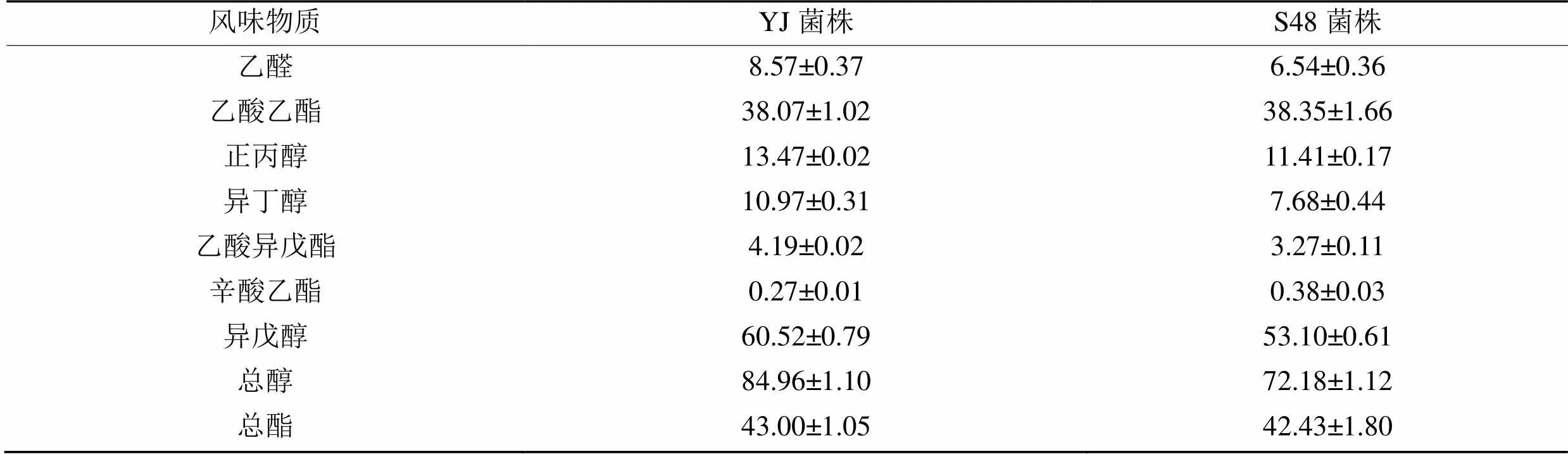
表4 成品酒主要风味物质检测结果(贮酒9 d)
啤酒发酵过程中,乙醛在主发酵3 d左右大量产生,由于酵母数量的急剧增加,代谢旺盛,乙醛大量积累而达到峰值,但随着发酵的继续,罐内压力升高,乙醛含量急剧下降。发酵结束后的乙醛的含量受麦汁质量、溶氧量、酵母细胞数及后发酵过程代谢等众多因素的影响,因此无法根据绝对值判断诱变菌株的降乙醛能力,需要通过与出发菌株比较的相对值来判断[16-17]。如表2所示,在3次发酵筛选实验中,不同批次的发酵液乙醛绝对值均出现波动情况,随着发酵体系的放大,诱变菌株S48降低乙醛的能力也有所减弱,这是由于放大过程十分复杂,比上游筛选工作所涵盖的内容体量更大,需要综合更多的因素加以考虑。
2.3 生产小试
2.3.1 成品酒理化指标检测 工厂小试发酵结束后贮酒9 d的成品酒理化指标检测结果(表3)显示,在诱变菌株S48在原麦汁浓度略低于出发菌株的情况下,酒精度稍有增加,发酵性能有所提升。与此同时,诱变菌株的苦味值、总酸及残糖量都略有下降,下降比例分别为7.9%、12.3%和54.6%,酒体的口感更加协调。双乙酰的含量较出发菌株降低了25%。由于双乙酰含量与乙醛代谢有着密切的关联,一定条件下可以直接由活性乙醛在乙酰辅酶的作用下缩合而成,其含量的减少也一定程度反映出了诱变菌株乙醛还原能力的提升[18]。

图4 感官分析雷达图(贮酒11 d)
Figure 4 Radar chart of sensory analysis (storage for 11 days)

表5 回收酵母泥的主要性能对比
2.3.2 成品酒主要风味物质的检测 进一步对成品酒中醛类、酯类和醇类主要风味物质组分进行了检测分析,结果(表4)显示:与出发菌株YJ相比,诱变菌株S48的成品酒(贮酒9 d)样品中,乙醛含量降低约23.69%,这表明诱变菌株的乙醛还原能力的确获得了良好的提升,在100 L的发酵体系中依旧能保持稳定的低产乙醛性能。此外,高级醇和挥发酯两大类物质是啤酒的重要风味成分,高级醇含量应控制在100 mg·L-1以下,含量过高容易引起“上头”等不良生理反应[19]。与出发菌株相比,诱变菌株发酵液中,总醇含量降低了15.04%,乙醇含量略有增加,正丙醇、异丁醇和异戊醇等含量均有所降低,说明在未减少乙醇产量的同时,普遍降低了发酵液中的高级醇含量;另一方面,总酯的含量无较大差异,因此诱变菌株S48发酵的成品啤酒中的醇酯比出发菌株降低了15%。
辛酸乙酯具有白兰地酒香味特征,S48的成品酒发酵液中辛酸乙酯含量升高了40.74%,在增加啤酒的特征香气方面有一定的帮助[20]。
2.3.3 成品酒感官分析 感官分析雷达图将科学模型与感官特性相结合,使用心理物理模型以综合评价酒体的感官体验[21]。图4为7位专业国家级品评人员对贮酒11 d的出发菌株YJ以及诱变菌S48两款成品酒的感官评分雷达图。由图4可以看出:S48的麦芽香、酒花香和甜味得分略高于YJ,高级醇味略明显,杀口感弱于出发菌株YJ;异味方面,两组均存在硫味,但S48的硫味不及YJ明显。因此,S48的成品酒感官评定综合结果更加良好。
2.3.4 回收酵母泥的主要性能对比 从理论上讲,发酵性能良好的酵母泥,可一直使用多代。在实际生产过程中,由于酵母菌种本身的变化及外界微生物的污染,随着酵母使用代数的增加,其发酵性能和活力等会有所降低,而死亡率、衰老比例等会有所上升[22]。一般啤酒厂的优良菌种回收的酵母泥需控制在能连续使用5~7代[23]。
表5展示了YJ以及S48两组酵母泥的主要性能对比数据。由表5可以看出,两者的电导率和活力无显著性差异,诱变菌株S48酵母泥的死亡率和衰老比例显著低于出发菌株YJ,分别降低了53.3%及46.6%。另外,S48的自溶系数较大,表明其自溶程度较低。在凝聚性方面,S48仅为1.35%,显著低于YJ(64.88%)。啤酒酵母产生乙醛的能力与凝聚性的关系尚未有研究说明,后续将进一步探究。
2.4 发酵过程中代谢关键酶的酶活检测
在啤酒的发酵过程中,啤酒酵母消耗葡萄糖、麦芽糖等碳源产生的丙酮酸,一部分转化为乙酰辅酶A进入TCA循环,另一部分经丙酮酸脱羧酶催化生成乙醛。乙醛脱氢酶以及乙醇脱氢酶是乙醛代谢的关键酶,能分别将乙醛还原为乙酸和乙醇。双硫仑能够有效抑制乙醛脱氢酶的活性,筛选所得诱变菌理论上应具有较高的乙醛脱氢酶酶活,因此我们跟踪检测了发酵过程中的乙醛脱氢酶以及醇脱氢酶的活性。从实验结果(图5)可知,出发菌以及诱变菌的醇脱氢酶活性水平基本一致,在发酵后期S48略高于YJ,而S48的乙醛脱氢酶活性始终高于YJ,且在发酵第3至第4天的活性较高,符合发酵过程中乙醛含量先增加后减少的趋势,体现出了双硫仑作为低产乙醛啤酒酵母筛选抑制剂的有效性。
2.5 遗传稳定性实验
传统诱变方法选育获得的菌株易为发生优势性状的回复突变,其稳定性需要进行长时间的针对性驯化实验和适宜的保藏方法来维持。研究对S48进行了3个月的乙醛驯化实验,连续传代30次后,分别取第0、第5、第10、第15、第20、第25和第30代进行发酵验证。其乙醛检测结果(图6)显示,经过多次传代后,菌株S48和YJ的乙醛产量分别稳定在9.84和14.92 mg·L-1,相对出发菌株YJ, S48乙醛产量能维持在降低34%左右,具有良好的遗传稳定性。
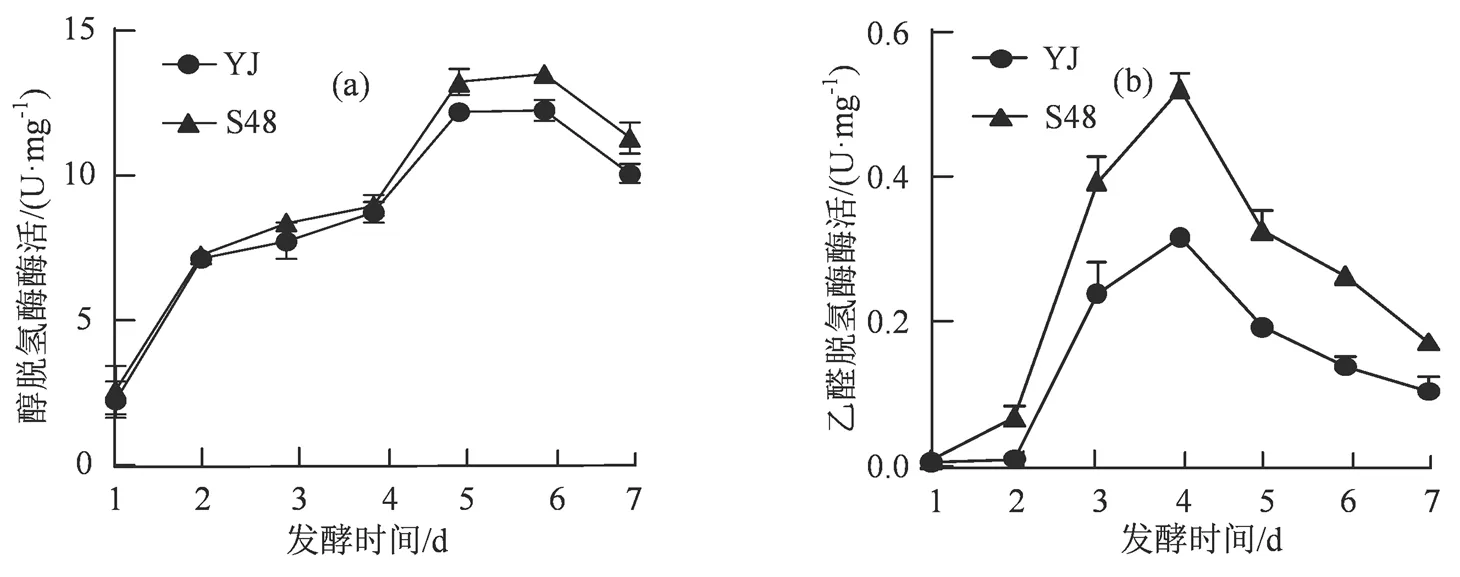
图5 发酵过程中醇脱氢酶(a)以及乙醛脱氢酶酶活情况(b)
Figure 5 Enzyme activities of alcohol dehydrogenase (a) and acetaldehyde dehydrogenase (b) during fermentation

图6 遗传稳定性实验产乙醛情况
Figure 6 Acetaldehyde production in genetic stability experiments
3 讨论与结论
如何降低发酵液中的乙醛含量一直是困扰啤酒行业的重要问题,而啤酒酵母对乙醛代谢起着至关重要的作用[24]。随着基因工程技术的发展及啤酒酵母基因组的不断阐明,目前已经有大量的研究采用各类分子手段、逆向代谢工程等方法揭示了啤酒酵母低产乙醛的机理,但在啤酒行业的实际应用方面还存在许多问题[25]。本文采用ARTP的方法,以双硫仑作为筛选抑制剂,对一株工业化大生产菌株进行诱变处理后,通过多次摇瓶发酵筛选得到的诱变菌株S48,在提高酵母细胞内乙醛脱氢酶的活性,降低发酵液乙醛含量的同时改善了其他风味物质的代谢及啤酒的风味稳定性,经过一定时间的乙醛驯化后,其优势性状基本达到稳定遗传状态,在啤酒的工业化生产上有着广阔的应用前景。
[1] XU X, NIU C T, LIU C F, et al. Unraveling the mechanisms for low-level acetaldehyde production during alcoholic fermentation inlager yeast[J]. J Agric Food Chem, 2019, 67(7): 2020-2027.
[2] 郝瑞颖, 赵洁, 刘延琳. 葡萄酒酿造过程中酿酒酵母乙醛代谢特征的研究[J]. 食品科学, 2013, 34(7): 175-179.
[3] SHEN N, WANG J J, LIU C F, et al. Domesticating brewing yeast for decreasing acetaldehyde production and improving beer flavor stability[J]. Eur Food Res Technol, 2014, 238(3): 347-355.
[4] KOSUGI S, KIYOSHI K, OBA T, et al. Isolation of a high malic and low acetic acid-producing sake yeaststrain screened from respiratory inhibitor 2, 4-dinitrophenol (DNP)-resistant strains[J]. J Biosci Bioeng, 2014, 117(1): 39-44.
[5] 张媛媛. 低产乙醛啤酒酵母的选育与研究[D].无锡: 江南大学, 2011.
[6] WANG J, SHEN N, YIN H, et al. Development of industrial brewing yeast with low acetaldehyde production and improved flavor stability[J]. Appl Biochem Biotechnol, 2013, 169(3): 1016-1025.
[7] 金玮鋆, 李红, 王君伟. 乙醛法筛选抗乙醛啤酒酵母菌株的应用研究[J]. 酿酒科技, 2016(1): 10-14.
[8] 崔云前, 王君伟, 李红, 等. 啤酒酵母乙醛代谢关键酶相关性研究[J]. 中国酿造, 2016, 35(1): 29-33.
[9] 刘春凤. 啤酒酿造酵母M14低产乙醛的研究[D]. 无锡: 江南大学, 2019.
[10] 沈楠. 低产乙醛啤酒酵母的选育[D].无锡: 江南大学, 2013.
[11] ZHANG X, ZHANG X F, LI H P, et al. Atmospheric and room temperature plasma (ARTP) as a new powerful mutagenesis tool[J]. Appl Microbiol Biotechnol, 2014, 98(12): 5387-5396.
[12] 蒋汶, 张庆庆, 汤文晶, 等. 紫外-等离子体复合诱变红曲霉产胞外多糖[J]. 食品与发酵工业, 2016, 42(1): 64-69.
[13] 沈楠, 王金晶, 刘春凤, 等. 低产乙醛啤酒酵母的定向驯化筛选[J]. 食品与发酵工业, 2013, 39(7): 94-97.
[14] 张媛媛, 魏良鑫, 佟婷婷, 等. 顶空进样气相色谱法检测啤酒中乙醛[J]. 分析试验室, 2011, 30(9): 26-29.
[15] 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. 啤酒分析方法: GB/T 4928—2008[S]. 北京: 中国标准出版社, 2009.
[16] KRZYSZTOF K, TADEUSZ T. The effect of wort filling time on fermentation, maturation and acetaldehyde content in beer[J]. Czech J Food Sci, 2016, 34(3): 265-270.
[17] ATANASOVA V, FULCRAND H, CHEYNIER V, et al. Effect of oxygenation on polyphenol changes occurring in the course of wine-making[J]. Anal Chimica Acta, 2002, 458(1): 15-27.
[18] 李生华. 谈谈双乙酰的控制[J]. 啤酒科技, 1999(2): 28.
[19] 朱莉娜. 微波诱变适宜醇酯比啤酒酵母菌株的选育[D].青岛: 青岛大学, 2012.
[20] XU X, SONG Y, GUO L, et al. Higher NADH availability of lager yeast increases the flavor stability of beer[J]. J Agric Food Chem, 2020, 68(2): 584-590.
[21] 宁准梅, 高冠明, 李爽. 三种酒曲酿造的崇明老白酒的挥发性风味物质分析及比较[J]. 工业微生物, 2016, 46(1): 8-15.
[22] 丁满生, 李绩, 肖冬光. 啤酒酵母泥回收利用研究动态[J]. 酿酒科技, 2001(4): 73-75.
[23] 曾蓉. 酵母泥回收的控制要点[J]. 啤酒科技, 2010(3): 49.
[24] 刘春华, 张国英. 如何降低啤酒中乙醛含量[J]. 酿酒, 2014, 41(3): 102-103.
[25] 刘春凤, 赵云, 李崎, 等. 低乙醛Lager型啤酒酵母研究进展[J]. 菌物学报, 2018, 37(11): 1411-1423.
Screening of low-acetaldehyde beer yeast with flavor advantages
GUAN Yu1, 2, LIU Chunfeng1, 2, LI Qi1, 2, HE Xiuli3, XIE Xin3, GUO Liyun3, WANG Jinjing1, 2
(1. Key Laboratory of Industrial Biotechnology, Ministry of Education, School of Biotechnology, Jiangnan University, Wuxi 214122; 2. Lab of Brewing Science and Technology, School of Biotechnology, Jiangnan University, Wuxi 214122; 3. Key Laboratory of Brewing Technology in Beijing, Technology Center, Beijing Yanjing Beer Co., Ltd., Beijing 101300)
Acetaldehyde is mainly produced by yeast during beer fermentation, and its modification greatly affects beer flavor and quality. There are a lot of researches about the relationship between low-level acetaldehyde beer and yeast, however, due to the food safety, none of them have been applied to industrial beer production yet. In this study, we mutated the parent strainYJ provided by beer company via ARTP (Atmospheric and room temperature plasma) and used a resistant plate combining disulfiram and ethanol to do the first round screening. Later, we selected the mutant strain S48 by several times of different flask fermentation. Compare with the parent strain, mutant strain (S48) lowered the amount of acetaldehyde by 23.69%, while alcohol was stronger, amaroid, total acid and diacetyl were lower in the factory fermentation tests. The flavor of fermentation liquor was better, and the alcohol with ester was more regulated.
yeast; acetaldehyde; ARTP; disulfiram; beer
TQ926.1; TS261.11
A
1672-352X (2021)03-0511-07
10.13610/j.cnki.1672-352x.20210706.005
2021-7-7 10:45:03
[URL] https://kns.cnki.net/kcms/detail/34.1162.S.20210706.1641.010.html
2020-09-15
国家自然科学基金项目(31601558,315571942)资助。
官 钰,硕士研究生。E-mail:1020616115@vip.jiangnan.edu.cn
王金晶,副教授。E-mail:jjwang@jiangnan.edu.cn

