体外受精-胚胎移植通过影响DNMT3B表达水平影响小鼠妊娠中晚期胎盘生长动力学轨迹*
相 萌,陈书强
(1.西安医学院临床医学院妇产科教研室,西安 710021;2.空军军医大学第二附属医院妇产科生殖中心,西安 710038)
体外受精-胚胎移植(in vitro fertilization embryo transfer,IVF-ET)作为一项重要的辅助生殖技术(assisted reproductive technology,ART),在解决了诸多不孕夫妇难题的同时也带来了子代远期代谢性疾病发病增高的风险[1]。有研究显示,IVF胚胎操作本身增加的不良负荷和影响会导致胎盘胎儿生长曲线偏离[2-3],而胎盘生长动力学与成人代谢生理学密切相关[3-4]。因此,了解IVF影响胎盘生长动力轨迹的机制并对胎盘功能进行严格评估具有重要的临床意义。课题组前期发现,ART致小鼠妊娠末期胎盘重量显著增加[5]。在影响和调节胎盘生长和发育的印迹基因中,H19是最早被鉴定的调控胎盘生长和胚胎早期生长发育的父源印迹基因,前期研究证实H19是参与引起IVF-ET胎盘过度生长的目标靶基因之一[6-7]。
H19基因编码一个2.3kb的非编码RNA分子microRNA-675,可与IGF1r发生特异性结合[8],通过抑制IGF1r介导的下游PI3K/Akt/mTOR信号通路,影响细胞分化和增殖。H19表达水平主要受上游4kb处DMR差异甲基化区域即ICR区的甲基化水平的调控[9]。大量报道表明,H19/IGF2隶属于一个基因印记簇,皆受H19ICR的调控。H19基因下游存在H19/IGF2共用的转录增强子,两者存在表达竞争关系,当H19表达下调时,IGF2表达上调[10-11],IGF2、IGF1r可共同参与介导mTOR信号通路,影响细胞分化和增殖[12]。
基于以上研究结果,本研究提出“IVF-ET致妊娠中晚期胎盘H19ICR甲基化水平波动是引起胎盘生长动力学改变的重要表观遗传因素”的假设(图1)。本研究通过构建ICR小鼠IVF-ET模型作为试验组,将体内受精的ICR小鼠设为对照组,通过对两组孕中晚期ICR小鼠胎盘质量、胎盘效率进行对比,从mRNA和蛋白水平分析生长因子受体以及甲基化酶类在妊娠中晚期各阶段的表达水平,发现IVF-ET主要通过影响妊娠末期胎盘甲基化酶类DNMT3B的表达水平使H19ICR区过甲基化水平波动,进一步影响胎盘生长动力学。
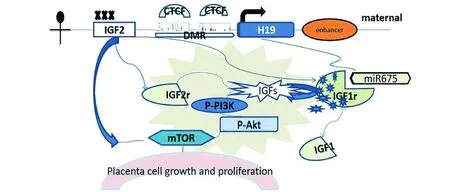
图1 甲基化蛋白酶与H19ICR(DMR区)结合调控H19/IGF2表达水平影响胎盘生长动力的相关机制
1 材料与方法
1.1 实验材料
1.1.1 实验动物 小鼠品系为ICR清洁级小鼠,购自北京维通利华实验动物技术有限公司。雌鼠4~6周龄,雄鼠3~6月龄。小鼠在21~23℃恒定的12h光照/12h黑暗循环下保证充分的食物和自来水。本研究通过空军军医大学唐都医院动物和医学伦理委员会(许可证号码:TDLL‐2016163),并按空军军医大学唐都医院活体动物教学和研究委员会指南进行。
1.1.2 主要试剂及仪器 孕马血清促性腺释放激素(PMSG),人绒毛膜促性腺激素(HCG)(美国Millipore)一步法反转录试剂盒(德国Abcam),茎环法反转录试剂盒,引物(中国上海生工),NanoDrop2000(美国Thermo),低温离心机(日本HITACHI),荧光定量PCR仪与蛋白凝胶成像系统(美国Bio-Rad),CO2培养箱(美国Thermo),染色质免疫沉淀试剂盒(美国Millipore),Bioruptor超声波仪(比利时Diagenode)。
1.2 实验方法 将雌性小鼠分为IVF-ET组和自然妊娠组(Negative Control Group,NC组):IVF-ET组经超促排卵、体外受精和体外培养;自然妊娠组自然交配受孕。
1.2.1 IVF-ET小鼠模型建立
1.2.1.1 超促排卵、MII期卵子的获取 4~6周龄雌性小鼠腹腔注射7.5IU(0.15mL)PMSG,46~48h后腹腔注射7.5IU(0.15mL)HCG。注射HCG后14~16h,断颈法处死小鼠,剪取输卵管,放置在200μL的HTF液滴,用尖头镊子撕破壶腹部,使颗粒细胞包围的卵子团释放出来,用100μL移液器将卵子团转移到干净的200μL HTF培养液滴中备用。
1.2.1.2 IVF-ET与标本收集 参考既往研究[13],分别在妊娠12.5、14.5、16.5天与18.5天(D18.5)时将孕鼠脱颈处死,剪取子宫,PBS缓冲液浸泡。用解剖镊将胎鼠和胎盘剥离出子宫,小心分离,尽量小心剥离干净羊膜组织,用预冷PBS缓冲液洗干净。将胎盘和胎儿放置干净的纱布表面称重。冻存管单个收集胎鼠及胎盘组织,投入液氮备用。
1.2.2 胎盘质量与胎盘效率曲线 比较IVF组与NC组小鼠在妊娠12.5、14.5、16.5天与18.5天的胎盘质量与胎盘效率,绘制IVF小鼠与NC组小鼠妊娠中晚期胎盘质量与胎盘效率曲线。比较各组小鼠在妊娠12.5、14.5、16.5天与18.5天的胎盘质量和胎儿质量,胎盘效率=胎儿质量/胎盘质量,Control组为自然妊娠组数据统一做标准化处理,值等于1(图2)。
1.2.3 Q-RT-PCR检测两组胎盘在妊娠12.5、14.5、16.5天与18.5天H19及其衍生的miR-675表达水平、IGFs及其受体表达水平 分别取3只孕鼠在妊娠12.5、14.5、16.5天与18.5天的胎盘组织,Q-RT-PCR技术检测小鼠胎盘目的基因H19及其衍生的miR-675、IGFs及其受体的mRNA表达水平,按试剂盒说明进行总RNA提取,cDNA合成,并根据TaKaRa实时定量PCR试剂盒说明书配制反应体系,引物设计见表1,反应总体系为20μL,每个待测样本目的基因设定3个复孔。扩增条件:95℃ 3min;95℃ 15s,58℃退火,72℃ 30s延伸,共50个循环;72℃ 2min延伸,65~95℃(每15s升高0.5℃)设置温度梯度。PCR反应完成后,利用PCR熔解曲线对产物进行定性分析。根据PCR扩增曲线,得到样本的Cq值(循环周期数),采用2-△△Cq法计算目的基因mRNA相对表达水平。
1.2.4 Western blot法检测两组胎盘在妊娠中晚期甲基化酶类蛋白水平 各组样本经分别匀浆离心,取上清,按蛋白提取试剂盒及BCA试剂盒说明书提取并测定蛋白浓度。取50μg蛋白进行电泳及转膜反应,5%脱脂奶粉溶液37℃封闭2h,加抗体DNMT1、DNMT3A、DNMT3B、GAPDH(除内参抗体稀释倍数为1∶2000外,其余抗体稀释倍数均为1∶1000),4℃孵育过夜,TBST漂洗3次,加1∶1000的羊抗兔或羊抗鼠二抗溶液,于摇床上室温孵育2h,经TBST再次漂洗3次,采用增强化学发光法显色并拍照,并以Image-J软件分析各组蛋白相对表达。

表1 目的基因及内参q-RT-PCR引物序列

表2 H19ICR区Chip-q-PCR引物序列
1.2.5 Chip-q-PCR检测两组胎盘在妊娠12.5及18.5天DNMT3B与H19ICR区的结合丰度 将样本于液氮中迅速而充分的研磨后,置于100mg 1%甲醛室温固定15min。用125mm甘氨酸淬灭反应。用Bioruptor超声波仪在4℃下将染色质裂解成200~500bp的片段。加入抗体之前,先将反应的25μL在一边用作input,4℃保存,250μL份用作实验。以IgG作为阴性对照,IP组使用5μL的抗DNMT3B抗体,4℃旋转混合孵育过夜,通过添加与蛋白结合的动态磁珠来纯化染色质。用磁铁将珠子拉下来,反复洗涤,再次悬浮在洗脱缓冲液中,交联后于65℃孵育5h后反转录,用Qiaquick柱(Qiagen,Hilden,Germany)纯化DNA。实时荧光定量PCR如1.2.3所述。引物序列及结合位点见表2。为了确定IP百分比,首先将样品归一化,利用2-ΔΔCt法计算IP百分比。公式Fold enrichment=%(Chip/Input)/%(IgG/Input)计算目的片段与DNMT3B的结合丰度。
1.3 统计学处理 采用Prism 6对实验数据进行分析,采用两独立样本t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 IVF组与NC组小鼠在妊娠12.5、14.5、16.5天与18.5天的胎盘质量与胎盘效率 IVF组小鼠胎盘质量在妊娠12.5天显著低于NC组,胎盘效率显著低于NC组,而在妊娠16.5及18.5天胎盘质量显著高于NC组,胎盘效率显著低于NC组,差异有统计学意义(P<0.05)(图2)。

图2 两组小鼠在妊娠中晚期的胎盘质量与胎盘效率A:胎盘质量曲线;B:胎盘效率曲线;*P<0.05 vs NC组
2.2 Q-RT-PCR检测两组胎盘在妊娠12.5、14.5、16.5天与18.5天H19及其衍生的miR-675表达水平 IVF组小鼠胎盘H19及其衍生的miR-675在妊娠12.5天显著高于NC组,而在妊娠16.5天及18.5天显著低于NC组,且表达水平与妊娠时间呈负相关,差异有统计学意义(P<0.05)(图3)。
2.3 Q-RT-PCR检测两组胎盘在妊娠12.5、14.5、16.5天与18.5天IGFs及其受体与甲基化酶类表达水平 IVF组小鼠胎盘IGFs及其受体mRNA表达量在妊娠12.5天显著低于NC组,胎盘甲基化酶类mRNA表达量在妊娠12.5天显著低于NC组,而在妊娠16.5天及18.5天均显著高于NC组,且表达水平与妊娠时间呈正相关,差异有统计学意义(图4)(P<0.05)。

图3 两组小鼠在妊娠中晚期的胎盘H19及其衍生的miR-675表达水平A:H19表达水平;B:miR-675表达水平;*P<0.05,**P<0.01,***P<0.001 vs NC组;

图4 两组胎盘在妊娠中晚期生长因子及其受体与甲基化酶类mRNA表达水平A:胎盘生长因子及其受体表达水平;B:胎盘甲基化酶类mRNA表达水平;*P<0.05,**P<0.01,***P<0.001 vs NC组;1、2、3、4分别为小鼠妊娠时间12.5、14.5、16.5、18.5d
2.4 Western blot法检测两组胎盘在妊娠中晚期甲基化酶类蛋白水平 甲基化酶DNMT3B蛋白表达量在IVF组小鼠胎盘妊娠12.5天显著低于NC组,而在妊娠18.5天显著高于NC组,且表达水平与妊娠时间呈正相关,差异有统计学意义(P<0.001)(图5)。

图5 两组胎盘在妊娠中晚期甲基化酶类蛋白表达水平A:胎盘甲基化酶表达水平;B:甲基化酶类蛋白表达水平;*P<0.05,**P<0.01,***P<0.001 vs NC组
2.5 Chip-q-PCR检测两组胎盘在妊娠12.5天及18.5天DNMT3B与H19ICR区的结合丰度 2.1至2.4结果提示IVF可能通过影响妊娠中晚期DNMT3B的表达水平,从而下调妊娠末期H19及其衍生的miR-657激活了IGFs及其下游信号通路,致小鼠妊娠末期胎盘生长动力轨迹曲线偏离。而DNMT3B的作用除与表达量相关亦与H19ICR区的结合丰度相关。进一步检测了妊娠12.5天及18.5天DNMT3B与H19ICR区的结合丰度。结果显示,IVF组小鼠在妊娠12.5天胎盘甲基化酶DNMT3B及其与H19ICR区的结合丰度显著低于NC组,而在妊娠18.5天胎盘甲基化酶DNMT3B及其与H19ICR区的结合丰度显著高于NC组,差异有统计学意义(P<0.05)(图6)。

图6 两组小鼠在妊娠12.5及18.5天DNMT3B与H19ICR区的结合丰度A:胎盘DNMT3B在妊娠12.5天与H19ICR区的结合丰度;B:胎盘DNMT3B在妊娠18.5天与H19ICR区的结合丰度;*P<0.05,**P<0.01 vs NC组
3 讨 论
目前全世界使用ART怀孕的儿童人数已达800万余例,并在继续增加。虽然绝大多数ART儿童是健康的,但许多研究表明,代谢并发症的风险即将到来,并进一步被“发育起源的健康和疾病假说”证实[4,14-16]。越来越多的证据表明,胎儿和胎盘的生长动力学是预测产后子代健康的重要特征,胎盘的生长发育决定胎儿的发育。因此,深入探讨并进一步研究ART引起的胎盘生长动力学轨迹改变的机制具有重要意义。本研究通过构建IVF小鼠模型,建立科学假说,从胎盘印记基因簇H19/IGF2的表达调节为切入点,在分子信号通路水平更多地揭示IVF致胎盘生长动力轨迹改变的机制,证实了IVF通过妊娠末期下调H19及其衍生的miR-657激活了IGFs及其下游信号通路,致小鼠妊娠末期胎盘生长动力轨迹曲线偏离;且小鼠妊娠中晚期胎盘动力学生长轨迹的改变主要通过IVF调控及影响DNMT3B的表达水平及其与H19ICR区的结合水平引起。该研究为促进和改善IVF的体外操作提供了理论支持和预警靶点,为降低子代远期代谢疾病的发病风险提供了理论依据。
本研究显示,甲基化酶DNMT1及DNMT3A、DNMT3B在胎盘生长的过程中都伴有随时间增加的剂量效应关系,然而,DNMT3B变化在随时间改变的剂量效应上最具有显著性,且相对于自然妊娠小鼠胎盘,IVF妊娠组小鼠胎盘DNMT3B表达显著增高。Dnmt1与Dnmt3(Dnmt3a,Dnmt3b)的作用机制有显著差别,Dnmt1在胚胎的发育过程中主要负责早期胚胎的甲基化维持[17],而Dnmt3除了参与胚胎早期发育的甲基化维持以外,具有在以未甲基化的双链DNA为母链模板链形成全新甲基化位点的作用,即重新甲基化的功能[18-19]。IVF妊娠组小鼠胎盘DNMT3B的表达相对于自然妊娠组小鼠胎盘显著增高,且其与H19ICR区的结合水平显著增高,表明IVF操作通过对DNMT3B的表达调节使H19ICR区的过甲基化,影响了胎盘印记基因表达[20-21]。印记基因对胎盘生长及功能具有重要的作用,印记基因簇H19/IGF2表观调节异常引起下游IGFs信号通路激活致小鼠妊娠末期胎盘过度生长是IVF操作对胎盘表观遗传干扰的一种代偿性补偿现象[20,22],而引起这种代偿性变化的潜在基因及其表观遗传改变可能是子代远期疾病发病的预警靶点[10,23-25]。
本研究仍具有一定局限性,印记基因H19的表观调节异常引起的ICR区过甲基化过程中有无其他相关组蛋白,转录因子的参与及作用机制仍需进一步探索,DNMT3B表达与胎盘生长动力学轨迹的关系中是否存在有miRNA参与的DNA甲基化酶活性调节[9,26],本研究中并未涉及,仍需在今后研究中做更进一步的探索。

