牛源大肠埃希氏菌肌尾噬菌体的鉴定与特性研究
邱子怡,孙 亮,赵 静,马红霞,,高云航,,么乃全,*,徐凤宇,,3*
(1.吉林农业大学动物医学院,吉林长春 130118;2.吉林农业大学动物科学技术学院,吉林长春 130118;3.动物生产及产品质量安全教育部重点实验室,吉林长春 130118;4.吕梁市动物疫病预防控制中心,山西吕梁 033000)
大肠埃希氏菌(E.coli)是人和动物正常菌群成员,少数为病原菌,常致人或动物腹泻、奶牛子宫内膜炎等疾病[1]。抗生素在治疗及预防细菌性疾病、挽救人和动物生命及促进动物生长中起到了重要作用。但随着抗生素大量及不合理应用,菌群失调、多重耐药现象等越来越引起重视[2],限制了抗生素在细菌性疾病治疗中的应用[3],新抗生素研发速度尚跟不上细菌快速耐药性变异。中药、微生态制剂、抗菌肽、噬菌体及其裂解酶等被认为是治疗抗性菌所致疾病的潜在替代或补充品。其中噬菌体作为高特异性、环境友好型细菌的天敌越来越被关注,如Kaabi S A G等[4]研究表明,在病原菌(大肠埃希氏菌、肺炎克雷伯菌、流感嗜血杆菌、铜绿假单胞菌、费氏柠檬酸杆菌、卡他莫拉菌)感染小鼠模型45 min、5 h、8 h、14 h后,2倍感染复数(multiplicity of infection,MOI)或1 MOI噬菌体可起到很好治疗作用,10株噬菌体组成的鸡尾酒可100%拯救最小致死量感染的实验小鼠;Dissanayake U等[5]用噬菌体F.O.P与氨苄青霉素分别治疗大肠埃希氏菌O157:H7(Ec231株)感染的试验小鼠,结果在减少小鼠粪便中病原菌数量方面二者效果相近,F.O.P治疗组小鼠的肠道菌群与对照组相似。另外,因与致病病毒存在很多相似性,大肠埃希氏菌噬菌体作为粪便指示菌(fecal indicator bacteria,FIB)替代品被用于评估娱乐用水的卫生质量[6];用外切葡萄糖酶标记的碱性磷酸酶作为报告的T7噬菌体结合磁性微球技术、比色分析可用于检测食品或水中大肠埃希氏菌[7]。本研究以牛源子宫内膜炎型大肠埃希氏菌为宿主,分离毒性噬菌体,并研究其主要生物学特性,希望为使大肠埃希氏菌噬菌体能在治疗大肠埃希氏菌所致疾病等方面发挥更好的作用提供材料。
1 材料与方法
1.1 材料
1.1.1 菌株 牛源子宫内膜炎型大肠埃希氏菌CE株由吉林省反刍动物繁育生物技术与健康养殖工程实验室馈赠;指示菌为本实验室分离保存的C-1株、C-2株、C-3株、C-4株、C-5株、C-6株、C-7株、C-8株、C-9株、C-10株大肠埃希氏菌。
1.1.2 主要试剂 RNaseA、DNaseI,北京鼎国生物技术有限责任公司产品;限制性核酸内切酶BamHⅠ、NcoⅠ、BlnⅠ、DraⅠ、Xhol Ⅰ,宝生物工程(大连)有限公司产品;LB培养液、LB上层培养基、含15 g/L琼脂的下层LB培养基、2×LB培养液、SM液依标准方法配制。
1.1.3 主要仪器 96孔细胞培养板,长春华益生物科技有限责任公司产品;超速离心机(Himac CP100MX),日本日立公司产品;透射电子显微镜(TEM-100CX),日本TEOL LTD公司产品。
1.2 方法
1.2.1 噬菌体分离纯化 参照文献[8]中方法,将新采集的污水样品室温静置2 h,取上清为分离材料,以CE株大肠埃希氏菌为宿主,分离、增殖、验证、纯化噬菌体。
1.2.2 噬菌体电镜观察 取5.0×103PFU/mL噬菌体液0.2 mL,与宿主菌0.2 mL、氯化钙(终浓度为1 mmol/L)按文献[9]中方法铺双层平板,待培养出噬菌斑网络后,加入2.5 mL SM液,4 ℃振荡12 h,取SM液与菌、噬菌体混合物,12 000 r/min离心30 min,取上清30 μL滴于铜网表面,静置30 s,加磷钨酸(20 mg/mL,pH7.0)负染90 s,透射电镜观察。
1.2.3 噬菌体核酸类型鉴定与酶切分析 参照文献[10]大规模培养噬菌体,提取基因组,分别用5种限制性内切酶将噬菌体基因组酶切10 h,10 g/L琼脂糖凝胶电泳检测。
1.2.4 噬菌体效价及裂解谱测定 将宿主菌液100 μL、氯化钙和100 μL适当稀释的噬菌体液混匀,加入47 ℃保温的上层培养基快速混匀铺双层平板,每个稀释度做3个重复,37 ℃培养12 h,计噬菌斑数量。
点滴法测噬菌体裂解谱:将10株受试菌分别均匀涂布于固体培养基表面,静置5 min,滴加5 μL纯化噬菌体液,37 ℃培养,观察裂解情况。
1.2.5 噬菌体的热及酸碱稳定性测定 在40 ℃~75 ℃范围内,间隔5 ℃设置8个水浴温度,用漂板将装有1 mL噬菌体的1.5 mL EP管放入各水浴中,分别放置20、40、60 min后测效价。
在1.5 mL灭菌EP管中分别放入900 μL pH 3~13的液体培养基,在37 ℃水浴锅中预热30 min后,分别混入100 μL噬菌体,37 ℃孵育3 h后测定效价。
1.2.6 最佳MOI、一步生长曲线的测定 参照文献[8]中方法测定EP-CE的最佳MOI、一步生长曲线。
1.2.7 体外抗菌活性检测 根据最佳MOI稀释EP-CE液和宿主菌液,取96孔细胞培养板,在A1空白孔中加入宿主菌液和EP-CE液各100 μL混匀,37 ℃培养,每隔1 h从左向右依次加入EP-CE液和宿主菌液各100 μL,混匀后继续培养;100 μL宿主菌液与100 μL灭菌SM液混匀作对照。12 h后用酶标仪测每孔OD 600 nm值。
2 结果
2.1 噬菌体分离纯化
将污水与CE株大肠埃希氏菌混合培养,6次富集后,经点滴法验证得大肠埃希氏菌毒性噬菌体;经7次挑单斑铺双层平板纯化,得单一均匀、边缘整齐、清晰透亮、直径约1.5 mm的噬菌斑(图1),命名为EP-CE。

图1 噬菌体EP-CE纯化后的噬菌斑
2.2 噬菌体效价及裂解谱测定结果
经双层平板法测得纯化后的EP-CE效价为1.06×109PFU/mL;用点滴法测得EP-CE除裂解宿主菌外,还可裂解C-6株指示菌。
2.3 噬菌体的电镜观察结果
透射电镜观察见EP-CE呈蝌蚪状,有一条可收缩的尾,可见尾丝、尾板(图2),头部长约70.9 nm±0.35 nm,宽约68.4 nm±0.48 nm,尾部长约90.1 nm±5.39 nm。

图2 噬菌体EP-CE电镜图
2.4 噬菌体核酸类型鉴定与酶切分析
用限制性内切酶BlnⅠ、BamHⅠ、NcoⅠ、XhoⅠ、DraⅠ对EP-CE的基因组进行酶切,经电泳分析发现,EP-CE有DraⅠ酶切位点,酶切后见6条带(图3),与Marker比较后知EP-CE基因组大于50 kb。
2.5 噬菌体的热及酸碱稳定性
温度对EP-CE的影响结果如图4,在40 ℃~55 ℃,作用时间对EP-CE的影响不大;温度高于55 ℃后,EP-CE效价随作用时间延长而降低;70 ℃作用60 min或温度高于75 ℃时噬菌体被灭活。

图4 温度对噬菌体EP-CE的影响
pH对EP-CE的影响结果如图5,在pH 7~10时, EP-CE的效价差异不显著;在pH 5~7时,随pH升高EP-CE效价也在增加;在pH 10~12时, EP-CE的效价随着pH升高而降低;pH≤4或≥13时,EP-CE被灭活。

图5 噬菌体EP-CE的酸碱稳定性

M.DNA标准DL 15 000;1.BamHⅠ酶切;2.BlnⅠ酶切;3.NcoⅠ酶切;4.DraⅠ酶切;5.XhoⅠ酶切
2.6 噬菌体的最佳MOI
当感染复数为0.01时噬菌体EP-CE效价为2.1×1010PFU/mL,在7个感染复数中最高,为最佳MOI(表1)。

表1 噬菌体EP-CE最佳感染复数测定结果
2.7 噬菌体的一步生长曲线
由图6可见EP-CE的复制规律。其感染大肠埃希氏菌CE株的潜伏期约30 min,30 min~120 min时EP-CE效价升高很快,为爆发期;120 min后EP-CE进入稳定期。计算其爆发量为26 PFU/cell。
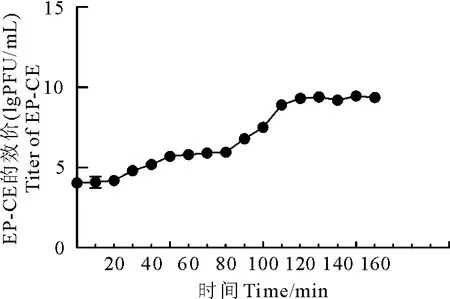
图6 噬菌体EP-EC的一步生长曲线
2.8 噬菌体的体外抗菌活性
噬菌体EP-CE体外抗菌活性结果如图7。在EP-CE与宿主菌共培养初始5 h内,OD值保持稳定;在5 h后,OD值随时间延长而升高,12 h时较对照组OD值低约0.5。
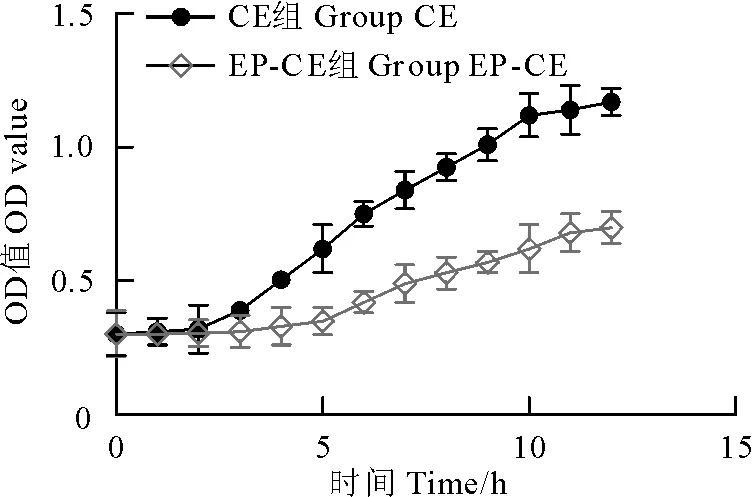
图7 噬菌体EP-CE体外抗菌活性
3 讨论
噬菌体在自然界中分布广泛而丰富,池塘、湖泊、污水、人或动物粪便中均可分离到。Gibson S B等[11]报道,大肠埃希氏菌噬菌体ΦHP3、ΦEC1、ΦCF2分别分离自鹅与鸭粪便混合物、犬粪、鸡粪,ΦES12、ΦES17、ΦES19、ΦES21、ΦES26分离自未处理的污水。Bumunang E W等[12]以非O157产志贺毒素大肠埃希氏菌(STEC)为宿主,从牛粪中分离到10株噬菌体,即SA20RB、 SA79RD、SA126VB、SA30RD、SA32RD、SA35RD、SA21RB、SA80RD、SA12KD和SA91KD。Pacífico C等[13]从奥地利一个三级护理医院的111份临床样品中分离到16株大肠埃希氏菌DSM 12242株的噬菌体,其中血液、尿液、气管吸出物分离率分别为23.8%、20.5%、6.1%,腹部、肺部、胸膜、肩膀和膝盖液、鼻腔拭子、静脉导管样品中未分离到大肠埃希氏菌噬菌体。本实验室曾从奶牛唾液和鼻黏液中分离到耻垢分支杆菌噬菌体,分离率11.8%[14]。说明噬菌体的分离率与样本来源关系密切。本试验前期试图从牛子宫及阴道分泌物中分离大肠埃希氏菌噬菌体,但多次试验未得到阳性结果,可能与子宫、阴道具有物理排除能力及局部黏膜免疫功能使其中细菌种类和数量随分娩周期演变有关[15]。
生物学特性是噬菌体应用的基础,Gibson S B等[11]研究表明该团队分离的8株大肠埃希氏菌噬菌体潜伏期为22 min~40 min,爆发量为9.6 PFU/cell~80.7 PFU/cell,基因组大小为53 242 bp~170 254 bp,含74个~275个ORF,除ΦES17为短尾外,其余均属肌尾病毒科,对89株大肠埃希氏菌分离株的裂解率为7%~58%。Bumunang E W等[12]分离的10株非O157 STEC噬菌体中肌尾噬菌体和长尾噬菌体各半,基因组大小为44 kb~184.3 kb,对血清型O76:H34、O99:H9、O129:H23、O136:H30的STEC均不敏感。Pacífico C等[13]分离的16株大肠埃希氏菌噬菌体中除1株肌尾噬菌体vB-EcoM-12474V外,其余均为长尾噬菌体,基因组大小为33.7 kb~114.6 kb,vB-EcoM-12474V头部长、宽约62 nm,可收缩的尾长约155 nm。马粪便来源的大肠埃希氏菌4s株噬菌体Paul[16]、Snoke[17]、Shashou[18]的基因组大小分别为79 429 bp、44.4 kb、44 155 bp。分离自废水的感染大肠埃希氏菌O165:H8的毒性噬菌体ST20 基因组为44 517 bp,属于长尾噬菌体科[19]。Kaczorowska J等[20]检测了从泉水、废水、肌肉等样品中分离到的19株大肠埃希氏菌噬菌体裂解谱,发现对受试的74株(72株ECOR收藏株及宋内志贺氏菌53G、O157:H7 Δstx株)菌的裂解率为14%~54%不等,观察其中的10株噬菌体,除JK16为长尾噬菌体外,其余均属肌尾噬菌体,10株噬菌体的基因组大小为51 854 bp~168 893 bp,最小的为长尾噬菌体JK16。可见目前已分离的大肠埃希氏菌噬菌体中肌尾和长尾噬菌体占优势。本研究分离的EP-CE为基因组大于50 kb的肌尾噬菌体,在40 ℃~55 ℃、pH 7~10环境中效价稳定,最佳MOI为0.01,潜伏期约30 min,爆发期约90 min,爆发量为26 PFU/cell,对11株受试菌的裂解率为18%,说明其特异性较强,体外裂解试验表明在与宿主菌共培养初始5 h内杀菌活性较好。
虽然本研究为大肠埃希氏菌噬菌体在治疗大肠埃希氏菌所致奶牛子宫内膜炎等方面的应用提供了资料,但引起子宫内膜炎的病原菌较多,其中大肠埃希氏菌分离率约16.95%[15],尚需将EP-CE与链球菌、金黄色葡萄球菌、棒状杆菌等的噬菌体,或每种病原菌的裂解谱不同的多株噬菌体联合应用,方能起到更好的治疗效果。

