无血清悬浮MDCK细胞培养流感病毒纯化工艺的初步建立
刘丽,郭骐源,郝建丽,郭丹丹,张雪梅,吴业红
长春生物制品研究所有限责任公司,吉林 长春130012
每年全球因季节性流感病毒感染会导致300万~500万严重的感染病例,死亡病例高达29万~65万例[1-2]。接种流感疫苗是预防流感最有效的措施[3]。传统鸡胚生产的流感疫苗,生产过程繁琐,培养的流感病毒抗原易突变,特别是当禽流感病毒引起流感大流行时,鸡胚的供应受到限制难以满足疫苗大量、快速生产的需求,应用细胞培养技术可克服上述困难。鸡胚生产流感疫苗的的下游工艺通常包括澄清、超滤和蔗糖区带离心[4],此工艺对细胞培养中的关键杂质宿主细胞残留蛋白和宿主细胞残留DNA去除效果不理想。因此亟待开发出满足严格监管要求的细胞基质流感疫苗下游纯化工艺,以确保细胞培养生产流感疫苗的安全性和有效性[5]。层析分离通常被认为是大规模生产中最通用,最有效的一种方法。不断发展用于层析的材料能满足从实验室到商业规模的高容量和高扩展性的要求[6],因此层析技术被广泛用于病毒的纯化[7]。由于传代细胞系的潜在致瘤风险,宿主细胞残留DNA通常选择核酸酶消化、离子交换层析等方法来进行有效去除[8]。新型复合填料Capto Core700具有未官能化的惰性外壳和位于核心的辛胺配基,使其具有分子排阻和离子吸附的双重功能[9],非常适合宿主细胞蛋白与核酸酶的去除[10]。
本研究通过优化核酸酶处理条件、复合介质Capto Core700与强阴离子介质Capto Q的纯化条件,建立适于无血清悬浮MDCK细胞培养流感病毒的下游纯化工艺,为后续MDCK细胞流感疫苗的生产奠定基础。
1 材料与方法
1.1 细胞及毒株 无血清悬浮犬肾上皮MDCK细胞株由长春生物制品研究所责任有限公司疫苗六室制备;流感毒株B/Brisbane/60/2008(NYMC BX-35)由NIBSC提供。
1.2 主要试剂及仪器Benzonase®核酸酶(纯度≥90%)购自德国Merck公司;牛血清白蛋白(BSA)购自中国食品药品检定研究院;CD MDCK 244培养基购自甘肃健顺生物科技有限公司;DMEM购自美国Gibco公司;宿主细胞残留DNA样本前处理试剂盒(磁珠法)和MDCK细胞残留DNA检测试剂盒购自湖州申科生物技术有限公司;MDCK细胞残留蛋白检测试剂盒购自美国CYGNUS公司;血凝素检测用标准血清与标准抗原均购自NIBSC;Capto Core 700、Capto Q和AKTA pure150层析系统均购自美国GE Healthcare公司。
1.3 病毒液制备 将无血清悬浮MDCK细胞在CD MDCK 244培养基中培养48 h;补加DMEM病毒维持液,加入流感病毒继续培养48~60 h;收获病毒液,经澄清后超滤浓缩,浓缩液中加入2 mmol/L MgCl2与Benzonase®核酸酶37℃消化后,进行蔗糖区带离心及灭活。上柱前所有病毒样品均8 169×g离心30 min。
1.4 核酸酶处理条件的优化 向病毒超滤浓缩液中加入不同终浓度(1、10、30、50 U/mL)的Benzonase®核酸酶,置37℃振荡孵育,每间隔2 h(0、2、4、6、8 h)取样,检测残留DNA。
1.5 Capto Core 700层析条件的优化
1.5.1 上样缓冲液盐离子浓度 采用50 mmol/L Tris pH 7.4的缓冲体系,分别加入不同盐离子浓度(150、500、1 000 mmol/L NaCl),分别平衡柱子后上样,收集流穿峰,全程流速为150 cm/h,每个条件重复3次。检测总蛋白含量、血凝素含量、宿主细胞残留蛋白和残留DNA。
1.5.2 线性流速的优化 设3个线性流速分别为60、150和300 cm/h,缓冲体系为150 mmol/L NaCl+50 mmol/L Tris,pH 7.4。用上述3个线性流速分别过柱,收集流穿峰,每个条件重复3次。检测总蛋白含量、血凝素含量、宿主细胞残留蛋白和残留DNA。
1.6 Capto Q线性流速的优化 采用的缓冲体系为500 mmol/L NaCl+50 mmol/L Tris,pH 7.4[11],设3个线性流速分别为60、150和300 cm/h。用上述3个线性流速分别过柱,收集流穿峰,每个条件重复3次。检测血凝素含量和宿主细胞残留DNA。
1.7 病毒纯化 按1.3项制备病毒液后,经复合介质和离子交换2步层析,加入裂解剂室温裂解2 h,超滤去除裂解剂,除菌获得单价原液。共纯化3批40 L病毒收获液。检测从病毒收获液、核酸酶处理、复合介质与离子交换层析液至单价原液中的总蛋白含量、血凝素含量、宿主细胞残留蛋白和残留DNA含量。
1.8 总蛋白含量检测 采用lowry法。以BSA为标准品,按照《中国药典》三部(2015版)要求[12]进行操作。
1.9 宿主细胞残留DNA检测 采用宿主细胞残留DNA样本前处理试剂盒(磁珠法)提取样品残留宿主DNA,qPCR荧光探针法检测残留DNA含量,具体操作按照MDCK残留DNA检测试剂盒说明书进行。
1.10 宿主细胞残留蛋白检测 采用MDCK细胞残留蛋白检测试剂盒,具体操作按照试剂盒说明书进行。
1.11 血凝素含量检测 采用单向免疫扩散(single radial immunodiffusion,SRID)法[12]。
1.12统计学分析 应用SPSS 24.0软件进行统计学分析,实验结果以均值±标准差(±s)表示,实验组各实验条件间的显著性分析采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 核酸酶处理条件 结果显示,当DNA起始浓度较高时(258 600 ng/mL),1 U/mL核酸酶酶解8 h后残留DNA去除率为(98.96±0.26)%,残留2 701 ng/mL,50 U/mL核酸酶残留DNA去除率为(99.96±0.02)%,残留103.8 ng/mL,两者消化能力相差26倍;而10 U/mL核酸酶残留DNA去除率为(99.92±0.06)%,残留207.2 ng/mL,30 U/mL核酸酶残留DNA去除率为(99.96±0.01)%,残留
108.9 ng/mL,均与50 U/mL核酸酶消化能力相当。见表1。
表1 高DNA起始浓度时不同酶解时间及核酸酶添加浓度对残留DNA的去除率(%,±s,n=3)Tab.1 Removal rate of residual DNA at a high original concentration by nuclease at various concentrations for addition for various time durations(%,±s,n=3)

表1 高DNA起始浓度时不同酶解时间及核酸酶添加浓度对残留DNA的去除率(%,±s,n=3)Tab.1 Removal rate of residual DNA at a high original concentration by nuclease at various concentrations for addition for various time durations(%,±s,n=3)
?
当DNA起始浓度较低时(5 634 ng/mL),1 U/mL核酸酶酶解8 h后残留DNA去除率为(99.04±0.59)%,残留54 ng/mL,50 U/mL核酸酶酶去除率为(99.57±0.32)%,残留24.3 ng/mL,两者消化能力仅差2.2倍。见表2。
表2 低DNA起始浓度时不同酶解时间及核酸酶添加浓度对残留DNA的去除率(%,±s,n=3)Tab.2 Removal rate of residual DNA at a low original concentration by nuclease at various concentrations for addition for various time durations(%,±s,n=3)
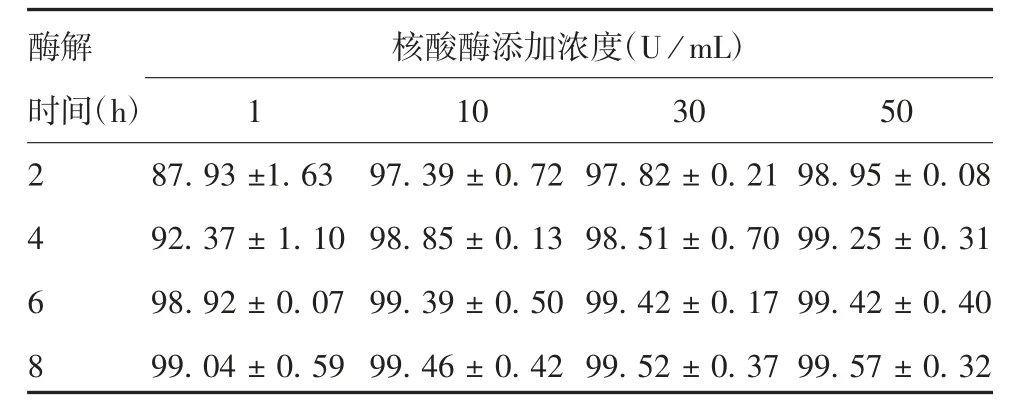
表2 低DNA起始浓度时不同酶解时间及核酸酶添加浓度对残留DNA的去除率(%,±s,n=3)Tab.2 Removal rate of residual DNA at a low original concentration by nuclease at various concentrations for addition for various time durations(%,±s,n=3)
?
综合成本,根据每批病毒液的收获情况与核酸酶添加顺序,当核酸酶在纯化前期加入时残留DNA起始浓度较高,可添加10 U/mL核酸酶酶解4~6 h,在纯化后期加入时残留DNA起始浓度较低,可添加1 U/mL核酸酶酶解6~8 h。
2.2 复合介质层析条件
2.2.1 上样缓冲液盐离子浓度 随着上样缓冲液盐离子浓度的增加,宿主细胞残留蛋白的去除率略有降低,但3种上样缓冲液盐离子浓度下宿主细胞残留蛋白的去除效果差异无统计学意义(F=1.760,P=0.250);3种上样缓冲液盐离子浓度下的残留DNA、总蛋白去除率和血凝素回收率差异也无统计学意义(F分别为0.462、0.338和0.028,P分别为0.651、0.726和0.973)。见表3。不同的缓冲液盐离子浓度对于复合介质纯化效果影响不大,根据宿主细胞残留蛋白去除效果,初步选择上样缓冲液为150 mmol/L NaCl+50 mmol/L Tris,pH 7.4。
表3 复合介质Capto Core 700不同上样缓冲液盐离子浓度的纯化效果(%,±s,n=3)Tab.3 Purification effect of samples by Capto Core 700 at various sodium chloride concentrations in loading buffer(%,±s,n=3)

表3 复合介质Capto Core 700不同上样缓冲液盐离子浓度的纯化效果(%,±s,n=3)Tab.3 Purification effect of samples by Capto Core 700 at various sodium chloride concentrations in loading buffer(%,±s,n=3)
?
2.2.2 线性流速 随着流速的不断增加,杂质的去除效果呈下降趋势,其中3种线性流速下宿主细胞残留蛋白去除效果差异有统计学意义(F=16.949,P=0.003),而3种线性流速下血凝素回收率虽不断增加,但差异无统计学意义(F=0.769,P=0.504),见表4。初步选择线性流速为60 cm/h。
表4 复合介质Capto Core 700不同线性流速下的纯化效果(%,±s,n=3)Tab.4 Purification effect of samples by Capto Core 700 at various linear flow rates(%,±s,n=3)

表4 复合介质Capto Core 700不同线性流速下的纯化效果(%,±s,n=3)Tab.4 Purification effect of samples by Capto Core 700 at various linear flow rates(%,±s,n=3)
?
2.3 Capto Q线性流速 随着流速的不断增加,残留DNA去除效果减弱,血凝素回收率不断增加,3种线性流速下残留DNA去除效果差异有统计学意义(F=33.458,P=0.001),血凝素回收率差异无统计学意义(F=3.915,P=0.082),根据残留DNA/血凝素的比值,比值越小说明杂质去除效果越好,同时血凝素回收率越高,因此选择流速为150 cm/h。见表5。
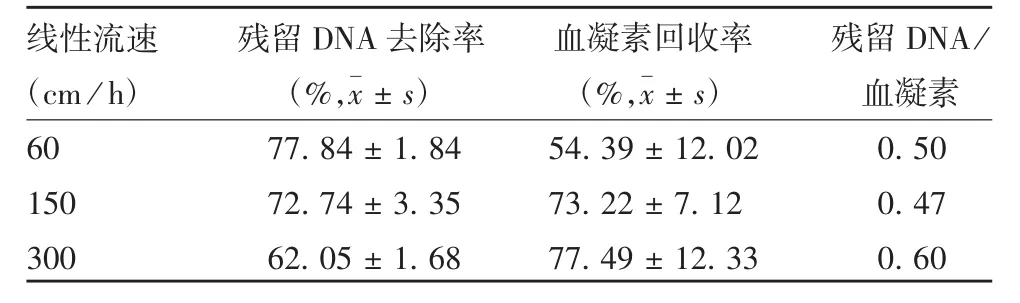
表5 Capto Q不同线性流速下的纯化效果(n=3)Tab.5 Purification effect of samples by Capto Q at various linear flow rates(n=3)
2.4 纯化病毒的检测结果 结果显示,经过Capto Core 700层析纯化后,可去除(86.68±8.64)%的宿主细胞残留蛋白和(54.85%±10.92)%的残留DNA,见图1。Capto Core 700的流穿液经Capto Q后,去除了(85.75±9.39)%的残留DNA,见图2。最后获得的单价原液血凝素含量为(528.91±25.21)μg/mL,宿主细胞残留蛋白为(4.13±2.23)μg/mL,残留DNA为(10.33±4.92)ng/mL。以血凝素含量15 μg/剂参考欧盟对四价细胞流感疫苗中残留DNA含量不高于10 ng/剂的标准,残留DNA/血凝素含量比值应不高于0.17 ng/μg,而本工艺生产的单价原液残留DNA/血凝素比值平均为0.02 ng/μg,达到欧盟要求。见表6和表7。
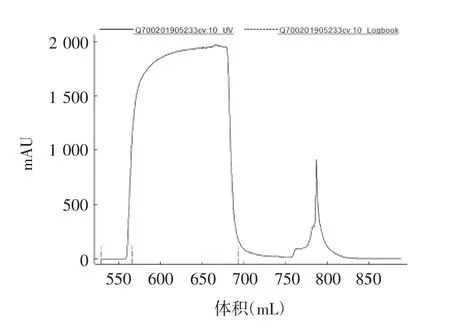
图1 Capto Core 700层析图谱Fig.1 Capto Core 700 vhromatographic profile
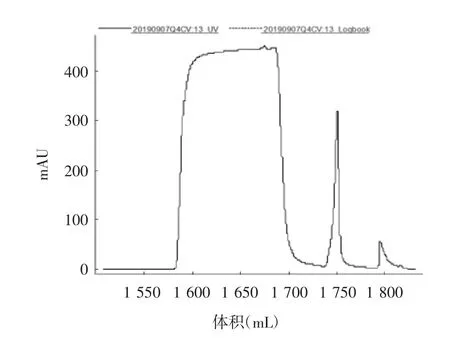
图2 Capto Q层析图谱Fig.2 Capto Q chromatographic profile
表6 纯化过程中关键步骤的关键指标检测(±s,n=3)Tab.6 Key indexes at major steps of purification process(±s,n=3)
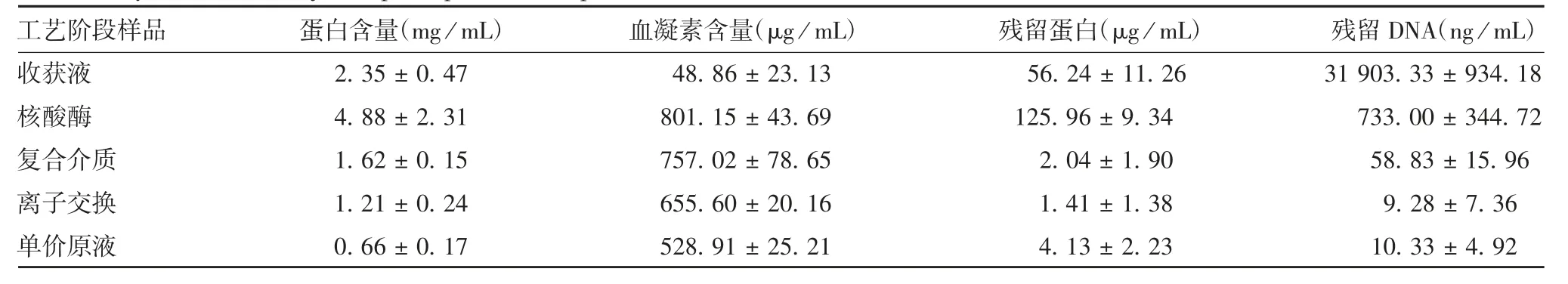
表6 纯化过程中关键步骤的关键指标检测(±s,n=3)Tab.6 Key indexes at major steps of purification process(±s,n=3)
?
表7 MDCK细胞培养流感病毒纯化工艺的得率及杂质去除率(%,±s,n=3)Tab.7 Recovery and removal rate of influenza virus cultured in MDCK cells after purification by developed purification process(%,±s,n=3)
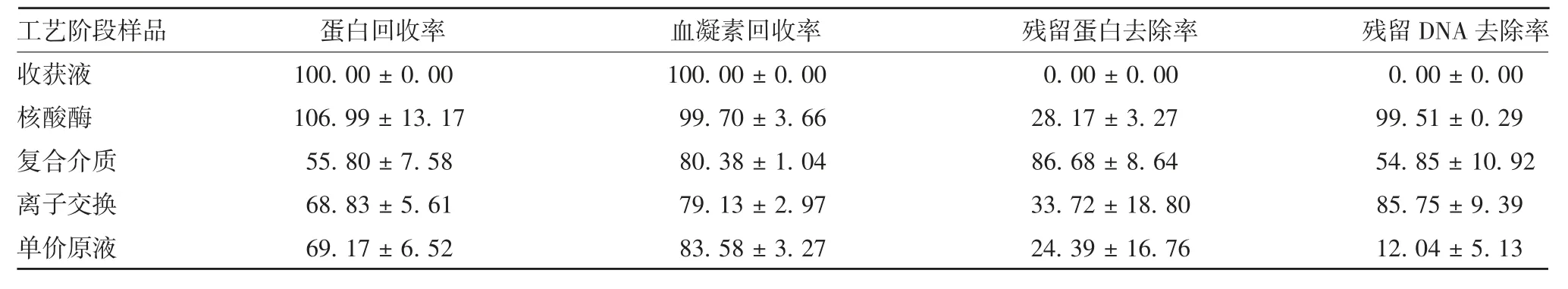
表7 MDCK细胞培养流感病毒纯化工艺的得率及杂质去除率(%,±s,n=3)Tab.7 Recovery and removal rate of influenza virus cultured in MDCK cells after purification by developed purification process(%,±s,n=3)
?
3 讨论
近年来,世卫组织积极推进使用细胞培养替代鸡胚培养生产流感疫苗。细胞培养生产流感疫苗能在较短时间内制备足够的剂量帮助人类应对大规模暴发的流感。国内尚无细胞流感疫苗上市,国外有Solvay Pharmaceuticals、Novartis、MedImmune[13]、SK[14]四家制造商以MDCK细胞为基质生产流感疫苗获批上市。其中Novartis公司和韩国SK公司生产的流感疫苗采用悬浮MDCK细胞培养流感病毒生产疫苗。临床数据显示,Novartis公司的悬浮MDCK细胞流感疫苗Optaflu在免疫原性、安全性及耐受性方面均优于鸡胚疫苗[15]。本研究使用的无血清悬浮MDCK细胞,不添加血清无外源因子污染,更易于规模化生产。
本研究对使用的Benzonase®核酸酶的添加顺序、作用浓度及时间进行了初步摸索。考虑到核酸酶的作用不仅能把DNA消化成3~5 bp的小片段,同时还能降低样品黏度促进后续过滤操作,因此考虑在纯化前期加入核酸酶,为后续精细纯化进一步去除宿主残留DNA减小压力。同时试验结果显示,核酸酶添加浓度最大50 U/mL、作用8 h,在DNA起始浓度较低(5 634 ng/mL)时也无法完全消化DNA(残留24.3 ng/mL)。有研究添加了300 U/mL核酸酶,酶解26 h后仍有0.9% DNA残留[4]。表明在病毒样品的下游纯化工艺中添加核酸酶后仍会残留少量DNA,可能是DNA与蛋白质或病毒颗粒结合缠绕,核酸酶无法作用到DNA。经过Benzonase®核酸酶处理后的血凝素含量酶解前后变化不大,表明核酸酶对流感病毒的活性影响不大,这与报道的结论一致[16]。
有研究使用尺寸排阻与离子交换的两步层析组合法可避免病毒的特异性结合,但最后残留DNA约500 ng/剂,远未达到欧盟标准[17]。另有研究采用弱阴离子、亲和层析与尺寸排阻的3步层析组合,残留DNA水平可达0.3 ng/剂,但未提供完整的血凝素回收率数据,难以评估其工艺应用于生产的可行性[4]。本研究采用2步层析法,先经复合介质后再经强阴离子交换,此过程均采用流穿模式收集目的蛋白,避免了任何病毒特异性捕获步骤。经过两步层析后最终去除了99.94%的宿主细胞残留蛋白和99.99%的残留DNA,其中残留DNA为2.35 ng/剂。因此,应注意通过选择适当培养基、培养条件和收获时间点来最大程度地减少细胞DNA释放水平从而进一步降低残留DNA。
综上所述,本研究初步建立了采用无血清悬浮MDCK细胞为基质培养流感病毒的下游纯化工艺,为后续MDCK细胞流感疫苗的生产奠定了基础。

