东洞庭湖表层水体中抗生素及抗性基因的赋存特征与源分析
宋冉冉, 国晓春, 卢少勇*, 刘晓晖, 王晓慧
1.北京化工大学化学工程学院, 北京 100029 2.中国环境科学研究院, 湖泊水污染治理与生态修复技术国家工程实验室, 环境基准与风险评估国家重点实验室, 北京 100012
自20世纪30年代以来,抗生素被广泛应用于人畜疾病治疗及农业活动等方面,然而只有25%~75%的抗生素能被吸收,剩余抗生素会以原形或代谢物形式经由粪尿排出体外[1-4]. 未被吸收的抗生素进入环境中不仅会增加环境污染负荷,还会诱导产生一些耐药菌群或抗生素抗性基因(ARGs)[5-7]. 环境中的ARGs可通过食物链进入人体,影响疾病治疗效果及危害人体健康[8-9]. 世界卫生组织已将抗生素耐药性作为重大的全球性公共健康问题之一[10]. 此外,ARGs可产生特殊的生态毒理效应,通过水平转移在菌间传递,也可随微生物繁殖传给子代,对公共卫生、食品和饮用水安全构成严重威胁[11-12].
2006年,Pruden等[13]首次将ARGs视为新兴污染物提出,由此ARGs开始受到世界范围内越来越多研究者的关注,在美国[14]、中国[15]、瑞士[16]、日本[17]、意大利[10]和澳大利亚[18]等国家均检测出了ARGs. 我国作为世界上较大的抗生素生产国和消费国,每年抗生素生产量和用量分别达24.8×104和16.2×104t,且超过5 t的抗生素排入水环境中[19-20],导致ARGs在我国鄱阳湖[21]、洪泽湖[22]、博斯腾湖[4]、洪湖[23]、太湖[24]等水体中被广泛检出.
水环境是ARGs重要的聚集地,其可通过直接或间接途径传播给人类和动物,产生健康风险[25]. 除背景水平的ARGs(微生物的内在抗性)外,外源输入是水环境中ARGs的重要来源,包括医疗废水、畜禽养殖废水、水产养殖废水和污水处理厂出水等[26-27]. 目前,对湖泊内ARGs的研究主要集中在污染水平分析,对湖泊水环境与陆地污染源ARGs的响应关系研究还比较少,进行湖泊内陆地污染源中ARGs污染特征的研究及量化其对湖内ARGs污染的贡献,是亟需解决的科学问题. 东洞庭湖作为洞庭湖流域东、西、南三湖中最大、最完整的集水盆地,是连接长江的纽带,其水质的好坏直接影响生态环境安全及长江的水质. 东洞庭湖区水产养殖面积、畜禽养殖数量及人口密度均较大,向东洞庭湖输送大量抗生素等污染物. 已有研究[19,28]表明,洞庭湖流域的抗生素排放量(3 440 t/a)居全国之首,且在洞庭湖流域东洞庭湖的污染水平最突出. 因此,研究ARGs在东洞庭湖流域中的赋存特征及迁移转化至关重要. 已有的少数研究多关注东洞庭湖内抗生素随季节的变化特征[28]以及沉积物中ARGs的含量[23],但尚没有关于表层水体中ARGs的污染特征以及陆地污染源对湖内ARGs贡献的系统研究. 该研究通过调查东洞庭湖表层水体中ARGs和抗生素的污染情况,定量分析陆地污染源中的ARGs,并对抗生素等环境参数进行冗余分析,明确东洞庭湖表层水体中抗生素及ARGs的赋存特征,探讨陆地污染源ARGs的分布及其入湖通量,以及ARGs丰度与抗生素及环境因素之间的相关关系,以期为东洞庭湖水体的污染防治提供可靠的数据支撑.
1 材料与方法
1.1 研究区域及样品采集
东洞庭湖(28°59′N~29°38′N、112°43′E~113°15′E)位于湖南省东北部,总面积 1 328 km2,平均水深6.39 m. 常年湖容量1.78×1010m3,年均气温17 ℃,总降水量 1 200~1 330 mm,无霜期258~275 d. 1982年成立东洞庭湖自然保护区,1994年升格为国家级自然保护区,主要保护洞庭湖湿地生态和生物资源. 东洞庭湖作为长江中下游仅有的2个天然湖泊之一,在调节洪水径流和保护物种基因或生物多样性方面发挥着重要作用.
该研究在东洞庭湖流域设定了14个采样点(X1~X14),于2019年11月采集表层水样品. 采用不锈钢桶采集0~1 m的表层水,置于1 L棕色瓶中,不锈钢桶和棕色瓶使用前均用甲醇和超纯水清洗并用水样润洗过. 加入5 mL甲醇抑制微生物生长,运至实验室于0~4 ℃冰箱保存. 同时,在东洞庭湖典型陆地污染源区(水产养殖区和污水处理厂)布设7个采样点:钱粮湖镇污水处理厂(W1采样点)、水产养殖区(W2、W3、W4和W5采样点)、岳阳市君山区第二污水厂(W6采样点)和君山区城区污水净化中心(W7采样点),利用不锈钢桶采集水产养殖区废水以及污水处理厂进、出水,置于1 L棕色瓶中. 采样点布设如图1所示.

图1 东洞庭湖采样点的布设Fig.1 Layout of sampling sites in East Dongting Lake
1.2 抗生素的检测
1.2.1样品预处理
用0.22 μm无菌滤膜过滤水样(1 L),加入0.5 g EDTA-2Na,用2 mol/L盐酸调节pH至3.0. 样品混匀后,以3 mL/min的流速通过Oasis HLB小柱进行富集. 富集完成后,用10 mL 5%甲醇水和10 mL纯水洗壁,抽干2 h. 再用6 mL甲醇、6 mL甲醇(5%)氨溶液进行缓慢洗脱,收集洗脱液于15 mL氮吹管中,在40 ℃水浴条件下氮吹至近干. 最后用1 mL甲醇溶液进行复溶,过0.22 μm滤膜后装入进样小瓶中,于0~4 ℃冰箱保存待测.
1.2.2抗生素的测定
用超高效液相色谱串联质谱仪(ACQUITY UPLC-XEVO-TQMSUSA, 美国Waters公司)测定水样中的12种抗生素(均购自德国的Ehrenstorfer公司),即罗红霉素(Roxithromycin,ROM)、土霉素(Oxytetracycline,OTC)、红霉素(Erythromycin,ERM)、四环素(Tetracycline,TC)、金霉素(Chlortetracycline,CTC)、磺胺嘧啶(Sulfadiazine,SDZ)、磺胺二甲嘧啶(Sulfadimidine,SMZ)、磺胺甲恶唑(Sulfamethoxazole,SMX)、氧氟沙星(Ofloxacin,OFLO)、诺氟沙星(Norfloxacin,NOR)、环丙沙星(Ciprofloxacin,CIP)和恩诺沙星(Enrofloxacin,ENR). 所有化学试剂和溶剂均为色谱纯,标准品(1 mg/L)溶于甲醇,在20 ℃下避光保存,直至分析.
色谱条件:色谱柱为UPLC BEH-C18柱(50 mm×2.1 mm,1.7 μm);柱温为40 ℃;流动相为溶剂A(0.01%甲酸水溶液)和溶剂B(100%乙腈). 梯度洗脱分离:0~1 min,15%~20%溶剂A,保持1 min;1~8 min,20%~30%溶剂A;8~17 min,30%~15%溶剂A,保持9 min.
质谱条件:离子源为电喷雾电离源(electrospray ionization,ESI);干燥气流速为10.0 L/min;雾化气流速为3.0 L/min;加热气流速为10.0 L/min;加热模块温度为400 ℃;扫描模式为多重反应监测(multiple-reaction monitoring,MRM).
1.3 抗性基因的检测
1.3.1样品预处理和DNA提取
用0.22 μm无菌滤膜过滤水样(1 L),利用基因组DNA提取试剂盒(美国OMEGA公司)提取DNA,并提取的DNA保存于-80 ℃冰箱备用.
1.3.2抗性基因的测定
采用实时荧光定量PCR技术(LineGene9600plus型荧光定量PCR仪,杭州博日科技有限公司)进行抗性基因的检测,共检测8种抗性基因:sul1、sul2、tetA、tetM、tetW、ermA、ermB、qnrS.引物序列和PCR反应条件见表1. PCR条件:在95 ℃下初始变性3 min,随后在95 ℃下保持30 s,在所需退火温度(见表1)下退火30 s,最后在72 ℃下延伸40 s,所有步骤循环35次. ARGs的标准曲线呈现良好的线性关系(R2>0.99),标准品扩增效率为88.93%~106.22%,满足试验要求.

表1 抗性基因的引物序列和PCR反应条件
1.4 水质参数测定
利用EXO2便携式多参数水质检测仪(美国YSI公司)检测水样的pH、氧化还原电位(ORP)、电导率(EC)、DO浓度和温度(T). 利用DR5000紫外分光光度计(美国HACH公司)检测水样中TN、TP、NH4+-N、NO3--N和正磷酸盐(M3PO4)的浓度.
1.5 陆地污染源入湖通量估算
污水处理厂按照点源排放考虑,根据式(1)[29]估算入湖通量:
(1)
式中:W为估算时间段内污染物的入湖通量,copies/a;n为估算时间段内的采样次数,该研究取值为1;K为时段转化系数,取值365;Qi为排放流量,m3/d;Ci为污染物浓度,copies/mL.
水产养殖区按照面源排放考虑,参考《第一次全国污染源普查 水产养殖业污染源产排污系数手册》,并结合东洞庭湖周边水产养殖业污染物排放情况来确定水产养殖业ARGs产排污系数,然后计算其入湖通量,即入湖通量=污染物排放量=排污系数×养殖增产量.
1.6 数据分析
利用Excel 2010软件进行数据的输入和处理;利用Canoco 5 软件进行ARGs丰度与环境变量的冗余分析;使用Origin 9.0软件绘制图表;使用ArcGIS 10.0软件绘制采样点位图.
2 结果与讨论
2.1 东洞庭湖表层水体中抗生素的赋存水平
抗生素的浓度水平如表2所示. 由表2可见,除红霉素外其余11种抗生素均有不同程度的检出,罗红霉素、磺胺嘧啶和氧氟沙星的检出率均为100%,诺氟沙星和环丙沙星的检出率最低,均为7%. 东洞庭湖表层水体中抗生素浓度范围为ND(未检出)~486.59 ng/L,氧氟沙星浓度最高,其次为土霉素、磺胺甲恶唑、金霉素、罗红霉素、恩诺沙星、四环素,其他抗生素浓度处于较低水平. 结合检出率与检出浓度来看,氧氟沙星和罗红霉素是东洞庭湖表层水体中的主要抗生素类型.

表2 东洞庭湖表层水体中不同种类抗生素的浓度
喹诺酮类抗生素浓度范围为ND~486.59 ng/L,平均值为18.58 ng/L. 氧氟沙星浓度最高达486.59 ng/L,平均值为63.41 ng/L,检出率为100%,居所有抗生素之首. 氧氟沙星主要用于人类疾病治疗,医疗用量较大[30],因此水体中氧氟沙星的来源可能为周围医疗废水直排. 恩诺沙星的浓度水平位居第二,平均值为8.09 ng/L,检出率为50%,归因于恩诺沙星在水产养殖和畜牧业中的高使用量[31]. 诺氟沙星和环丙沙星的检出率和浓度均处于较低水平,这是由于诺氟沙星已被禁止在未成年人中使用,限制了其用量[32]. 东洞庭湖中喹诺酮类抗生素的平均浓度高于巢湖(15.39 ng/L)[33]和大通湖(8.55 ng/L)[34],略低于艾比湖(19.54 ng/L)[35]. 氧氟沙星的浓度远高于艾比湖(22.67 ng/L)[35],与太湖贡湖湾(14~474 ng/L)[36]相当;诺氟沙星的浓度比太湖贡湖湾(14~474 ng/L)[36]低很多;恩诺沙星的浓度与大通湖(8.04 ng/L)[34]基本持平. 喹诺酮类药物主要应用于规模化养殖及人类疾病控制,这些显著的差异可能与研究区域内喹诺酮类抗生素使用量不均有关.
磺胺类抗生素浓度范围为ND~220.95 ng/L,平均值为7.44 ng/L,低于珠江三角洲(<776 ng/L)[37]和大通湖(37.41 ng/L)[34]. 磺胺甲恶唑的平均浓度最高(20.73 ng/L),归因于其在水环境中的降解受光照及好氧等条件影响小,能在水体中长期存在[38]. 磺胺类抗生素由于具有广谱性、疗效强和价格低廉等特点被广泛应用于水产养殖业中,以提高养殖鱼类的健康和产量[39]. 因此,磺胺甲恶唑的高检出浓度可能与研究区域内磺胺甲恶唑在水产养殖业的广泛使用有关.
大环内酯类抗生素浓度范围为ND~110.66 ng/L,罗红霉素检出率为100%,红霉素均未检出. 罗红霉素最高浓度达110.66 ng/L,低于太湖(218.3 ng/L)[40]和白洋淀(155 ng/L)[41],但高于南昌市城市湖泊(20.8 ng/L)[31]4倍以上. 罗红霉素主要用于农业养殖及医疗,其在水体中的检出率及检出浓度相对较高,说明此类抗生素在东洞庭湖周围居民中的使用量大,使用频率高.
四环素类抗生素浓度范围为ND~50.32 ng/L,平均值为14.08 ng/L. 东洞庭湖土霉素、四环素和金霉素的平均浓度均高于艾比湖(平均值分别为10.12 ng/L、2.49 ng/L、ND)[35]和大通湖(平均值分别为0.68、1.65、3.92 ng/L)[34],呈现出较高水平,应引起足够注意. 土霉素的平均浓度最高(22.12 ng/L),与王倩倩等[35]的研究结果一致. 四环素类抗生素主要用于动物疾病的治疗与预防,其在水环境的稳定性与光照、微生物和沉积物的吸附作用等多种因素有关,进而检出不同的浓度水平[42-43].
2.2 东洞庭湖表层水体中抗生素的空间分布特征
抗生素的浓度水平及空间分布受消耗量、使用频率和环境因子等多种因素的影响. 由图2可见,抗生素的累积浓度为23.02~754.13 ng/L,具有一定的空间差异. X3采样点抗生素的累积浓度最高,氧氟沙星和磺胺甲恶唑是主要贡献因子,贡献率在93%以上,其次为X7采样点,其主要原因是:①X3采样点水产养殖业发达,且靠近生态渔村,饲料中抗生素的添加导致这片区域抗生素浓度相对较高;②X7采样点靠近岳阳市岳阳楼区,人类活动频繁,在医疗中对抗生素的大量使用导致这片区域抗生素浓度较高. X13采样点抗生素的累积浓度最低,可能与该采样点远离人口密集区和水产养殖区有关.

图2 东洞庭湖各采样点抗生素的累积浓度Fig.2 Accumulative concentration of antibiotics at each sampling site in the East Dongting Lake
2.3 东洞庭湖表层水体中抗生素抗性基因的赋存水平
所有抗性基因的检出率均为100%,说明东洞庭湖水体受到磺胺类、四环素类、大环内酯类和喹诺酮类抗性基因的共同污染. ARGs的浓度情况如图3所示. 由图3可见,8种抗性基因的最高浓度均大于2.9×101copies/mL. 基因sul2、tetW、ermA的平均浓度最高,分别为1.3×103、5.4×102和2.0×102copies/mL,磺胺类和四环素类抗性基因的高浓度水平与房平等[44]的研究结果一致.
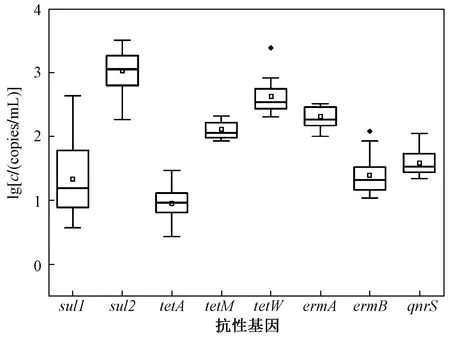
图3 抗性基因绝对浓度(c)的箱式分布图Fig.3 Box-plot of absolute concentration of ARGs
磺胺类抗性基因浓度范围为3.7~3.16×103copies/mL,平均值为7.07×102copies/mL,高于其他三类ARGs. 基因sul2的平均浓度最高,为1.3×103copies/mL,是东洞庭湖流域表层水体中的优势ARGs,这说明该区域磺胺类抗生素使用广泛,存在潜在的环境风险. 截至目前,共发现4种磺胺类基因(sul1、sul2、sul3、sulA),且基因sul1和sul2最常在水环境中检出,这与该研究的结果一致. 与鄱阳湖流域ARGs浓度(基因sul2的平均浓度为1.9×101copies/mL)[45]相比,东洞庭湖表层水体中基因sul2的平均浓度(1.3×103copies/mL)相对较大,说明东洞庭湖流域磺胺类抗性基因污染情况严重,湖泊水环境已经成为ARGs的一个重要储库.
四环素类抗性基因浓度范围为2.69~2.43×103copies/mL,平均值为2.27×102copies/mL,仅次于磺胺类抗性基因,这表明东洞庭湖表层水受磺胺类和四环素类抗性基因污染严重. 一方面是由于ARGs的自我扩增和在环境中的稳定性造成的,ARGs可通过与转座子、质粒等可移动元件结合,在不同细菌间转移和传播,而携带ARGs的菌株死亡后,其携带的ARGs可以在脱氧核糖核酸酶的保护下释放到环境中并持久存在,并通过结合、转导等方式进入到其他菌株内[20,46];另一方面是由于磺胺类和四环素类抗生素在动物养殖业中的广泛使用和滥用所产生的选择性压力造成的. 基因tetA、tetM、tetW的绝对浓度范围分别为2.7~2.9×101、8.5×101~2.1×102、2.0×102~2.4×103copies/mL,平均值从大到小表现为基因tetW>基因tetM>基因tetA,这种浓度水平的差异可能与区域内四环素类抗生素的使用方式、相应抗性机制及不同种类的宿主细菌有关. 四环素类抗性基因在表层水体中广泛存在,四环素类抗生素在表层水体中的检出率和检出浓度较低,这可能与ARGs的“持久性”或“可复制性”有关[47].
大环内酯类抗性基因ermB和喹诺酮类抗性基因qnrS的浓度范围分别为1.1×101~1.2×102、2.2×101~1.1×102copies/mL,含量低于其他两类ARGs,且远低于长江下游湖泊中基因ermB和qnrS的浓度(分别为4.25×104~1.65×105、9.31×102~3.92×106copies/mL)[5],表明这两类抗性基因虽然普遍存在(检出率均为100%),但污染情况并不严重. 喹诺酮类抗生素的检出率和检出浓度都处于较高水平,而喹诺酮类抗性基因qnrS处于较低水平,说明ARGs的存在不完全取决于抗生素的污染程度,可能与该基因不如其他基因稳定有关[48].
2.4 东洞庭湖表层水体中抗生素抗性基因的空间分布特征
湖泊中ARGs污染水平主要受沿湖污染源输入的影响,东洞庭湖ARGs的浓度水平如图4所示. 由图4可见,基因sul2在X5、X14和X12采样点均呈现较高浓度水平,由于周边水产养殖业相对发达,抗生素的使用量及使用频率较高,通过雨水径流或直接施用等途径进入湖中,导致湖内区域磺胺类抗性基因浓度升高. 另外,X14采样点靠近入江口,高浓度的ARGs会随着湖水流至长江,对长江的水质造成影响. X11采样点各抗性基因的检出浓度基本都低于其他采样点,可能是因为该采样点远离岸边,距离外界输入型污染源较远,由于污染物的削减作用导致检出浓度低[22].
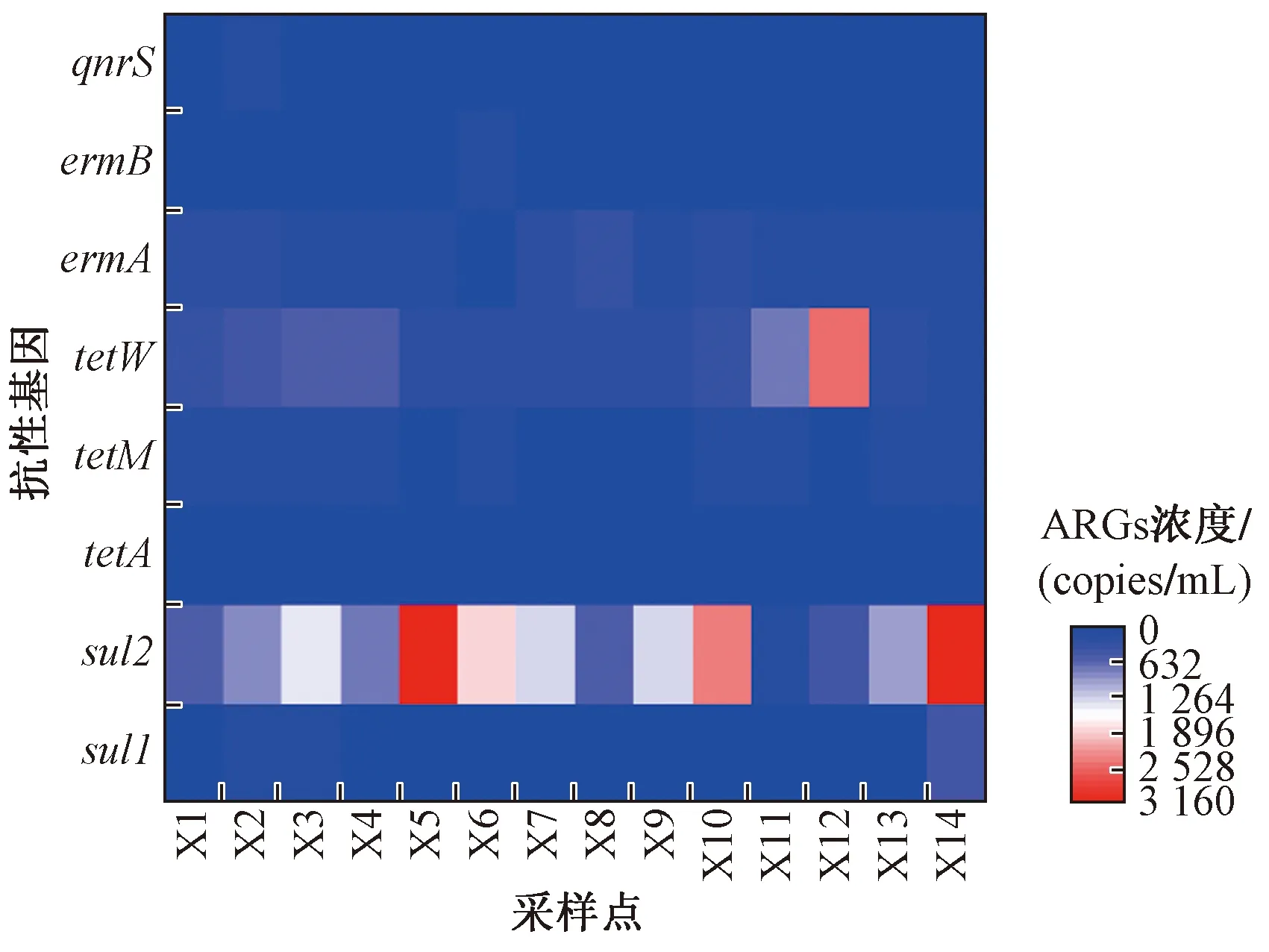
图4 东洞庭湖各采样点抗性基因(ARGs)的浓度Fig.4 Concentration of ARGs at each sampling site in the East Dongting Lake
2.5 东洞庭湖流域抗生素抗性基因的污染源分析
人类活动是影响ARGs分布的重要因素,包括畜禽养殖、水产养殖和污水处理厂等[49]. 陆地污染源ARGs的测定结果如图5所示. 其中W1、W6和W7采样点分别为钱粮湖镇污水处理厂、岳阳市君山区第二污水厂和君山区城区污水净化中心进水,W1-1、W6-1和W7-1采样点分别为钱粮湖镇污水处理厂、岳阳市君山区第二污水厂和君山区城区污水净化中心出水. 由图5可见,钱粮湖镇污水处理厂和君山区城区污水净化中心出水中每种抗性基因的浓度都低于进水,说明污水处理厂对ARGs具有一定的去除效果. 出水中仍含有一定浓度的ARGs,说明污水处理厂中的处理设施不能完全去除ARGs,处理后废水的排放会增加其受纳水体(河流和湖泊)中ARGs的浓度[50-51]. 岳阳市君山区第二污水厂中的基因qnrS经过污水厂处理后浓度甚至增加,污水厂中的生物处理单元常常有大量微生物参与,这增加了ARGs传播的可能性. 以上结果说明污水处理厂在改善环境的同时,有可能会带来二次污染,传统的污水处理方法不能完全去除ARGs,甚至可能增加其丰度,污水处理厂已经成为ARGs向水环境中传播的主要途径[52]. 在水产养殖区废水中,4类ARGs均有不同程度的检出,这与其对应的抗生素在水产养殖业中广泛使用有关. 基因sul2在4个水产养殖废水中的浓度都居于首位,是主要污染物. 与表层水体中ARGs的检测结果结合分析,钱粮湖镇污水处理厂出水中基因qnrS绝对浓度最高(9.81×102copies/mL),在距离该污水处理厂最近的湖内X2采样点也检测到了基因qnrS的最高浓度(1.12×102copies/mL). W5采样点四环素类抗性基因的累积浓度最高(6.16×102copies/mL),在距离该采样点最近的湖内X11和X12采样点,四环素类抗性基因累积浓度也处于较高水平,分别为2.53×103和9.65×102copies/mL. 该研究结果表明,陆地污染源中ARGs的浓度可能会影响湖内表层水体中ARGs的赋存.
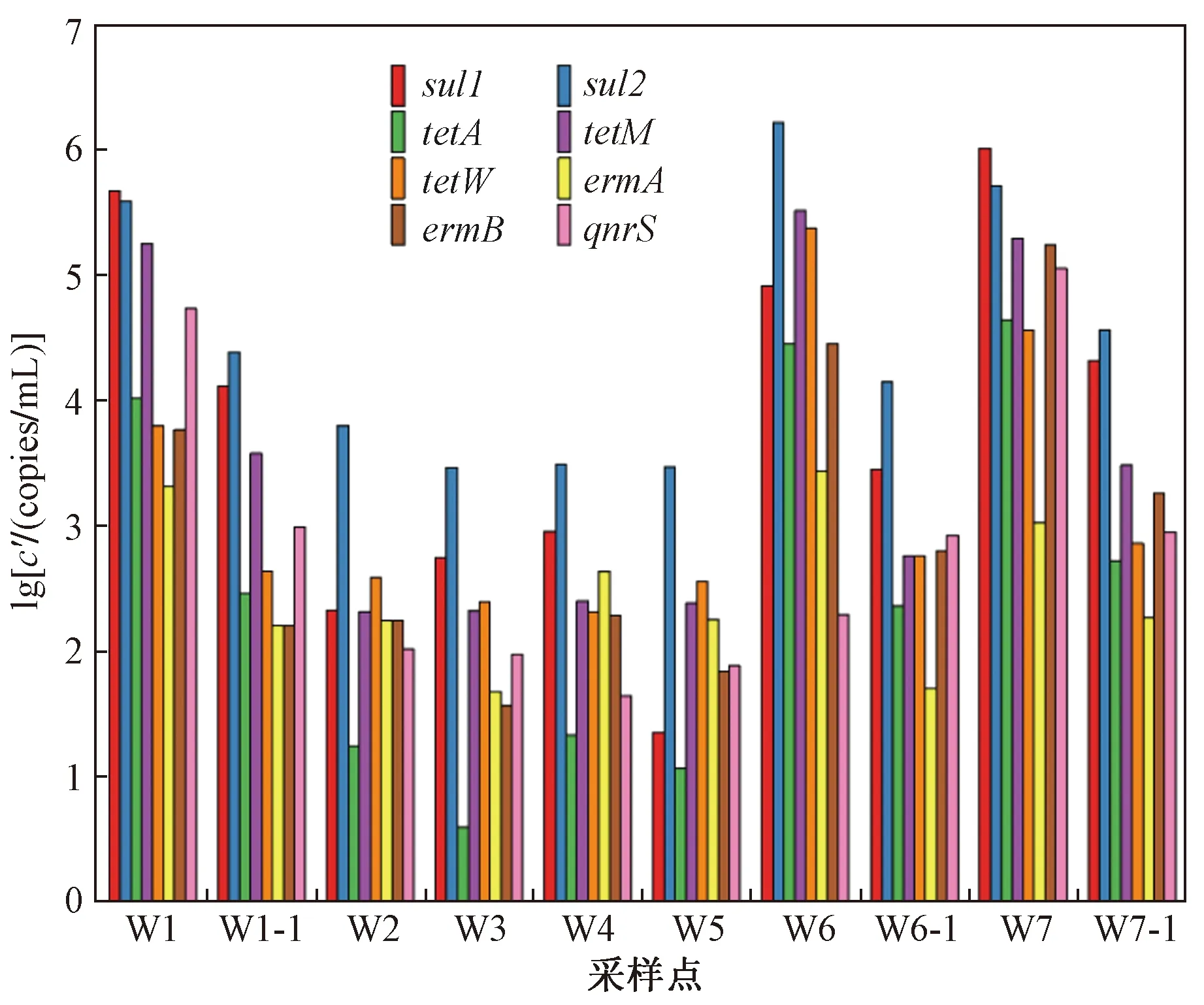
图5 陆地污染源中ARGs的浓度(c′)Fig.5 Concentration of ARGs of land pollution sources
选取的4个水产养殖区,养殖模式均为池塘养殖,主要养殖鱼和虾,通过查找《第一次全国污染源普查 水产养殖业污染源产排污系数手册》,确定养殖鱼和虾的排污系数分别为 0.003 1 和 0.009 0. 钱粮湖镇污水处理厂、岳阳市君山区第二污水厂、君山区城区污水净化中心的排放流量分别为 5 000、50 000、25 000 m3/d,其入湖通量计算结果如图6所示. 由图6可见,污水处理厂出水的ARGs对湖内ARGs的贡献远高于水产养殖区,且所检测的8种抗性基因都有不同程度的贡献. 基因sul2在钱粮湖镇污水处理厂、岳阳市君山区第二污水厂、君山区城区污水净化中心的入湖通量都呈现最高水平(分别为4.46×1016、2.56×1017、3.33×1017copies/a),其次是基因sul1(分别为2.38×1016、5.14×1016、1.90×1017copies/a),成为污水处理厂向湖内输入的主要ARGs. 但是水产养殖区ARGs的污染也不能忽视,对于东洞庭湖来说,湖区水产品占湖南省的1/2,具有水产养殖面积广阔、养殖总量大等特征[53]. 后续研究应该对东洞庭湖所有水产养殖的企业及个体进行普遍调查,从而明确其对湖内污染物的总体贡献,以期为东洞庭湖流域ARGs的污染防治提供决策支持.

图6 陆地污染源中ARGs的入湖通量(W)Fig.6 ARGs fluxes flowing into lake of land pollution sources
2.6 东洞庭湖表层水体中ARGs、抗生素和环境参数之间的相互关系
已有研究[22]发现,ARGs的浓度水平不仅与环境中抗生素的暴露水平相关,还与有机质含量等环境因素相关. 环境中的外源抗生素及其代谢物可能通过基因突变或选择压力在低浓度下加速ARGs的进化,因此ARGs丰度通常与环境中抗生素的浓度呈正相关[54]. 选择水质参数环境变量(如pH、ORP、EC、T以及TN、TP、NH3-N、NO3--N、M3PO4、DO浓度)和检出的主要抗生素,与ARGs含量进行相关性分析,以探究东洞庭湖流域表层水体中环境变量与ARGs丰度之间的潜在关系.
ARGs丰度与抗生素的冗余分析如图7所示. 图7中,蓝色箭头代表ARGs,红色箭头代表抗生素等环境变量,红色箭头与蓝色箭头之间的夹角余弦值代表该环境变量与ARGs丰度的相关性大小[55]. 轴1和轴2的特征值分别为 0.597 3 和 0.168 4,ARGs丰度与抗生素浓度的关系在轴1和轴2的累计解释量为76.56%. 四环素类抗性基因tetA、tetM丰度与四环素(TC)、土霉素(OTC)、金霉素(CTC)浓度均呈正相关,磺胺类抗性基因sul1、sul2丰度与磺胺二甲嘧啶(SMZ)、磺胺甲恶唑(SMX)浓度均呈正相关,大环内酯类抗性基因ermA丰度与罗红霉素(RXM)浓度呈正相关,喹诺酮类抗性基因qnrS丰度与环丙沙星(CIP)、恩诺沙星(ENR)浓度均呈正相关,均符合ARGs在其对应抗生素选择性压力下的特征.
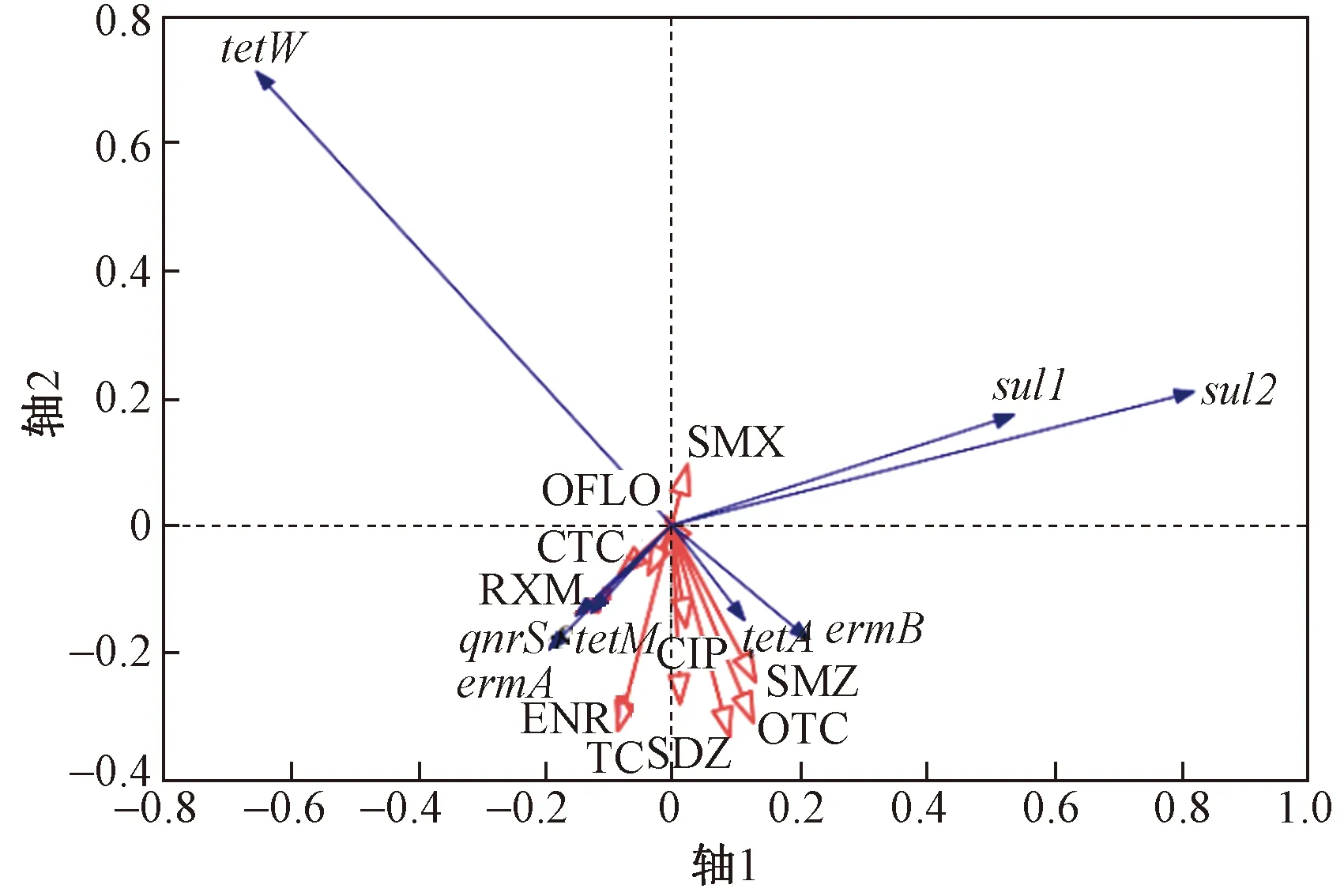
图7 ARGs丰度与抗生素浓度的冗余分析Fig.7 Redundancy analysis between abundance of ARGs and concentration of antibiotics
ARGs丰度与水质参数的冗余分析如图8所示. 由图8 可见,轴1特征值为 0.714 8,轴2特征值为 0.166 2,ARGs与水质参数的关系在轴1和轴2的累计解释量为88.10%. 该研究结果表明,对ARGs丰度影响最重要的4个水质参数分别为TP浓度(贡献率为28.9%)、EC(贡献率为15.4%)、NO3--N浓度(贡献率为13.3%)和T(贡献率为12.7%). 基因tetA、tetW与DO浓度、ORP、T、pH之间的夹角均为锐角,说明这4种水质参数与基因tetA、tetW均呈正相关. pH、T以及TN、NO3--N、M3PO4浓度与基因tetM和qnrS丰度均呈正相关,与基因sul1和sul2丰度均呈负相关. 基因ermA、ermB丰度与EC以及TN、NO3--N、M3PO4、NH3-N浓度均呈正相关. 这表明ARGs的丰度不仅与其对应抗生素的选择性压力有关,还与一些环境因素的压力有关.

注: TN、NO3--N、M3PO4、NH3-N均表示其浓度. 图8 ARGs丰度与水质参数浓度的冗余分析Fig.8 Redundancy analysis between abundance of ARGs and water quality parameters
3 结论
a) 东洞庭湖表层水体中抗生素浓度处于ND~486.59 ng/L水平,氧氟沙星浓度最高,其次依次为土霉素、磺胺甲恶唑、金霉素、罗红霉素、恩诺沙星、四环素,其他抗生素浓度处于较低水平. 抗生素的累积浓度为23.02~754.13 ng/L,且具有一定的空间差异性,这与水产养殖业和人口密集程度相关.
b) ARGs在东洞庭湖表层水体中均被检出,检出率均为100%. 基因sul2、tetW、ermA的平均浓度最高,分别为1.3×103、5.4×102和2.0×102copies/mL. ARGs的浓度水平具有一定的空间差异性,与该地区水产养殖业中的用药和外界输入型污染源距离有关.
c) 污水处理厂对ARGs具有一定的去除效果,但不能完全去除ARGs,甚至会增加ARGs传播的可能性. 磺胺类抗性基因sul2是水产养殖废水中的主要污染物. 入湖通量计算结果显示,污水处理厂出水ARGs对湖内ARGs的贡献远高于水产养殖区,磺胺类抗性基因sul11和sul2是污水厂向湖内输入的主要ARGs.
d) 冗余分析表明,基因tetA、tetM丰度与四环素、土霉素、金霉素浓度均呈正相关,基因sul1、sul2丰度与磺胺二甲嘧啶、磺胺甲恶唑浓度均呈正相关,基因qnrS丰度与环丙沙星、恩诺沙星浓度均呈正相关,符合ARGs在其对应抗生素的选择性压力下的特征;TP浓度(贡献率为28.9%)、EC(贡献率为15.4%)、NO3--N浓度(贡献率为13.3%)和T(贡献率为12.7%)是影响ARGs丰度最重要的环境因子. 这表明ARGs的丰度不仅与其对应抗生素的选择性压力有关,还与一些环境因素的压力有关.

