俄色果不同极性部位的抗氧化、降血糖活性
陈 蓉, 徐 俊, 陈华林, 康晋梅, 敬 勇, 李 敏
(成都中医药大学,中药材标准化教育部重点实验室,中药资源系统研究与开发利用省部共建国家重点实验室培育基地,四川 成都 611137)
俄色果来源于蔷薇科苹果属植物变叶海棠Malustoringoides(Rehd.) Hughes.或花叶海棠Malustransitoria(Batal.) Schneid.的干燥成熟果实,为甘孜藏族自治州民间的一味习用药材,具有悠久药用及食用历史。俄色果在《如意宝树》[1]《晶珠本草》[2]《藏药晶镜本草》[3-4]《新修晶珠本草》[5]和《中华藏本草》[6]中均有记载。俄色果味甘、酸,性平,具有清肺疾,排(化)痰、健胃、降血压等作用。俄色果富含三萜类、有机酸、黄酮、多糖、维生素、氨基酸等成分,聂继云等[7]研究发现变叶海棠果实含有多种二氢查耳酮、黄酮醇类以及花青苷类类黄酮成分。目前甘孜州炉霍雪域俄色有限责任公司制备俄色果酒[8]和果丹皮[9],有将俄色果制成保健茶或预防高原反应的胶囊剂[10-11]或应用于保肝的药物或保健食品中的报道[12-13],俄色果在药用和食用方面均具重要价值。俄色果的现代药理研究较少,仅课题组前期对其降血脂、保肝以及抗氧化作用进行了初步研究。尚未见到对俄色果体外抑制α-淀粉酶活性的报道。
据报道,糖尿病及其并发症的发生与机体的氧化应激水平有关,其诱导的氧化反应是导致糖尿病和代谢综合症等多种慢性疾病的重要因素[14]。α-淀粉酶抑制剂主要通过抑制肠道内唾液和胰淀粉酶的活性,阻碍食物中碳水化合物的水解和消化,减少糖分摄取,降低血糖和血脂水平。通过系统溶剂法梯度萃取俄色果水和95%乙醇提取的混合部位,得到5种俄色果不同极性部位,采用DPPH、ABTS自由基清除实验对5种不同极性部位的抗氧化活性进行研究,选择猪胰-α-淀粉酶为药物靶点,以淀粉为底物,阿卡波糖为阳性对照药,采取体外酶抑制活性检测方法对5种极性部位的α-淀粉酶抑制活性进行筛选,确定α-淀粉酶抑制活性部位,以期为开发相关保健品和药物提供参考。
1 材料
1.1 样品 俄色果由四川省炉霍雪域俄色有限公司2019年10月下旬采摘提供,经成都中医药大学李敏教授鉴定为蔷薇科植物变叶海棠Malustoringoides(Rehd.) Hughes.的干燥成熟果实。称取100 g,粉碎,过24目筛,置于5 000 mL圆底烧瓶中,按1∶20的料液比加入2 000 mL 95%乙醇回流提取2次,每次2 h,趁热过滤,残渣再加10倍量水煎煮2次,每次2 h,趁热过滤,合并2次醇提滤液,减压回收乙醇至无醇味;合并2次水提滤液,与醇提液并浓缩得浸膏,将浸膏用水分散,使其充分混匀,依次加入石油醚、二氯甲烷、乙酸乙酯、水饱和的正丁醇萃取,每次300 mL,连续3 次,剩余部分为水部分,回收各部位萃取溶剂于旋转蒸发仪上蒸干,真空干燥至干,最终得到水、正丁醇、乙酸乙酯、二氯甲烷、石油醚等5个萃取部位样品粉末[15-17]。
1.2 试剂 熊果酸(四川省维克奇生物科技有限公司,纯度≥98%,批号wkq18012906);猪胰-α-淀粉酶(上海源叶生物科技有限公司,批号S08M10I87687);二苯基-2-苦肼基自由基(DPPH,上海源叶生物科技有限公司,批号S14O10M99952);2,2′-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS,大连美仑生物技术有限公司,批号M9403A);2,4,6-三(2-吡啶基)-1,3,5-三嗪(TPTZ,大连美仑生物技术有限公司,批号A0301A);阿卡波糖(上海源叶生物科技有限公司,批号S25M11X109783);抗坏血酸(大连美仑生物技术有限公司,批号J1024A);2,6-二叔丁基对甲酚(BHT,大连美仑生物技术有限公司,批号D1026A)。
1.3 仪器 SQP电子分析天平[赛多利斯科学仪器(北京)有限公司];电子恒温水浴锅(北京中兴伟业仪器有限公司);A580紫外分光光度计[翱艺仪器(上海)有限公司];KQ-500DE型数控超声波清洗器(昆山市超声仪器有限公司);PHS-3E型雷磁PH计(上海精密科学仪器有限公司)。
2 方法
2.1 三萜类成分测定 用乙醇配制100 μg/mL熊果酸对照品溶液。精密称取样品约100 mg,置于10 mL棕色量瓶中,加入约8 mL乙醇,超声45 min后取出,放冷至室温,加乙醇稀释至刻度,摇匀,经0.45 μm微孔滤膜过滤,待测。准确吸取对照品溶液0.125、0.25、0.5、0.75、1 mL和样品溶液0.2 mL于5 mL比色管中,氮气挥干溶剂后进行测定[18]。以熊果酸质量浓度为横坐标(X),吸光度为纵坐标(Y)绘制熊果酸标准曲线,计算不同极性部位的三萜成分含量。
2.2 DPPH自由基清除试验 准确称取DPPH 0.04 g,用乙醇溶解,将溶解液转移到1 000 mL量瓶中定容,摇匀待用。根据前期预试验结果,将俄色果不同极性部位用0.1%DMSO溶液制备成一定浓度的样品溶液,吸取100 μL样品溶液加入3.9 mL 0.1 mmol/L DPPH乙醇溶液中,密塞,摇匀,避光37 ℃水浴30 min。在517 nm波长处以乙醇为参比试剂,测定样品吸光度As;对照组以乙醇代替DPPH溶液和100 μL样品溶液反应,得样品溶液本底吸光度A0;空白组以0.1%DMSO溶液代替样品溶液和3.9 mL 0.1 mmol/LDPPH乙醇溶液反应,得DPPH吸光度A1,以人工抗氧化剂BTH为阳性对照,实验重复3次,计算各浓度样品的DPPH自由基清除率,最后结果以SC50值表示,即DPPH自由基清除率为50%时反应池中样品的终浓度。清除率=[1-(As-A0)/A1]×100%,式中As为样品测定管吸光度,A0为各样品溶液本底吸光度,A1为空白组吸光度。
2.3 ABTS自由基清除试验 将7 mmol/L ABTS和4.9 mmol/L过硫酸钾等体积混合后,在黑暗室温下放置16 h,用无水乙醇稀释至吸光度0.70±0.05(734 nm波长),作为ABTS自由基工作液。根据前期预试验结果,将俄色果不同极性部位用0.1%DMSO溶液制成一定浓度的样品溶液,将100 μL样品溶液加到试管中,再分别加入3.9 mL ABTS自由基工作液,涡旋振荡混匀,室温避光反应15 min,于734 nm波长处以乙醇为参比试剂,测定样品反应后的吸光度AS;对照组以无水乙醇代替ABTS溶液反应,得样品溶液本底吸光度A0;空白组以0.1%DMSO溶液代替样品溶液反应,得ABTS吸光度A1,以人工抗氧化剂BTH为阳性对照,重复3次,计算ABTS自由基清除率,结果以SC50表示。清除率=[1-(As-A0)/A1]×100%,式中As为样品测定管吸光度,A0为各样品溶液本底吸光度,A1为空白组吸光度。
2.4 总抗氧化能力测定 精密移取0.3 mol/L醋酸盐缓冲液,与10 mmol/L TPTZ溶液和20 mmol/L的三氯化铁溶液按照10∶1∶1比例混合,制得质量浓度为0.04 mg/mL的FRAP工作液。根据前期预试验结果,将各部位均制成质量浓度为0.17 mg/mL的溶液,取待测样品溶液100 μL,加入3.9 mL预热至37 ℃的FRAP工作液,漩涡振荡混匀后37 ℃水浴反应10 min,于593 nm处读取吸光度,每份样品平行测定3次,计算FRAP值。以FeSO4为标准物质,浓度为横坐标,吸光度为纵坐标,绘制标准曲线,所有实验均重复3次,以超纯水代替样品作为本底吸光度。样品的总抗氧化能力以FRAP值表示,以1.0 mmol/L的 FeSO4为标准,样品抗氧化活性以达到同样吸光度值为1个FRAP值(样品总抗氧化能力以达到同样吸光度所需FeSO4浓度来表示)。
2.5 俄色果不同极性部位对猪胰-α-淀粉酶抑制活性筛选 根据前期预试验结果,将俄色果不同极性部位用0.1%DMSO溶液制备成一定浓度的样品溶液,吸取250 μL,加入125 μL含α-淀粉酶液的PBS溶液,在37 ℃下保温10 min后,添加250 μL 1%淀粉溶液,在37 ℃下反应5 min。加入0.5 mL DNS溶液颜色剂终止反应,沸水浴10 min后立即取出,置冰水中迅速冷却,加入5 mL去离子水进行稀释,摇匀后在540 nm 波长处测定吸光度。以PBS作为空白对照,阿卡波糖作为阳性对照,设对照空白消除背景颜色,每个样品重复3次,取平均值,计算α-淀粉酶抑制率,结果以IC50表示。抑制率={1-[(As-A0′)/(A1-A0)]}×100%,式中As为样品测定管吸光度,A0′为以磷酸缓冲液代替酶溶液的样品溶液本底吸光度,A1为以磷酸缓冲液代替样品溶液作为空白组的吸光度,A0为以磷酸缓冲液代替样品溶液,酶溶液作为空白组的吸光度。
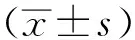
3 结果
3.1 三萜类成分含量测定 以熊果酸质量浓度为横坐标(X),对应吸光度为纵坐标(A)进行回归,得方程A=0.045 1X-0.036(r=0.999 6)。其中,二氯甲烷部位的三萜类成分含量最高,为(4.068±0.668)%,其次为石油醚部位、水部位、正丁醇部位、乙酸乙酯部位,见表1。
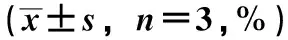
表1 俄色果不同极性部位的三萜类成分含量测定结果
3.2 对DPPH自由基的清除作用 由图1可知,各极性部位对DPPH自由基均具清除作用,并呈现一定的剂量-效应关系。表2显示,各极性部位对DPPH自由基清除作用的SC50值从小到大依次为二氯甲烷部位、石油醚部位、水部位、乙酸乙酯部位、正丁醇部位,可以看出俄色果清除DPPH自由基的主要活性成分集中在二氯甲烷和石油醚部位;BHT的SC50值低于俄色果各部位的SC50值(P<0.05),表明俄色果清除DPPH自由基的能力低于BHT;俄色果各部位清除DPPH自由基的SC50值与三萜类成分具有显著相关性(r=-0.848),因此,各部位DPPH自由基清除能力可能与后者有关。

图1 俄色果不同极性部位对DPPH自由基的清除作用Fig.1 Scavenging effects of different extract parts of Ese fruit on DPPH
3.3 对ABTS自由基的清除作用 由图2可知,各极性部位对ABTS自由基均具清除作用,并呈现一定的剂量-效应关系。表3显示,各极性部位对ABTS自由基的清除作用的SC50值从小到大依次为石油醚部位、乙酸乙酯部位、二氯甲烷部位、正丁醇部位、水部位,可以看出俄色果清除ABTS自由基的主要活性成分集中在石油醚部位;BHT的SC50值与俄色果石油醚部位的SC50值无统计学差异(P≥0.05),表明两者清除ABTS自由基的能力相当;俄色果各部位清除ABTS自由基的SC50值与三萜类成分相关度较低(r=-0.505),推断其他成分在起作用,或三萜与其他成分共同作用。
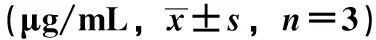
表2 俄色果各极性部位对DPPH自由基清除的SC50值
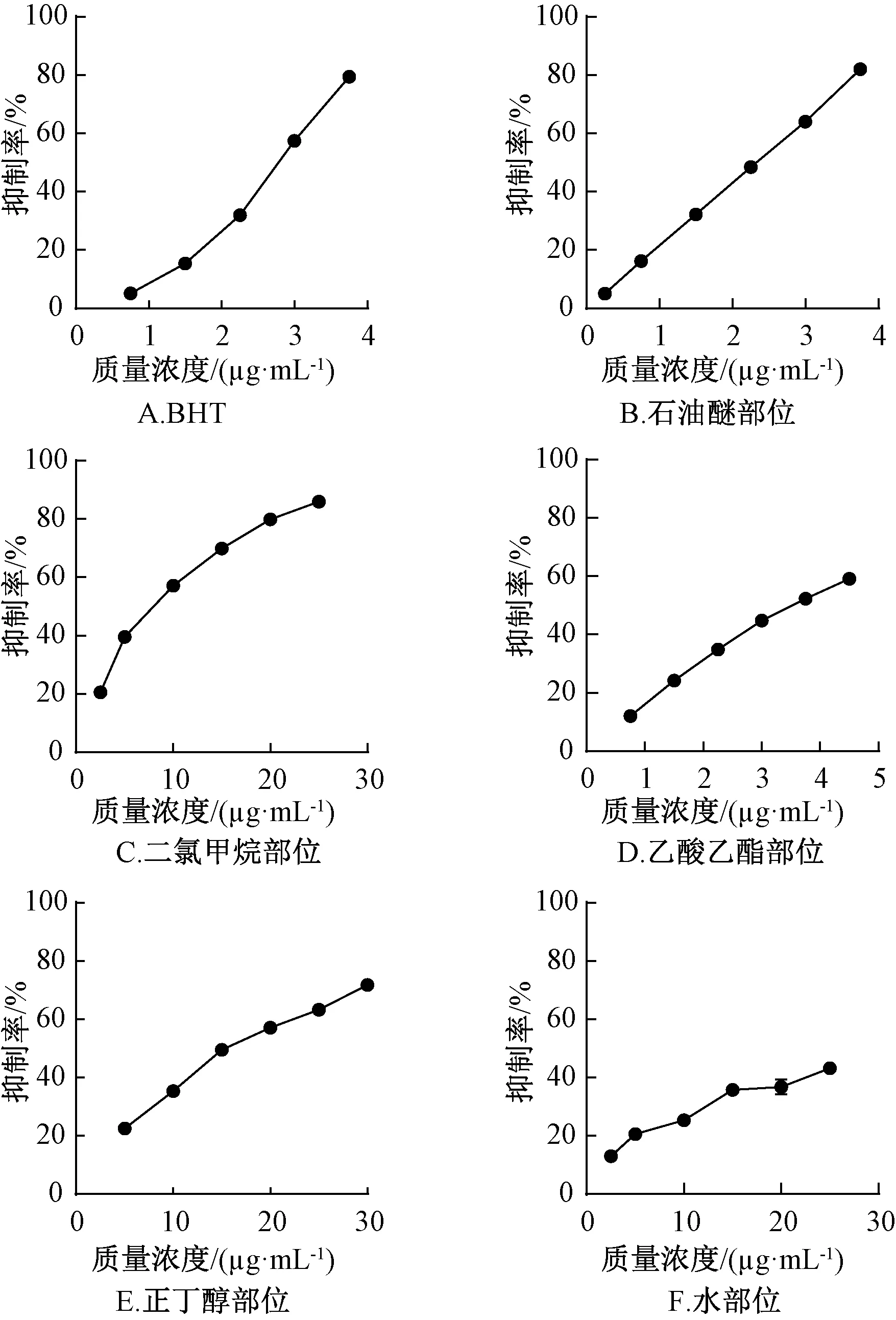
图2 俄色果不同极性部位对ABTS自由基的清除作用Fig.2 Scavenging effects of different extract parts of Ese fruit on ABTS
3.4 总抗氧化能力 按“2.4”项下方法测得FeSO4标准物质方程为Y=0.461 5X+0.006 3(r=
表3 俄色果各极性部位对ABTS自由基清除的SC50值
0.999 3),线性关系较好。由图3可知,同浓度各极性部位的FeSO4当量从大到小依次为石油醚部位、二氯甲烷部位、乙酸乙酯部位、正丁醇部位、水部位,可以看出俄色果的石油醚和二氯甲烷部位的抗氧化能力最强,活性成分集中在这2个部位;同浓度BHT的FeSO4当量大于俄色果各部位的(P<0.05),表明俄色果抗氧化能力低于BHT;俄色果各部位的FRAP值与三萜类成分具有很大的相关性(r=0.864),推测各部位的总抗氧化能力可能与后者有关。
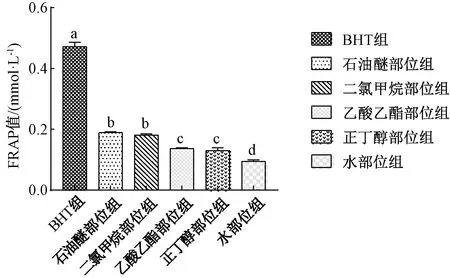
注:不同小写字母表示数据之间差异具有统计学意义(P<0.05)。图3 俄色果不同极性部位总抗氧化能力Fig.3 Total antioxidant capacity of different extract partsof Ese fruit
3.5 俄色果不同极性部位对猪胰-α-淀粉酶抑制活性 由图4可知,各部位均表现出猪胰-α-淀粉酶抑制作用,并呈一定的剂量-效应关系。表4显示,各部位抑制猪胰-α-淀粉酶的IC50值从小到大依次为二氯甲烷部位、石油醚部位、正丁醇、水部位、乙酸乙酯部位,可以看出俄色果抑制猪胰-α-淀粉酶的主要活性成分主要集中在二氯甲烷部位,石油醚部位次之;阿卡波糖对猪胰-α-淀粉酶抑制的IC50值显著小于二氯甲烷部位的IC50值(P<0.05),表明俄色果抑制作用小于阿卡波糖;俄色果各部位抑制α-淀粉酶的IC50值与三萜类成分相关性不大(r=-0.538),但如果除去水部位,其他部位的IC50值与三萜类成分呈显著相关(r=-0.636),说明后者多种活性成分共同作用。

图4 俄色果不同极性部位对猪胰-α-淀粉酶的抑制活性Fig.4 Inhibitory effects of different extract parts of Ese fruit on porcine pancreatic α-amylase
表4 俄色果不同极性部位对猪胰-α-淀粉酶抑制的IC50值
4 讨论
实验结果表明,俄色果各提取部位中,二氯甲烷和石油醚部位的三萜类成分含量明显高于其他部位。各部位均具有抗氧化和α-淀粉酶抑制作用。其中,二氯甲烷和石油醚部位的DPPH自由基清除作用、总抗氧化能力以及α-淀粉酶抑制作用较其他部位强,石油醚部位的ABTS自由基清除作用较其他部位强,可见俄色果抗氧化和降血糖的主要活性成分集中在二氯甲烷和石油醚部位。通过三萜类成分含量与抗氧化和α-淀粉酶抑制作用的相关性分析发现,三萜类成分与DPPH自由基清除作用、总抗氧化能力呈显著相关,与ABTS自由基清除作用和α-淀粉酶抑制作用有一定的相关性,但相关度较低,这意味着可能存在其他成分在起作用或三萜类与其他成分共同作用,除去俄色果水部位后进行分析,发现各部位的三萜类成分与α-淀粉酶抑制作用呈显著相关性,表明其他α-淀粉酶抑制成分主要分布在俄色果水部位。
现代研究发现,相比化学药物,天然植物有效成分具有良好的药理活性和很小的不良反应,且多种活性成分均具有降血糖作用。研究表明三萜类成分、有机酸、黄酮、多酚、多糖、多肽、皂苷、酵素等均具有α-淀粉酶抑制作用[19-20],三萜类成分是具有神经保护潜能的α-淀粉酶抑制剂[20],具有开发为防治糖尿病保健品和药物的前景。阿卡波糖对α-淀粉酶具有强抑制作用,导致未消化的多糖在肠道内聚集,在肠道菌群的作用下放出气体和其他低分子物质,因此服用阿卡波糖常常伴有胃肠胀气和肠鸣音、腹痛、腹胀、腹泻等不良反应[21]。α-淀粉酶抑制剂是有效的降血糖手段,俄色果提取物对α-淀粉酶有明显的抑制作用,但效果不如阿卡波糖,表明俄色果可能在发挥作用的同时也会减少肠道方面的不良反应。汪冬善[22]在对同属植物红玉海棠和湖北海棠的果实降胆固醇作用有效部位筛选时发现氯仿部位明显降低高脂小鼠的空腹血糖,这对俄色果降血糖作用的研究具有一定指导作用。通过测定俄色果各部位三萜类成分和筛选抗氧化和对猪胰-α-淀粉酶活性部位,以期为深入研究俄色果活性化合物,筛选抗氧化和降血糖活性成分奠定基础,今后还需结合动物体内试验研究降血糖效果,以及现代化学和药理知识进一步筛选出明确的活性成分和降血糖作用及其机制。

