基于类黄酮成分的不同品种无花果采收时机及抑癌活性研究
李 晓,邓佳丽,安玉艳,林泽崑,汪良驹,2*
1南京农业大学园艺学院,南京 210095;2青岛海德坤生物科学研究院,青岛 266200
无花果(FicuscaricaL.)属于桑科榕属温带落叶果树,原产于幼发拉底河和底格里斯河流域,是人类驯化最早的栽培果树之一,距今已有1万年以上种植历史[1]。类黄酮类化合物被证实是一种潜在的天然抗氧化剂,具有抑菌、抗肿瘤等作用[2,3]。无花果的根、茎、叶、果均可入药。20世纪50年代Ullman提出,外用无花果乳汁处理动物肠道,能引起大量的毛细血损伤,严重时导致动物死亡;但若经口服,则没有任何毒性[4]。从无花果乳汁中分离出4种活性组分,其中2种组分经皮下注射或者静脉注射,能抑制小鼠移植性肉瘤生长。后续证实,无花果乳汁液能显著抑制小鼠原发性乳腺癌细胞生长,导致癌细胞坏死,延缓移植性腺癌、骨髓性白血病、淋巴肉瘤和肉瘤发生,并引起肉瘤退化[5]。在中国,Wang等[6]首先报道无花果根、茎、叶和果实(包括幼果和成熟果)提取液对S180肉瘤、肺癌、肝癌和艾氏腹水癌均具有明显的抑制活性。他们将无花果水提液供给荷瘤小鼠或癌症病患,均能提高试验对象的免疫功能,因而建议,无花果制剂可以作为一种天然、无毒的辅助性药物,以缓解化疗、放疗患者病痛,提高生活质量。然而,无花果抗癌有效成分却一直未阐明。Takeuchi等[7]最早提出,苯甲醛是无花果抗癌的主要成分。Yin等[8]认为,无花果抗癌是包括香豆素类化合物、苯甲醛和呋喃环类小分子芳环化合物共同作用的结果,苯甲醛只是增效剂或有机活性分子之一。后来发现,无花果多糖具有抗癌活性[9]。但是,多糖物质结构复杂,其与抗肿瘤的关系需要更多探讨。另一方面,类黄酮与抗癌的关系引起大家重视。Sharada等[10]提出,无花果中含有的一种类黄酮物质桑色素(morin)可以抑制1,2-二甲基肼(DMH)诱发的大鼠结肠癌发生。有关这一研究缺乏后续报道。介于无花果品种众多,不同时期成熟的果实叶片可能具有不同功能。为此,本研究于2019年7月至11月间,采集3个无花果品种叶片,分别提取并精制类黄酮,研究不 同月份品种叶片对人体癌细胞增殖的抑制活性,探讨无花果类黄酮的抑癌机理,分析类黄酮物质与抗癌活性的关系,以期为无花果类黄酮在抗癌医药上的应用开发提供理论依据。
1 材料与方法
1.1 材料
本试验所用的无花果(FicuscaricaL.)共有三个品种,即‘布兰瑞克’(Brunswick)、‘玛斯义陶芬’(Masui Dauphine)和‘波姬红’(Bojihong)。其中,前两品种叶片采摘于常州市圣王果蔬有限公司无花果园,‘波姬红’叶片采自南京市浦口区翔辰家庭农场无花果园。从2019年7月至11月份,每个月份采集一次新梢中部成熟叶片。洗净后,在110 ℃烘箱中杀青10 min,在80 ℃条件下烘干,磨碎后过60目筛以备类黄酮提取之用。人肝癌HepG-2细胞购于中国科学院上海生命科学研究院细胞库,胃癌BGC-823和SGC-7901细胞由中国药科大学倪孟祥教授馈赠。
1.2 试验试剂与仪器
1.2.1 试剂
DMEM(Dulbecco’s Modified Eagle Medium)、RPMI(Roswell Park Memorial Institute)培养基、PBS(Phosphate Buffer Solution)、0.25%胰蛋白酶为Hyclone公司产品;胎牛血清(Fatal Bovine Serum,FBS)来自Gibco公司。细胞培养级别二甲亚砜(DMSO)、MTT细胞增殖抑制试剂盒(MTT Cell Proliferation Assay Kit)、Annexin V-FITC/PI凋亡检测试剂盒(Annexin V-FITC/PI Apoptosis Detection Kit)、细胞周期DNA含量检测试剂盒(DNA Content Quantitation Assay-Cell Cycle)、线粒体电位检测试剂盒(JC-1)(Mitochondrial Membrane Potential Assay Kit with JC-1)全部来自北京索莱宝生物科技有限公司,130种酚类标准品由上海鹿明生物科技有限公司提供。
1.2.2 仪器
冷冻干燥机;超声波清洗机;CO2培养箱(Thermo Electron Corporation,MA,USA);倒置显微镜;流式细胞仪(BD Accuri C6 Ⅱ);多功能酶标仪(Cytation 3);高速冷冻离心机;三重四极杆质谱仪(AB Qtrap 6500+);高效液相色谱仪(AB ExionLC)。
1.3 试验方法
1.3.1 类黄酮提取与精制
取不同品种不同月份的无花果叶片粉末各50 g,按照1∶49物液比加入80%乙醇溶液,在70 ℃条件下以420 W功率超声波提取40 min,减压真空抽滤,重复以上操作两次,合并滤液。在真空旋转蒸发仪中旋转蒸发,用冷冻干燥机冻干,得粗黄酮。随后,采用D101型大孔树脂进行静态吸附精制。具体方法为:称取8 g已活化处理的D101型大孔树脂,以60%乙醇溶液按照1∶40物液比溶解1 g上述粗黄酮。在25 ℃恒温摇床中以150 rpm转速浸摇吸附12 h,再用去离子水冲洗吸附后的树脂,去除洗涤水。然后,加入70%乙醇溶液20 mL,再于25 ℃恒温摇床中以150 rpm转速浸摇解析12 h,减压抽滤,旋转蒸发,最后冷冻干燥得到精制类黄酮。
1.3.2 细胞培养
人体肝癌HepG-2细胞培养在含有80%DMEM和20%胎牛血清培养基上,胃癌BGC-823和SGC-7901细胞培养在含有90%RPMI和10%胎牛血清培养基上,置于37 ℃、含5%CO2培养箱。
1.3.3 细胞增殖抑制试验
1.3.3.1 无花果品种和月份类黄酮样品抑癌效应
利用MTT法检测无花果叶片类黄酮对胃癌细胞SGC-7901增殖的抑制效应,比较不同品种和月份叶片的抑癌效率。在对数生长期,将细胞浓度调整为1×105/mL。取100 μL加入到96孔板中,吹打成单细胞,置于培养箱中继续培养4 h至贴壁。弃除上清,加入含有1 mg/mL无花果叶片类黄酮的培养基,继续培养48 h。弃除培养基,加入90 μL新鲜培养基和10 μL MTT溶液(5 mg/mL),再培养4 h。然后弃除孔内溶液,加入110 μL二甲亚砜(DMSO),水平晃动10 min,使晶体充分溶解,在酶标仪490 nm处测定吸光度。抑制癌率=(1 - OD样品/ OD空白)×100%。该试验重复10次以上,取平均值。
1.3.3.2 无花果叶片类黄酮对不同癌细胞株系的抑制效率
以人体肝癌HepG-2细胞、胃癌BGC-823和SGC-7901细胞为材料,利用MTT法检测类黄酮对不同癌细胞系增殖抑制效率,比较不同癌细胞增殖对无花果类黄酮的敏感性。具体方法同“1.3.3.1”。
1.3.3.3 细胞形态观察
介于‘布兰瑞克’无花果8月份叶片类黄酮对SGC-7901细胞增殖的抑制率最高(见结果与分析),本研究用该体系来探讨无花果类黄酮抑癌机理。在细胞形态观察中,将SGC-7901细胞均匀铺在两组6孔板中,用不同浓度类黄酮处理,培养48 h后选择一组加入MTT染色后,分别在倒置光学显微镜下观察两组SGC-7901细胞形态变化。
1.3.3.4 细胞凋亡测定
在SGC-7901细胞对数生长期,将细胞浓度调整为1×105/mL,取2 mL加入6孔板中,吹打均匀,置于培养箱中培养4 h至贴壁。弃除上清液,加入含有不同浓度类黄酮的培养基,继续培养48 h。收集细胞后,用预冷的PBS洗涤,2 000 rpm离心5 min,弃上清。用1 mL Binding Buffer (1×)悬浮细胞,2 000 rpm离心10 min,弃上清。用Binding Buffer重悬细胞,使细胞密度达到1×106个/mL。吸取100 μL重悬细胞,加入5 μL AnnexinV-FITC溶液,暗孵育10 min。加入5 μL碘化丙啶(PI),暗孵育5 min,按照Annexin V-FITC/PI凋亡检测试剂盒说明书,在流式细胞仪上检测细胞凋亡情况。
1.3.3.5 线粒体膜电位测定
参照“1.3.3.4”法收集经不同浓度类黄酮处理的SGC-7901细胞,去除上清,用PBS洗涤2次,再加入1 mL细胞培养液和1 mL JC-1工作液,充分混匀后,在细胞培养箱中孵育20 min。4 ℃下600 g离心5 min,去除上清液。用JC-1染色缓冲液(1×)洗涤2次,再加入适量JC-1染色缓冲液(1×)重悬细胞,按照线粒体电位检测试剂盒(JC-1)说明书,在流式细胞仪上分析无花果叶片类黄酮对SGC-7901细胞线粒体膜电位的影响。
1.3.3.6 细胞周期分析
参照“1.3.3.4”法收集经不同浓度类黄酮处理的SGC-7901细胞。经PBS冲洗两次,用70%预冷乙醇固定过夜;再用PBS洗涤2次,加入500 μL含RNase的碘化丙啶(PI)染色液,在4 ℃下避光孵育30 min,按照细胞周期DNA含量检测试剂盒说明书,在流式细胞仪上检测激发波长为488 nm红色荧光下细胞周期情况。
1.3.3.7 细胞凋亡相关基因表达
参照“1.3.3.4”法收集经不同浓度类黄酮处理的SGC-7901细胞,利用RNA simple Total RNA Kit 试剂盒提取RNA,利用微量分光光度计测定RNA浓度,经琼脂糖凝胶电泳检测RNA18S和26S条带完整性。使用cDNA反转录试剂盒将RNA反转录为cDNA。以此为模板,用qRT-PCR测定p53、Bax、Bcl-2以及与周期相关基因表达量,以GAPDH为内参。引物序列如表1。
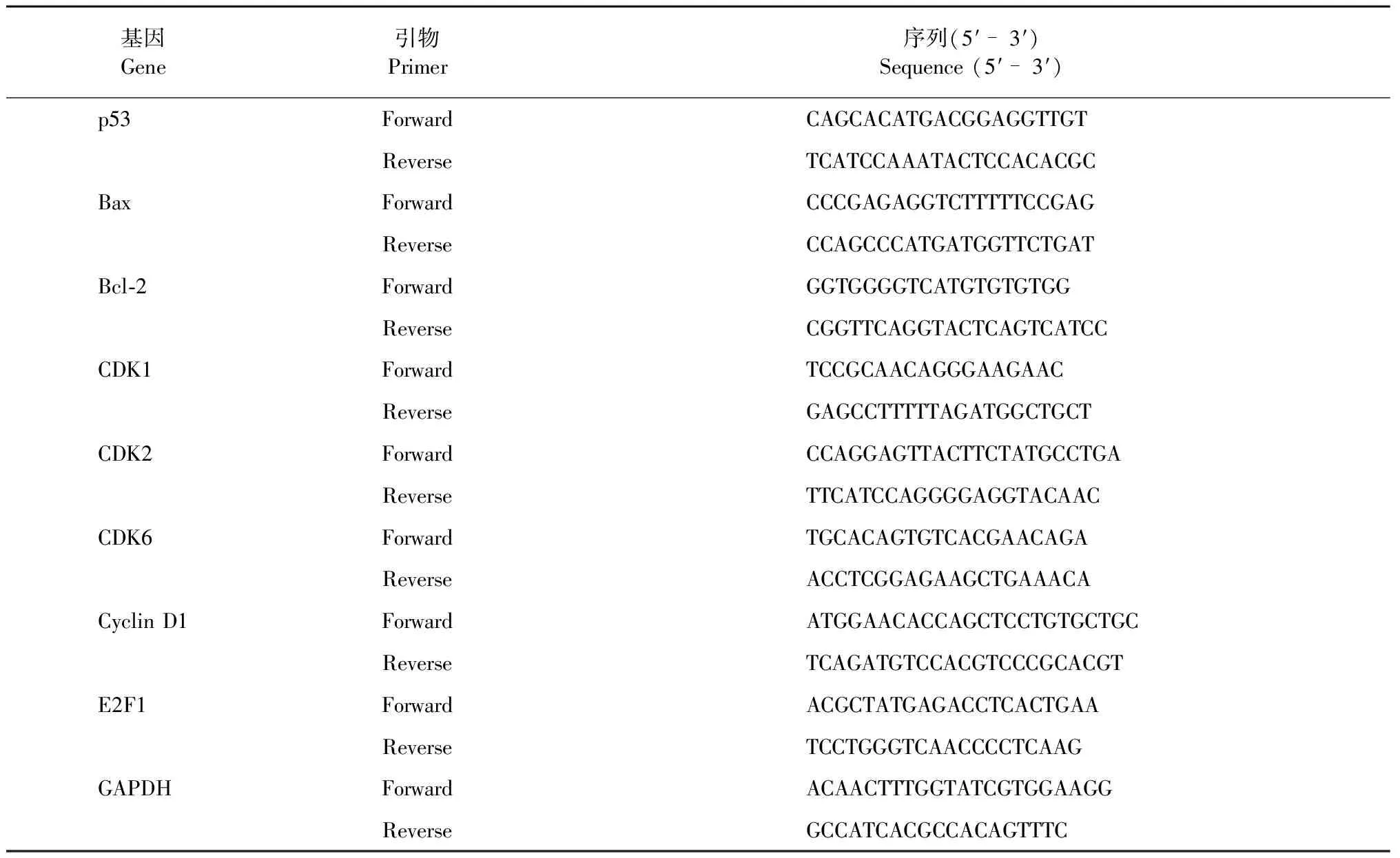
表1 用于RT-qPCR分析的引物序列Table 1 Oligonucleotide sequences for primers used in RT-qPCR
1.3.4 液相色谱串联质谱(LC-MS/MS)法测定黄酮类物质含量
以三种抑癌效率不同的无花果叶片类黄酮为材料,采用UPLC-ESI-MS/MS开展定性定量检测,借以探索与抑癌率相关的无花果黄酮种类。色谱条件:Waters UPLC HSS T3(100 mm× 2.1 mm,1.8 μm)液相色谱柱,流动相A(0.1%甲酸-水溶液),流动相B(乙腈),梯度洗脱,流速为0.3 mL/min,进样量5 μL。分析前,先将130种黄酮类标准品分别用甲醇溶解,制备1 mg/mL母液。梯度稀释后,制作标准曲线并优化质谱条件。无花果叶片样品分析时,用精制后黄酮。根据出峰时间、峰面积和标准曲线,定性定量分析黄酮类代谢物绝对含量。每个样品生物学重复3次。
1.4 数据处理
所有数据均为重复3次以上试验的平均值。经单因素或双因素方差分析和Duncan氏显著性测验。当P< 0.05时,认为差异显著;当P< 0.01时,认为差异极显著。
2 结果与分析
2.1 无花果叶片类黄酮对癌细胞增殖的抑制效应
表2为添加1 000 μg/mL无花果类黄酮对人体胃癌SGC-7901细胞增殖抑制率。从中可以看出,除了‘布兰瑞克’8月份叶片的抑癌率达39.24%外,其他月份以及其他两个品种‘玛斯义陶芬’和‘波姬红’叶片类黄酮的抑癌率均相当低,甚至为负值,表明并非所有品种月份无花果叶片类黄酮都有抑癌活性。

表2 不同品种月份无花果叶片类黄酮对人体胃癌SGC-7901细胞增殖抑制效率Table 2 The inhibitory efficiency of flavonoids of fig leaves of different cultivars harvested indifferent months on the proliferation of human gastric cancer SGC-7901 cells
介于8月份采集的‘布兰瑞克’无花果叶片类黄酮对人体胃癌SGC-7901细胞具有明显的抑癌活性,我们以此为材料,利用MTT法测定了它对三种癌细胞系,包括肝癌细胞Hepg-2、胃癌细胞SGC-7901和BGC-823增殖抑制的浓度效应,结果如图1。从中可以看出,在100~1 600 μg/mL浓度范围内,无花果类黄酮对3种癌细胞的抑制率均随着浓度增加而迅速上升。当浓度为1 600 μg/mL时,无花果叶片类黄酮对肝癌Hepg-2细胞抑制率为21.93%,对胃癌SGC-7901细胞抑制率为86.65%,对胃癌BGC-823细胞抑制率为26.31%。显然,无花果叶类黄酮对胃癌SGC-7901细胞抑制率最高,而对其他两种癌细胞的抑制率均低于30%。

图1 8月份采集的‘布兰瑞克’无花果叶片类黄酮对不同癌细胞增殖的抑制效应Fig.1 The inhibitory effect of flavonoids from ‘Brunswick’ fig leaves harvested in August on the proliferation of different lines of cancer cells注:图中相同小写字母代表在P = 0.05水平上差异不显著。Note:The same lowercases in a figure indicate no significant difference at P = 0.05 level.
图2显示的是倒置显微镜中观察到的8月份采集的布兰瑞克无花果叶片类黄酮对人体胃癌SGC-7901细胞增殖的抑制情况。从中可以看出,无论是否经MTT染色,癌细胞数量均随无花果类黄酮浓度增加而迅速下降,细胞松散,逐渐萎缩死亡。MTT染色可以提高这一效应的可视性,因为MTT可以被活细胞线粒体脱氢酶还原生成深紫色结晶体,颜色越深,表明活细胞数量越多。从图2可以看出,随着无花果叶类黄酮浓度的提高,SGC-7901细胞颜色逐渐变浅,细胞数量迅速下降。当类黄酮浓度达1 600 μg/mL时,几乎见不到能被染色的活细胞。表明,无花果叶片类黄酮处理对胃癌SGC-7901细胞增殖有显著抑制效应。
2.2 无花果叶片类黄酮诱导SGC-7901细胞凋亡效应
图3为不同浓度无花果叶片类黄酮处理诱发人体胃病SGC-7901细胞凋亡的流式细胞仪检测结果。其中,A图由6个小图组成,每一个小图有4个象限。Q1为裸核细胞,Q2为凋亡晚期细胞或已经坏死的细胞,Q3为处于凋亡早期的可逆性细胞,Q4为活细胞。B图是多次重复测试后获得的不同类型细胞百分率。从中可以看出,正常培养条件下,92.83%为活细胞。随着无花果类黄酮浓度增加,活细胞数量直线下降。其回归方程y= -0.045 7x+ 76.381,相关系数r= -0.910 1*。由此计算出无花果类黄酮对SGC-7901细胞的半致死浓度IC50为577.26 μg/mL。另一方面,正常培养条件下凋亡早期和凋亡晚期的细胞很少,两者总共只有5.26%。当无花果叶类黄酮浓度为100 μg/mL时,凋亡细胞总数升为13.26%。当无花果叶类黄酮浓度达到1 600 μg/mL时,凋亡细胞总数升为83.6%,其中凋亡早期细胞为24.1%,凋亡晚期细胞为59.5%。以上结果再次证明,无花果叶片类黄酮以剂量依赖方式促进人体胃癌SGC-7901细胞凋亡。

图3 不同浓度无花果类黄酮处理对人体胃癌SGC-7901细胞凋亡的影响Fig.3 Effects of fig flavonoids in different concentrations on apoptosis of human gastric cancer SGC-7901注:A:流式细胞仪照片;B:不同凋亡时期细胞百分数。图中相同字母代表在P = 0.05水平上差异不显著。Note:A:Photos of flow cytometry.B:Percentage of apoptotic cells at different stages.The same letters in the figure represent no significant difference at P = 0.05 level.
2.3 无花果叶片类黄酮对SGC-7901细胞线粒体膜电位的影响
JC-1是一种特殊的荧光染料。它在细胞线粒体外能产生红色荧光。当线粒体膜电位下降时,它可以进入线粒体,荧光则由红色转变为绿色。因而,JC-1可以作为分子探针,特异性地检测线粒体膜电位变化。如图4,未经类黄酮处理的人体胃癌SGC-7901细胞红色荧光强度为97.9%,100 μg/mL类黄酮处理对此没有明显影响。当类黄酮浓度达200 μg/mL时,红色荧光显著下降(P< 0.05)。以后,随着类黄酮浓度上升,红色荧光强度迅速下降。当类黄酮浓度为1 600 μg/mL时,红色荧光降低到3.9%。与此相反的是,绿色荧光强度随着类黄酮浓度上升而上升。当类黄酮浓度为1 600 μg/mL时,绿色荧光上升至96.07%。红色荧光与绿色荧光的比值从对照的47.68%到下降到0.04%。这些结果表明,200 μg/mL以上浓度的无花果叶片类黄酮处理显著降低SGC-7901细胞线粒体膜电位。
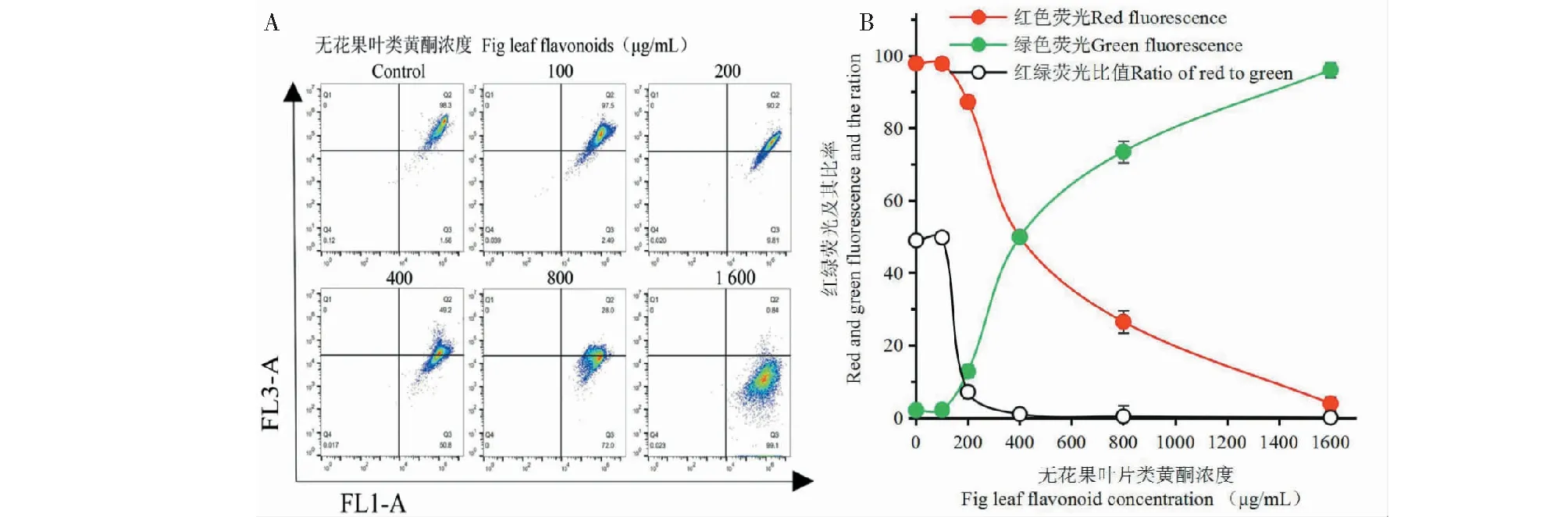
图4 不同浓度的无花果类黄酮处理对人体胃癌SGC-7901细胞线粒体膜电位的影响Fig.4 Effects of fig leaf flavonoids at different concentrations on mitochondrial membrane potential of human gastric cells SGC-7901注:A:流式细胞仪JC-1检测结果;B:红绿荧光比值。Note:A:Images from flow cytometer.B:Red and green fluorescence and their ratio which present mitochondrial membrane potential.
2.4 无花果叶片类黄酮对SGC-7901细胞周期的影响
图5展示的是无花果叶类黄酮对人体胃癌SGC-7901细胞周期的影响。其中,G1为DNA复制前期,主要合成与DNA复制有关的RNA、结构蛋白以及酶蛋白等;S为DNA复制期,它不仅复制DNA,导致DNA加倍,而且合成与DNA组装构成染色质等有关的组蛋白;G2为DNA复制后期,主要负责染色体浓缩以及形成有丝分裂所需的成分。从图5B可以看出,G1期细胞比例随着无花果叶片类黄酮浓度增加逐渐下降。当浓度为400 μg/mL时,G1细胞仅为对照的52.56%,差异达到极显著水平。与此同时,S期细胞比例极显著增加,处理组比对照高出47.98%。类似地,G2期细胞比例也明显增加。当类黄酮浓度达1 600 μg/mL时,处理组G2细胞比例比对照高出77.58%。以上结果说明,无花果叶类黄酮对SGC-7901细胞G1期没有阻滞效应,但显著抑制DNA复制,导致S期细胞比例显著增加。同时,G2期细胞比例也有显著提高。由于细胞周期受阻于S期和G2期,细胞增殖停滞,同时逐渐凋亡。

图5 不同浓度无花果叶片类黄酮对人体胃癌SGC-7901细胞周期的影响Fig.5 Effects of fig leaf flavonoids in different concentrations on the cell cycle of human gastric cancer SGC-7901注:A:流式细胞仪检测出的细胞周期图;B:细胞周期不同阶段细胞所占比百分数。图中相同字母代表在P = 0.05水平上差异不显著。 Note:A:Images of cell cycles by flow cytometer;B:Cell percentage at different stages of cell cycles.The same letters in the figure represent no significant difference at P = 0.05 level.
2.5 无花果叶片类黄酮对SGC-7901细胞凋亡相关基因表达的影响
为了在mRNA水平上阐明无花果叶类黄酮抑制SGC-7901细胞增殖机理,本试验采用qRT-PCR技术检测了细胞凋亡相关基因的相对表达量,如图6A。促凋亡基因Bax在SGC-7901细胞内的相对表达量随无花果叶类黄酮浓度的升高而上升。当类黄酮浓度达到400 μg/mL后,Bax相对表达量与对照间达到显著差异(P< 0.05)。类似地,抑癌基因p53表达也表现出上调趋势,但类黄酮浓度低于400 μg/mL时,其差异未达到P= 0.05的显著水平;当类黄酮浓度达800 μg/mL时,p53相对表达量比对照高出1.89倍(P< 0.05);1 600 μg/mL时,高出4.24倍,说明一定浓度无花果叶类黄酮处理显著上调p53表达。与此相反,抑凋基因Bcl-2相对表达量随着类黄酮浓度的升高而下降。这种效应在无花果叶类黄酮浓度为100 μg/mL时就显著存在(P< 0.05);当浓度为1 600 μg/mL时,Bcl-2相对表达量仅为对照的16%,说明无花果叶类黄酮处理显著抑制抑凋基因Bcl-2表达。

图6 不同浓度无花果叶类黄酮处理对SGC-7901细胞基因表达的影响Fig.6 Effect of fig leaf flavonoids in different concentrations on the gene expressions of SGC-7901 cells注:A:细胞凋亡相关基因;B:细胞周期相关基因。同一基因相同字母代表在P = 0.05水平上差异不显著。Note:A:Apoptosis-related genes;B:Cell cycle-related genes.The same letters in a gene represent no significant difference at P = 0.05 level.
CDK1、CDK2和CDK6为细胞周期蛋白依赖激酶(Cyclin-dependent kinase,CDKs)编码基因。从图6B可以看出,随类黄酮浓度升高,CDK1、CDK2和CDK6相对表达量均呈下降趋势。就CDK1、CDK6而言,类黄酮浓度低于400 μg/mL时,效果不显著(P> 0.05);当类黄酮浓度上升为800 μg/mL时,CDK1和CDK6的相对表达量仅为对照的30%左右,达到P= 0.05显著水平。CDK2相对表达量对类黄酮浓度更敏感。当类黄酮浓度为200 μg/mL时,相对表达量降至对照的82.62%(P< 0.05)。此后,随着类黄酮浓度升高,表达量进一步下降。当类黄酮浓度为1 600 μg/mL时,处理仅为对照的11.34%。Cyclin D1为细胞周期蛋白(Cyclins)编码基因。与CDKs类似,Cyclin D1的表达量随无花果叶类黄酮处理浓度的升高而呈降低。当类黄酮浓度上升为800 μg/mL时,差异达到P= 0.05显著水平;当浓度为1 600 μg/mL时,处理仅为对照的8.94%。另一方面,从图6B可知,无花果叶类黄酮促进E2F1基因表达。这种效应在类黄酮浓度为1 600 μg/mL时显著存在(P< 0.05),相对表达量约为对照的2倍。以上结果说明,无花果叶类黄酮显著降低SGC-7901细胞周期相关基因CDKs和Cyclin D1表达,同时促进E2F1表达。
2.6 液相色谱串联质谱(LC-MS/MS)定性定量测定黄酮类物质种类与含量
为了探讨无花果叶片类黄酮抑制SGC-7901细胞增殖效应的活性成分,根据表2结果,我们选取抑癌率不同的3组类黄酮,即‘布兰瑞克’8月、‘玛斯义陶芬’9月和‘波姬红’9月,利用LC-MS/MS技术定性定量测定类黄酮成分和含量,其中图7展示的是130种标准品的总离子流图。从中可以看出,每个标样出峰清晰,3次进样的出峰时间重叠,说明检测条件良好且稳定。另外,每个样品的标准曲线相关系数均在0.998以上(数据未列出),可以用于定量检测。

图7 标品总离子流图Fig.7 Total ion flow diagram of standards
3组样品各3次重复共检测出60种类黄酮物质(资料未列出),其总量分别为714.75、636.45和505.69 μg/mL。它们与抑癌率呈正相关关系,但相关系数未达到P= 0.05显著水平。以单个物质含量与抑癌率做相关分析,共有11种含量与抑癌率的相关关系达到P= 0.05显著水平(表3)。其中,2.6-二羟基苯甲酸、香草乙酮为苯丙类,芥子酸、单咖啡酰酒石酸为苯丙素类,其余均为黄酮类物质。无花果叶片中特有的桑色素(morin)含量与抗癌率相关系数的P= 0.08,虽然未达到但很接近0.05显著水平,所以也列入表中。从表3可得,水仙苷含量与无花果类黄酮抑癌率相关系数达0.999 9以上(P< 0.01);2.6-二羟基苯甲酸、紫云英苷、香草乙酮、氯化矢车菊素-3-O-芸香糖苷、表儿茶素、异荭草苷、烟花苷、芥子酸、单咖啡酰酒石酸和金丝桃苷含量与无花果类黄酮抑癌率均呈显著相关关系(P< 0.05)。这些结果为后续抗癌活性物质鉴定提供了依据。
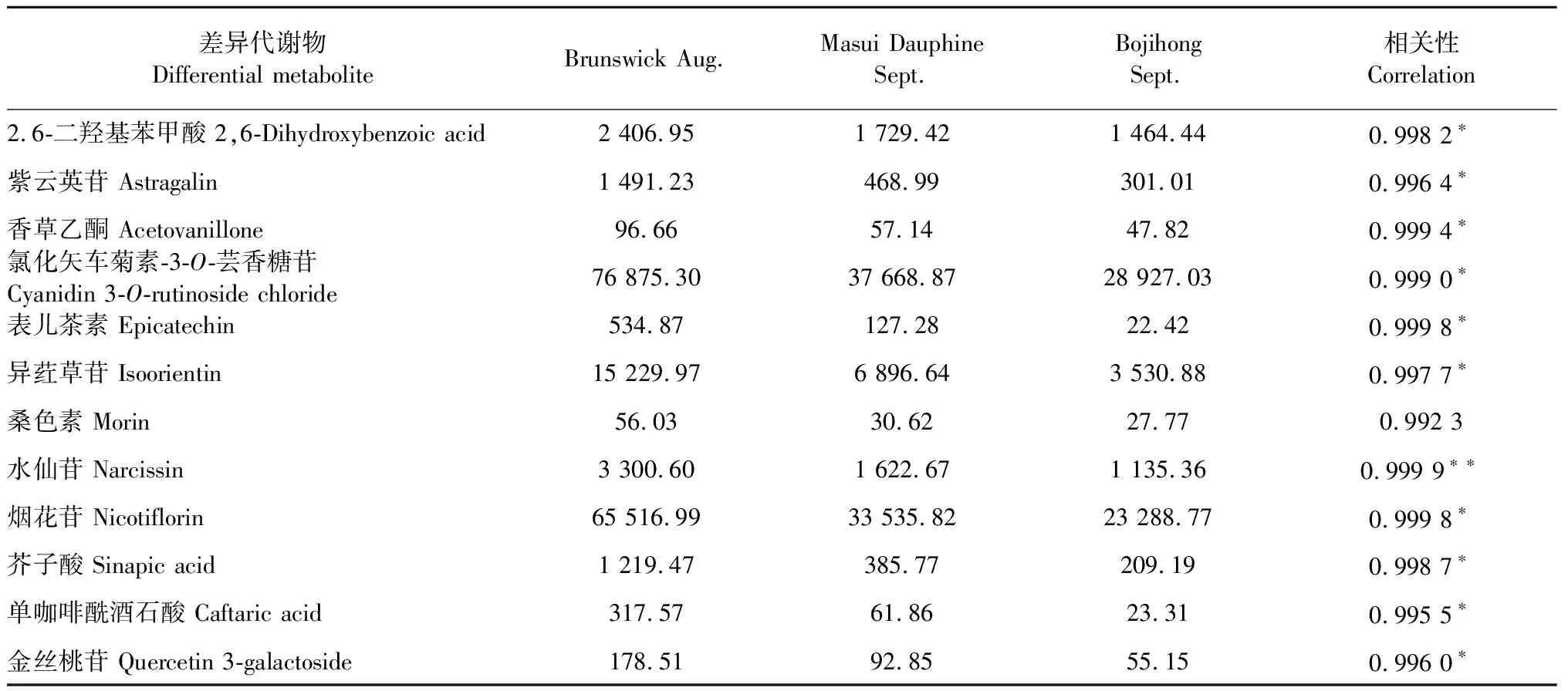
表3 三种无花果叶差异代谢物含量及与抑癌率相关性Table 3 Correlation between different metabolite content and anti-cancer efficiency of three kinds of fig leaves
3 讨论
类黄酮是两个苯环通过三个碳原子相互连接而成的一系列化合物的总称,具有C6-C3-C6结构,难溶或不溶于水,易溶于甲醇、乙醇、乙酸乙酯等有机溶剂。因此,无花果醇类提取液,甚至无花果酒中都含有一定量的类黄酮,并且具有抑癌活性[11]。在抗肿瘤方面,Bai等[12]利用无花果乙醇提取物腹腔注射荷S180实体瘤小鼠,发现对肉瘤生长有明显的抑制作用,并增加脏器指数,增强T淋巴细胞百分数,暗示着无花果乙醇提物可能通过增强荷瘤小鼠免疫功能起到抗肿瘤效果。这是无花果类黄酮抑制动物肿瘤的最早报道。本试验中,我们观察到无花果叶片类黄酮对人体胃癌细胞SGC-7901细胞增殖有显著抑制活性,但是,对胃癌BGC-823和肝癌Hepg-2细胞增殖效应却相对较低(见图1)。从不同品种月份采集的叶片提取出的类黄酮抑癌效应上看,‘布兰瑞克’8月份叶片对SGC-7901细胞抑制率最高,其他品种以及月份叶片类黄酮的抑制率均比较低(见表2)。似乎只有特定品种和特定月份的无花果叶片类黄酮对特定肿瘤细胞增殖才有显著效应。有人提出,蝉花虫草醇提液对癌细胞增殖的抑制率也是SGC-7901最高[13]。本试验结果与此相似。随着无花果叶片类黄酮浓度增加,胃癌SGC-7901细胞数目减少,变短皱缩,逐渐脱离细胞板,其抑制作用呈剂量效应(见图2)。这为无花果叶片的采收时机确定及类黄酮抑癌功效开发提供了理论依据。
我们首次利用流式细胞仪观察无花果叶片类黄酮诱导细胞凋亡(见图3)。在类黄酮浓度为200 μg/mL时,细胞总凋亡率为39.08%;当浓度达1 600 μg/mL时,总凋亡率达83.60%。据此计算出无花果类黄酮对SGC-7901细胞半致死浓度为577.25 μg/mL。这与Purnamasari等[14]提出的无花果甲醇提取液对肝癌细胞Huh7it半抑制浓度为653 μg/mL相似。他们发现,无花果叶片甲醇提取液能抑制肝癌细胞增殖,促进凋亡,导致细胞坏死。细胞凋亡涉及一系列基因的激活、表达和调控,主要包括内源性线粒体途径和外源性死亡受体调节途径[15]。细胞线粒体膜电位下降是线粒体依赖性凋亡早期的一个标志性事件[16]。García-Zepeda等[17]证明,白藜芦醇诱导宫颈癌细胞系的线粒体膜电位降低,促进癌细胞凋亡。本试验观察到,无花果类黄酮降低人体胃癌SGC-7901细胞线粒体膜电位水平(见图4)。这表明无花果叶片类黄酮通过诱导SGC-7901细胞线粒体膜电位水平降低,促进细胞凋亡。
我们还观察了无花果叶片类黄酮对癌细胞周期的抑制效应,发现它将SGC-7901细胞有丝分裂主要阻滞在S期,也有部分在G2期(见图5)。曾报道,辣椒素能将子宫内膜癌细胞阻滞于S期,并引起凋亡率升高[18]。据研究,辣椒素抑癌机理在于抑制细胞周期依赖性蛋白激酶CDK2、CDK4、CDK6蛋白表达[19]。人工合成的黄酮类氨基酸衍生物也能使MGC-803胃癌细胞周期受阻于G2/M期,同时下调抗凋亡蛋白Bcl-2表达,上调促凋亡蛋白Bax表达,从而引发细胞凋亡[20]。本试验在mRNA水平上分析无花果类黄酮抑制SGC-7901细胞凋亡机理。我们发现,经无花果叶类黄酮处理的SGC-7901细胞CDK1、CDK2、CDK6和Cyclin D1基因表达显著下降,E2F1表达升高(见图6B)。在多种肿瘤组织中,CDKs都处于异常活化状态[21],抑制CDKs表达便能抑制肿瘤无序增殖。此外,无花果叶类黄酮处理还影响到抑癌基因P53和Bax以及促癌基因Bcl-2的表达(见图6A)。这三个基因中,Bax与Bcl-2属于同一基因家族,其中,Bcl-2促进细胞周期,而Bax与Bcl-2形成蛋白二聚体,拮抗后者活性,抑制细胞周期,引起细胞凋亡[22]。据报道,天山雪莲类黄酮可导致人食管癌细胞CaEs-17 Bax表达量上调,Bcl-2表达量下调,从而诱导细胞凋亡[23]。我们观察到的无花果叶类黄酮促进抑癌基因P53和Bax表达,抑制促癌基因Bcl-2表达。这说明,无花果叶类黄酮对胃癌细胞SGC-7901的凋亡诱导作用可能是通过调节凋亡相关基因Bax、P53和Bcl-2的表达来实现的。
为挖掘无花果叶类黄酮抑制胃癌SGC-7901细胞增殖效应的具体活性成分,根据不同品种不同月份无花果叶片类黄酮对人体胃癌SGC-7901细胞增殖抑制效率不同,我们选取三个(‘布兰瑞克’8月、‘玛斯义陶芬’9月、‘波姬红’9月)样品进行LC-MS/MS定性定量分析。经筛选,获得12种与抑癌率高度相关的差异代谢物(见表3)。其中,水仙苷与无花果类黄酮抑癌率呈极显著正相关。曾报道,水仙苷具有抗病毒活性,还对阿尔茨海默症、Ⅱ型糖尿病、帕金森症等蛋白构象病的防治具有重要意义[24]。最近有人提出,水仙苷可以用于防治新冠病毒[25]。但是,它是否具有抑癌效应还有待研究。表3结果还表明,异荭草苷与无花果类黄酮抑癌率呈显著相关关系。有人报道,异荭草苷能够显著抑制胶质瘤组织miR-23a表达,从而抑制癌细胞增殖[26]。因而,无花果叶片异荭草苷与抗肿瘤的关系值得深入研究。第三,桑色素能够抑制肿瘤细胞生长[10],且发生在细胞周期的S期[27]。但也有人认为,阻滞发生在G2/M期[28]。本研究也检测出桑色素的存在,而且其含量与抗癌率的相关系数r= 0.9923,P= 0.08。虽然未达到0.05水平,但非常接近。而且,我们观察到无花果叶片类黄酮抑制SGC-7901细胞周期效应在S期。这与前人[27]结果类似。由于无花果属于桑科榕属,这种黄酮物质是否与无花果抗癌活性有关,值得深入研究。此外,我们还观察到2.6-二羟基苯甲酸、香草乙酮、氯化矢车菊素-3-O-芸香糖苷、烟花苷、表儿茶素、芥子酸等含量与无花果类黄酮抑癌率呈显著相关关系(表3)。曾报道,儿茶素对人体肝癌有抑制效应[29]。但是,本试验中,我们观察到无花果叶片类黄酮对肝癌HepG-2的抑制效应比较低(见图1),因而推测,它对SGC-7901的抑制效应可能与表儿茶素无关。其他几种代谢物与抑癌效应的关系目前很少见报道。
综上所述,本文首先分析了‘布兰瑞克’、‘玛斯义陶芬’和‘波姬红’等3个品种叶片在7月到11月份间的类黄酮对不同癌细胞株增殖的抑制效率,发现‘布兰瑞克’无花果品种8月份叶片类黄酮对SGC-7901胃癌的抑制率最高。随着类黄酮浓度上升,癌细胞密度和粘附性下降,活细胞减少,死亡细胞和凋亡晚期细胞比例上升。抑癌机理研究表明,无花果叶类黄酮将细胞周期阻滞在S期以及少量的G2期,细胞线粒体膜电位明显下降,促细胞凋亡基因Bax和p53、细胞周期调控基因E1F2表达量显著上升,抗凋亡基因Bcl-2以及细胞周期相关基因Cyclin D1和CDKs表达量显著下降。这些都是无花果叶类黄酮促进癌细胞凋亡的重要机制。此外,借助于LC-MS/MS技术和相关分析,我们筛选得到水仙苷、异荭草苷、桑色素等几种与抑癌率高度相关的差异代谢物。这为后续无花果叶片抗癌药物开发开辟了新视野。

