终末期肾病病人骨桥蛋白水平与冠状动脉钙化相关性
范娟 高升波 魏玉娇 周燕 王明秋 马瑞霞

[摘要] 目的 探讨终末期肾病(ESRD)病人血清骨桥蛋白(OPN)水平与冠状动脉钙化的相关性。方法 选取2016年1月—2019年12月在青岛大学附属医院接受冠状动脉造影和血管内超声(IVUS)检查的ESRD病人48例。按照冠状动脉钙化指数(CalcIndex)分为无钙化组、轻度钙化组(CalcIndex≤0.14)和重度钙化组(CalcIndex>0.14)。比较各组临床资料,包括性别、年龄、透析龄、体质量指数(BMI)、既往史(高血压病史、糖尿病病史、吸烟史和服用钙剂史)以及C反应蛋白(CRP)、糖化血红蛋白、血磷、血钙、甲状旁腺激素(iPTH)和碱性磷酸酶(ALP)等实验室指标,分析OPN水平与钙磷相关参数的相关性;采用非条件Logistic回归分析冠状动脉钙化的危险因素;采用受试者工作特征(ROC)曲线评价OPN在冠状动脉钙化诊断中的价值。结果 与轻度钙化组相比,重度钙化组病人的年龄、透析龄、高血压病史、糖尿病病史、服用钙剂史、CRP、糖化血红蛋白、血磷、iPTH、钙磷乘积和ALP水平显著增高,差异均有统计学意义(F=3.47~6.48,χ2=3.19~3.28,H=4.32~6.43,P<0.05)。随着冠状动脉钙化程度的加重,ESRD病人血清OPN水平显著升高,差异有统计学意义(F=6.54,P<0.05)。ESRD病人血清OPN水平与血磷、钙磷乘积、iPTH以及ALP均呈正相关(r=0.201~0.399,P<0.05),而与血钙无相关性。Logistic回归分析显示,透析龄、血磷、iPTH、钙磷乘积和血清OPN水平是ESRD病人发生冠状动脉钙化的独立危险因素。ROC曲线分析显示,血清OPN水平诊断冠状动脉钙化的曲线下面积为0.947(95%CI=0.882~0.981,P<0.01),當检测的截点为81.73 ng/L时,其诊断灵敏度和特异度分别为72.5%和75.9%。结论 伴有冠状动脉钙化的ESRD病人血清OPN水平显著升高,血清OPN水平是ESRD病人发生冠状动脉钙化的独立危险因素,可作为反映冠状动脉钙化的潜在生物学标志物。
[关键词] 肾功能衰竭,慢性;骨桥蛋白质;冠状血管;血管钙化;生物标记
[中图分类号] R692.5
[文献标志码] A
[文章编号] 2096-5532(2021)04-0517-05
慢性肾脏病(CKD)病人,尤其是终末期肾病(ESRD)病人,作为一类特殊的人群,其心血管疾病、心血管事件以及全因死亡率显著增加[1]。越来越多的证据表明,冠状动脉疾病是引起心血管事件以及全因死亡率增加的重要机制之一[2]。冠状动脉钙化作为冠状动脉疾病关键的病理改变,与动脉粥样硬化密切相关,是心血管事件发生的独立危险因素[3]。有研究表明,CKD病人冠状动脉钙化发生率高达76.5%,且伴冠状动脉钙化病人疾病进展快,预后差[4]。因此,探讨CKD疾病背景下的冠状动脉钙化病理生理过程具有十分重要的临床意义。
血管内超声(IVUS)可实时显示冠状动脉管腔、管壁成像,以及动脉粥样硬化斑块的大小、组成成分和分布,精确评估冠状动脉病变情况[5]。骨桥蛋白(OPN)是一种小分子整合素结合配体(N-连接糖蛋白),主要表达于血管细胞和多种免疫细胞,可桥连细胞和基质无机物,在包括血管钙化在内的众多病理生理过程中起至关重要的作用[6-7]。本研究通过IVUS评估冠状动脉钙化情况,探讨ESRD病人血清OPN水平与冠状动脉钙化的关系,为指导其临床诊断和治疗提供理论依据。
1 资料与方法
1.1 研究对象
2016年1月—2019年12月,选取在青岛大学附属医院血液净化中心接受冠状动脉造影和IVUS检查的维持性血液透析和维持性腹膜透析病人48例。排除标准:①严重感染者;②冠状动脉支架植入术后支架再狭窄者;③有冠状动脉旁路移植手术史者;④近半年长期服用影响骨代谢药物病人。入选病人的透析时间均大于6个月。血液透析方案:每周规律血液透析3次,每次4 h;腹膜透析方案:日间非卧床腹膜透析(CAPD)。按照冠状动脉钙化指数(CalcIndex)再将病人分为无钙化组、轻度钙化组(CalcIndex≤0.14)以及重度钙化组(CalcIndex>0.14)[8-9]。本研究经青岛大学附属医院伦理委员会批准,所有病人均签署知情同意书。
1.2 研究方法
1.2.1 资料收集 收集研究对象的临床资料,包括性别、年龄、体质量指数(BMI)、透析龄、既往史(高血压病史、糖尿病病史、吸烟史和服用钙剂史)以及血红蛋白(Hb)、清蛋白(ALB)、三酰甘油(TG)、胆固醇(CH)、低密度脂蛋白(LDL)、高密度脂蛋白(HDL)、尿酸(UA)、C-反应蛋白(CRP)、糖化血红蛋白(HbA1C)、血磷、血钙、碱性磷酸酶(ALP)、甲状旁腺激素(iPTH)等实验室指标。计算钙磷乘积;当ALB低于40 g/L时对血钙进行校正,校正公式为:校正血钙=测量血钙值+(40-ALB)×0.02。
1.2.2 OPN测定 所有研究对象均于入院第2天晨起空腹采集肘静脉血5 mL(标本采集过程避免溶血),置于生化管内,在4 ℃下以3 000 r/min离心10 min,小心吸取上清液置于EP管内,-80 ℃保存待测。应用酶联免疫吸附试验(ELISA)方法检测血清中OPN水平。所用试剂盒为人OPN ELISA试剂盒(abcam公司,ab100618),严格按照说明书进行操作。
1.2.3 IVUS检查 经桡动脉或股动脉置入6F指引导管至冠状动脉口,送入经皮冠状动脉腔内血管成形术导丝至冠状动脉远端,将超声导管(应用美国Boston Scientific Lab IVUS诊断仪)沿此导丝送至病变的远端,然后使用机械回撤装置以0.5 mm/s速度自动回撤超声导管,同时进行超声检测。根据美国心脏病学会和欧洲心脏病协会冠状动脉IVUS的检测指南进行检测。检测指标包括:钙化位置、最大钙化弧、总钙化弧、对向管腔壁至钙化边缘距离、管腔面积、最大管腔直径、最小管腔直径、平均管腔直径及管腔偏心指数等。采用QIvus iMap Basic Viewer软件,于心脏舒张末期、最狭窄血管横截面进行定量分析。根据IVUS检查结果,计算CalcIndex,CalcIndex=病变段钙化长度/(病变总长度×最大钙化角度/360°)。
1.3 统计学方法
采用SPSS 20.0软件进行统计学分析。正态分布的计量资料以X2±s形式表示,符合方差齐性者整体检验采用单因素方差分析,组间两两比较采用SNK法;非正态分布的计量资料以中位数以及四分位数(M(P25,P75))表示,整体检验采用Kruskal-Wallis H检验,组间两两比较采用Nemenyi检验。计数资料以例数和百分数表示,整体检验采用卡方检验,组间比较采用Bonferroni校正法。正态分布的计量资料相关性检验采用Pearson相关分析,非正态分布计量资料相关性检验采用Spearman相关分析。采用非条件Logistic回归分析冠状动脉钙化的危险因素。采用受试者工作特征(ROC)曲线评价血清OPN水平在冠状动脉钙化诊断中的价值。所有假设检验置信水平均为α=0.05。
2 结 果
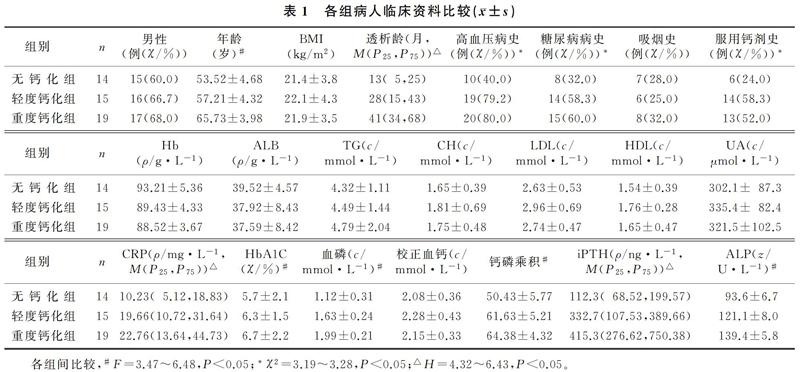
2.1 各组临床资料比较
随着ESRD病人冠状动脉钙化的加重,年龄、透析龄、高血压病史、糖尿病病史、服用钙剂史、CRP、HbA1C、血磷、iPTH、钙磷乘积和ALP水平显著增高,差异均有统计学意义(F=3.47~6.48,χ2=3.19~3.28,H=4.32~6.43,P<0.05);各组性别、BMI、吸烟史、Hb、ALB、血脂、UA以及校正血钙比较差异无显著性(P>0.05)。见表1。
2.2 各组血清OPN水平比较
无钙化组、轻度钙化组和重度钙化组的血清OPN水平分别为(61.45±8.28)、(81.73±11.97)和(128.28±23.92)μg/L,3組比较差异具有统计学意义(F=6.54,P<0.01)。轻度钙化组和重度钙化组血清OPN水平显著高于无钙化组(q=4.15、6.77,P<0.01),重度钙化组显著高于轻度钙化组(q=5.43,P<0.01)。
2.3 ESRD病人OPN水平与钙磷相关参数相关性
Pearson或Spearman相关分析显示,ESRD病人血清OPN水平与血磷(r=0.399,P<0.05)、钙磷乘积(r=0.298,P<0.05)、iPTH(r=0.328,P<0.05)以及ALP(r=0.201,P<0.05)均呈正相关,而与血钙(r=0.104,P>0.05)无相关性。
2.4 ESRD病人发生冠状动脉钙化的危险因素
以性别、年龄、透析龄、BMI、高血压病史、糖尿病病史、吸烟史、服用钙剂史以及TG、CH、LDL、HDL、CRP、Hb、UA、ALB、HbA1C、血磷、校正血钙、iPTH、钙磷乘积、ALP和OPN水平等作为自变量,进行非条件Logistic回归分析,分析结果显示,透析龄、血磷、iPTH、钙磷乘积和血清OPN水平是ESRD病人发生冠状动脉钙化的独立危险因素。见表2。
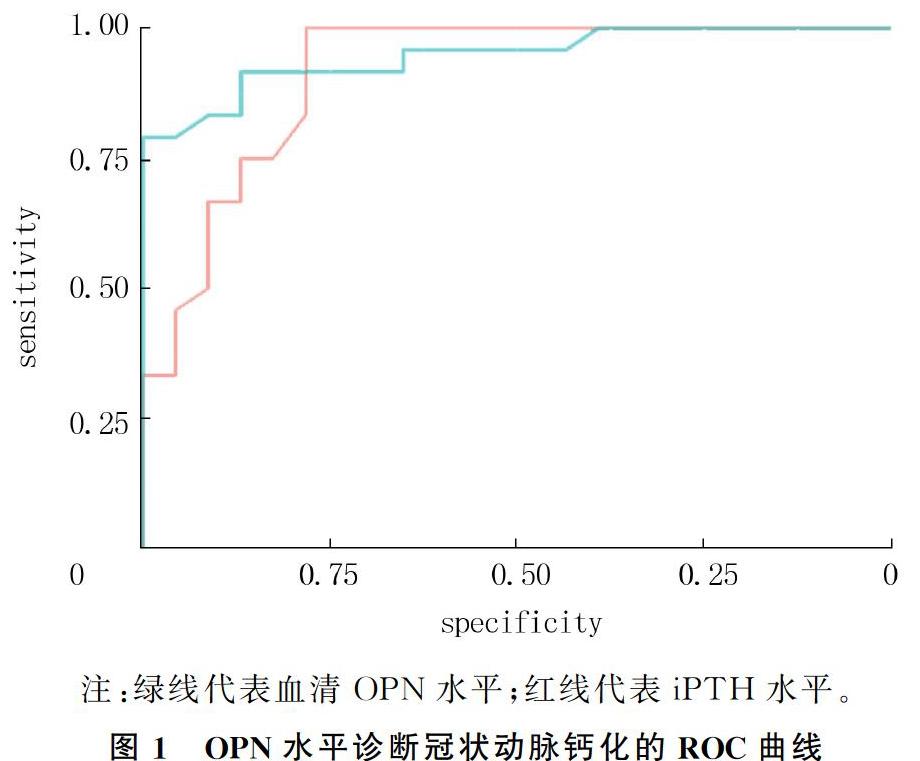
2.5 血清OPN水平在ESRD病人冠状动脉钙化诊断中的价值
ROC曲线分析显示,血清OPN水平诊断冠状动脉钙化的曲线下面积为0.947(95%CI=0.882~0.981,P<0.01),当检测值的截点为81.73 ng/L时,其诊断灵敏度和特异度分别为72.5%和75.9%。见图1。
3 讨 论
血管钙化是CKD病人血管病变最常见的表现,亦是心血管事件发生的独立危险因素。研究表明,OPN在血管钙化发生过程中发挥至关重要的作用,但其在ESRD透析病人冠状动脉钙化中的作用尚不明确。本研究结果显示,伴有冠状动脉钙化的ESRD透析病人血清OPN表达水平较无冠状动脉钙化者显著升高,而且OPN表达水平随冠状动脉钙化程度的加重而升高。进一步研究结果显示,血清OPN水平与血磷、钙磷乘积、iPTH以及ALP有着显著的相关性,而且是ESRD病人发生冠状动脉钙化的独立危险因素,可以作为反映ESRD病人冠状动脉钙化的有效标志物。因此,本研究对早发现、早干预ESRD病人冠状动脉钙化具有十分重要的临床价值。
作为冠状动脉粥样硬化的重要组成成分,钙化是冠状动脉血管病变的特征性表现,可以导致冠状动脉粥样硬化斑块破裂和血栓形成,可作为预测ESRD病人高病死率的独立危险因素[10]。临床上一般使用CT和冠状动脉造影检查冠状动脉钙化是否发生,但这两种检查存在很多局限性。IVUS可实时显示冠状动脉血管管腔、管壁成像,以及动脉粥样硬化斑块的大小、组成成分及分布情况。有研究表明,与冠状动脉造影检查相比,IVUS能够更好地评估病人钙化病变血管管腔直径、钙化面积和钙化弧度[11],更加精确地评估冠状动脉病变情况。
目前,冠状动脉血管钙化的发生机制仍不十分清楚。有研究表明,除了钙、磷和iPTH等传统致病因素外,冠状动脉血管钙化的发生还与众多其他因素有关,如ESRD病人显著升高的成纤维细胞生长因子23、脂蛋白异常以及华法林和二磷酸盐的不合理使用等[12-15]。然而,最近的证据表明,ESRD病人冠状动脉钙化不是一个被动的钙质沉积过程,而是一个由众多细胞参与、过程十分精密的主动调节过程[16]。越来越多的证据表明,OPN是动脉粥样硬化相关血管病变发生发展的关键调节因子[17]。但是,OPN在ESRD病人冠状动脉钙化中的确切作用仍然不明确。
OPN已被证实参与调控细胞的增殖、分化、迁移以及凋亡等各种生理和病理生理过程[18]。近年来研究表明,OPN在肾脏病相关血管病变发生中发挥了重要作用。在正常肾脏中,OPN的表达水平很低;而在病变的肾脏中,肾小管细胞OPN的表达显著增加[19]。ESRD病人主动脉平滑肌细胞(SMC)以及动脉粥样硬化斑块周围的巨噬细胞亦表达高水平的OPN[20-21]。更有临床意义的是,ESRD病人血清OPN水平显著升高[22],且在促进冠状动脉钙化中发挥至关重要的作用[23]。有研究结果表明,透析病人血清能够通过OPN促进SMC矿物质沉积和钙化[24],并且使用中和抗体特异性抑制OPN则可以显著抑制颈动脉内皮剥脱大鼠新生内膜的增厚。这些证据提示,OPN可能是引起ESRD病人冠状动脉钙化的重要病理机制。
有研究表明,血清OPN水平可作為反映血管钙化的生物标志物[23]。本研究结果与之相一致。ABDALRHIM等[25]研究发现,OPN在血管钙化和炎症过程中起关键作用,且血浆中OPN水平与冠状动脉疾病密切相关。另一项研究结果显示,与非钙化的心脏瓣膜相比,伴有钙化的心脏瓣膜中OPN表达水平显著增加[26]。以上证据表明,OPN水平可以反映冠状动脉疾病的存在和严重程度。
本研究的不足之处:样本量较小;由于IVUS检查时探头必须通过病变,所以对于狭窄严重的病变,IVUS无法检测,这导致一些严重的病变未能被统计,从而可能影响结果。
综上所述,血清OPN水平在伴有冠状动脉钙化的ESRD病人中显著升高,且与冠状动脉钙化的严重程度相关,是ESRD病人发生冠状动脉钙化的独立危险因素,可作为反映ESRD病人冠状动脉钙化的有效标志物。
[参考文献]
[1]GRAMS M E, YANG W, REBHOLZ C M, et al. Risks of adverse events in advanced CKD: the chronic renal insufficiency cohort (CRIC) study[J]. American Journal of Kidney Diseases, 2017,70(3):337-346.
[2]WILKIESON T J, RAHMAN M O, GANGJI A S, et al. Co-ronary artery calcification, cardiovascular events, and death: a prospective cohort study of incident patients on hemodialysis[J]. Canadian Journal of Kidney Health and Disease, 2015,2:29.
[3]SAKAMOTO A, VIRMANI R, FINN A V. Coronary artery calcification: recent developments in our understanding of its pathologic and clinical significance[J]. Current Opinion in Cardiology, 2018,33(6):645-652.
[4]周继生,鲍宏达,汪年松,等. CKD与非CKD患者冠状动脉钙化发生情况的比较研究[J]. 中国中西医结合肾病杂志, 2013,14(7):586-589.
[5]MAHTTA D, ELGENDY A Y, ELGENDY I Y, et al. Intravascular ultrasound for guidance and optimization of percutaneous coronary intervention[J]. Interventional Cardiology Clinics, 2018,7(3):315-328.
[6]CASTELLO L M, RAINERI D, SALMI L, et al. Osteopontin at the crossroads of inflammation and tumor progression[J]. Mediators of Inflammation, 2017, 2017:4049098.
[7]GARCA-GMEZ M C, VILAHUR G. Osteoporosis and vascular calcification: a shared scenario[J]. Clin Investig Arterioscler, 2020,32(1):33-42.
[8]HUANG W C, TENG H I, CHEN H Y, et al. Association between asymmetric dimethylarginine and in-stent restenosis tissue characteristics assessed by optical coherence tomography[J]. International Journal of Cardiology, 2019,289:131-137.
[9]CHIRUMAMILLA A P, MAEHARA A, MINTZ G S, et al. High platelet reactivity on clopidogrel therapy correlates with increased coronary atherosclerosis and calcification: a volumetric intravascular ultrasound study[J]. JACC Cardiovascular Imaging, 2012,5(5):540-549.
[10]CHEN J, BUDOFF M J, REILLY M P, et al. Coronary arte-ry calcification and risk of cardiovascular disease and death among patients with chronic kidney disease[J]. JAMA Cardio-logy, 2017,2(6):635-643.
[11]徐大勇. CT冠状动脉造影与血管内超声评价冠状动脉钙化病患者管腔和钙化的特点[J]. 医疗装备, 2017,30(21):26-28.
[12]ANDREWS J, PSALTIS P J, BARTOLO B A D, et al. Coronary arterial calcification: a review of mechanisms, promoters and imaging[J]. Trends in Cardiovascular Medicine, 2018,28(8):491-501.
[13]YAMADA S, GIACHELLI C M. Vascular calcification in CKD-MBD: roles for phosphate, FGF23, and Klotho[J]. Bone, 2017,100:87-93.
[14]LU X, HU M C. Klotho/FGF23 axis in chronic kidney disease and cardiovascular disease[J]. Kidney Diseases (Basel, Swit-zerland), 2017,3(1):15-23.
[15]VLAD C E, FOIA L, POPESCU R, et al. Apolipoproteins A and B and PCSK9: nontraditional cardiovascular risk factors in chronic kidney disease and in end-stage renal disease[J]. Journal of Diabetes Research, 2019, 2019:6906278.
[16]OGAWA T, NITTA K. Pathogenesis and management of vascular calcification in patients with end-stage renal disease[J]. Contributions to Nephrology, 2018,196:71-77.
[17]LOK Z S Y, LYLE A N. Osteopontin in vascular disease[J]. Arteriosclerosis, Thrombosis, and Vascular Biology, 2019,39(4):613-622.
[18]ICER M A, GEZMEN-KARADAG M. The multiple functions and mechanisms of osteopontin[J]. Clinical Biochemistry, 2018,59:17-24.
[19]KALETA B. The role of osteopontin in kidney diseases[J]. Inflammation Research, 2019,68(2):93-102.
[20]NAKAMURA H, HONDA H, INADA Y, et al. Osteopontin expression in vascular smooth muscle cells in patients with end-stage renal disease[J]. Therapeutic Apheresis and Dialysis, 2006,10(3):273-277.
[21]KWON H M, HONG B K, KANG T S, et al. Expression of osteopontin in calcified coronary atherosclerotic plaques[J]. Journal of Korean Medical Science, 2000,15(5):485.
[22]DRUCK A, PATEL D, BANSAL V, et al. Osteopontin levels in patients with chronic kidney disease stage 5 on hemodialysis directly correlate with intact parathyroid hormone and alkaline phosphatase[J]. Clinical and Applied Thrombosis/Hemostasis, 2019,25(113):107602961989662.
[23]BEREZIN A E, KREMZER A A. Circulating osteopontin as a marker of early coronary vascular calcification in type two diabetes mellitus patients with known asymptomatic coronary artery disease[J]. Atherosclerosis, 2013,229(2):475-481.
[24]CHEN N X, ONEILL K D, DUAN D X, et al. Phosphorus and uremic serum up-regulate osteopontin expression in vascular smooth muscle cells[J]. Kidney International, 2002,62(5):1724-1731.
[25]ABDALRHIM A D, MARROUSH T S, AUSTIN E E, et al. Plasma osteopontin levels and adverse cardiovascular outcomes in the PEACE trial[J]. PLoS One, 2016,11(6):e0156965. doi:10.1371/journal.pone.0156965.
[26]SAINGER R, GRAU J B, POGGIO P, et al. Dephosphorylation of circulating human osteopontin correlates with severe valvular calcification in patients with calcific aortic valve di-sease[J]. Biomarkers: Biochemical Indicators of Exposure, Response, and Susceptibility to Chemicals, 2012,17(2):111-118.
(本文編辑 马伟平)

