果胶甲酯酶类添加剂在食品加工中的应用
高敏,陆宁
(1.云南轻纺织职业学院,昆明 650300;2.安徽农业大学 茶与食品科技学院,合肥 230036)
果胶是一种天然的食品添加剂,具有乳化、增稠和胶凝作用,被广泛应用于食品与医药等领域[1-2]。同时,果胶也兼具天然的抗辐射功能和养颜护肤功能,目前如何将其应用于化妆品加工中成为果胶应用领域的热点问题。天然果胶物质广泛存在于植物的果实与根茎中,通常以原果胶、果胶和果胶酸形态存在。目前多以干燥的柠檬皮、苹果皮作为果胶的主要来源,此外,菠萝皮也富含果胶,可以作为果胶生产的原料[3]。
在食品加工领域,使用果胶添加剂可以对食品的口感、质地、形状和存储时间进行一定的优化。由于其与糖的口感相似且具有脂肪一般的质地,因此,多使用其去糖与脂肪,对口感缺失的食品进行口感恢复。由文献研究可知,从不同的原料中提取到的果胶,甲酯化程度会出现一定的差异。在果胶使用的过程中由于果胶酯化基团分布的差异性,不同的果胶与食品的结合效果也有所不同[4]。为了对其在食品中的使用进行更加深入的了解,此次研究将对果胶甲酯酶类添加剂在食品加工中的应用进行试验,以期为果胶甲酯酶类添加剂的使用提供引导与新的方向。
1 材料与设备
1.1 材料来源
果胶常在植物体内以不溶于水的原果胶形式存在,因此,在研究中需选定部分植物作为果胶提取原料,并结合合适的化学试剂完成添加剂样本制备过程。化学试剂选择结果及纯度见表1。

表1 化学试剂Table 1 The chemical reagents
使用上述选取的试剂与原料,完成果胶甲酯酶类添加剂的制取过程。
1.2 试验设备
此次研究中所需设备见表2,将上述设备安装到实验室中,组成相应试验设备系统。

表2 主要仪器Table 2 The main instruments

续 表
1.3 样本制备
根据文献研究结果及以往试验环节设定情况,制备流程见图1。

图1 果胶甲酯酶类添加剂样本制备流程Fig.1 The preparation process flow of pectin methylesterase additive samples
1.4 样本制备工艺要点
原料处理:获取新鲜果胶原料,使用剪刀将其分割为若干份,灭活酶处理后,将其放置于65 ℃干燥箱内进行干燥处理。每15 min翻动一次,完全烘干后使用粉碎机打碎,过筛待用。
果胶提取:此环节分为酸提取与酶提取两部分。将适量的蒸馏水加入粉碎过筛的原料中,搅拌均匀后加入适量的酸,调节pH值,在恒温水浴锅中酸解,使用滤布过滤酸提取液。在过滤后的提取液中加入适量的蒸馏水,调节pH值,加入适量的酶,混合均匀后使用恒温水浴锅进行溶液中酶的降解。根据以往试验中设定的反应时间,设计此环节的处理时间,并选择合适的滤布对提取液进行过滤。
果胶沉淀:在过滤后的溶液中滴入适量的乙醇,混合均匀后调节pH值。沉淀一段时间后,使用离心机对其进行处理,得到果胶沉淀物。提取沉淀物放置于鼓风干燥箱中烘干到恒重,得到果胶样本。
在此环节中使用的果胶得率公式如下:
(1)
式中:C表示果胶得率,v1表示果胶质量,g1表示原料干燥粉末质量。
使用电子天平称取0.5~1.0 g果胶,将其完全溶解至100 mL蒸馏水中,在溶液中滴入酚酞指示剂[5-6],使用0.1 mol/L氢氧化钠溶液滴定变色,而后加入5 mL 0.5 mol/L氢氧化钠溶液,放置于室温中皂化3 h,使用0.1 mol/L硫酸溶液滴定至褪色,完成样本甲氧基含量的测定过程,具体甲氧基含量计算公式如下:
(2)
式中:D表示甲氧基含量,h1表示皂化时加入的氢氧化钠溶液体积,d1表示皂化时加入的氢氧化钠溶液浓度,h2表示滴定皂化后剩余碱液的硫酸体积,d2表示滴定皂化后剩余碱液的硫酸浓度,m表示测定过程中的果胶质量,0.031表示甲氧基的毫摩尔数。
将配制好的果胶样本倒入干净的乌氏粘度计中,保证其刻度线垂直于地面后,将乌氏粘度计放置于35 ℃恒温水浴锅中,等待粘度计的刻度线全部浸入溶液中,恒温处理10 min。使用洗耳球将溶液由毛细管口吹下,搅拌。而后,等待溶液自由下落,当测定溶液自由流向两球之间刻度线时,按下秒表暂停计时。反复测定3次,取测定结果平均值作为最后输出结果。粘度计控制测定流速在120~200 s最佳。样本粘度计算公式如下:
P=α×J。
(3)
式中:α表示样本流经时间,J表示粘度计常数,P表示运动粘度。通过上述计算过程,确定果胶甲酯酶类添加剂的制取条件。
2 试验方法
2.1 酯化度测定
为保证样本的酯化程度符合此次研究的需要,使用滴定法测试果胶酯化度。在获取到的果胶溶液中滴入适量的蒸馏水,将其配制为15 mL 0.1% (W/V)的样本溶液。在样本中滴加2~3滴酚酞指示剂,并使用1.0 mol/L氢氧化钠溶液滴定至变色,将滴入的氢氧化钠溶液体积记作A1。随后,在此溶液中缓慢加入15 mL 0.5 mol/L氢氧化钠溶液,使用磁力搅拌器搅拌20 min,得到甲酯化果胶。最后,在此溶液中滴入15 mL 0.1 mol/L盐酸溶液,用0.1 mol/L氢氧化钠滴定酚酞指示剂变色,在此环节中消耗的氢氧化钠溶液体记作A2。设定酯化度为B,则有:
(4)
2.2 果胶酶活力测定
在15 mL的比色管中滴入2.0 mL 2%的样本溶液,在45 ℃条件下保温5 min,加入0.5 mL稀释酶液后开始计数,在45 ℃环境下反应30 min,滴入3 mL DNS溶液后,终止反应。沸水浴10 min,将溶液稀释至20 mL,取1 mL溶液加入蒸馏水稀释至5 mL,在550 nm处测定吸光值,对照D-半乳糖醛酸标准曲线[7-8]获取还原糖含量,计算果胶酶活力。具体果胶酶活力计算公式如下:
(5)
式中:F表示果胶酶活性,n表示反应过程中生成的还原糖含量,194.14表示葡萄糖的摩尔质量,v表示反应溶液体积,t表示反应时间,E表示酶液浓度。
2.3 食品pH值对果胶酶使用效果影响测定
称取10 mL果胶添加剂样本,使用柠檬酸溶液将其pH值调节为3.5,并使用pH值为3.5的缓冲液将其定容至100 mL。分别配制pH值为3.8,4.0,4.2,4.4的食品材料。取12支比色管,每3支一组,分别注入pH 3.8,4.0,4.2,4.4的食品材料3 mL以及果胶酶溶液1 mL,在40 ℃环境下反应1 h。反应结束后,使用滴管取上清液,利用分光光度计测量其透光度,绘制变化曲线。
2.4 果胶酶处理时间对其使用效果影响测定
取12支比色管,每3支一组,以每支比色管中抽取2.3测定环节中得到的最佳pH值食品稀释液3 mL。加入1 mL相应pH值的果胶酶溶液后,在40 ℃环境中,反应15,30,45,60 min反应结束后,使用滴管取上清液,利用分光光度计测量其透光度,绘制变化曲线。
2.5 果胶酶处理温度对其使用效果影响测定
取12支比色管,每3支一组以每支比色管中抽取2.3测定环节中得到的最佳pH值食品稀释液3 mL。加入1 mL相应pH值的果胶酶溶液后,分别放置于30,35,40,45 ℃环境中反应60 min,在每个温度条件下取3组测定结果平均值作为最终结果。使用滴管取上清液,利用分光光度计测量其透光度,绘制变化曲线。
2.6 果胶酶添加量对其使用效果影响测定
取12支比色管,每3支一组并进行编号。以每支比色管中抽取2.3测定环节中得到的最佳pH值食品稀释液3 mL,而后在1~4号中分别加入1 mL蒸馏水、稀释倍数3.4,700,14,75.20 U/mL的添加剂溶液。根据上述两部分测定结果,设定处理时间和温度,处理后使用滴管取上清液,利用分光光度计测量其透光度,绘制变化曲线。
2.7 数据处理
本次研究中所有测定方案均进行3次,并采用SPSS 24.0和Origin 2017软件[9-10]对数据和图表进行分析,试验数据之间差异使用SPSS 24.0完成计算过程。
3 结果与分析
3.1 果胶甲酯酶类添加剂基本性能测定结果分析
通过测定可知,使用滴定法可得到不同果胶的酯化度。由图2可知,所有果胶的酯化度均在29.00%~72.50%之间,此种添加剂的酯化度符合后续试验要求。

图2 果胶添加剂酯化度测定结果Fig.2 The determination results of esterification degree of pectin additives
由图3可知,此次试验中果胶酶的活性完全符合食品添加剂的使用要求,因此可以使用此次样品制备中获取的果胶酶添加剂作为试验测定的对象,开展后续的测定环节。
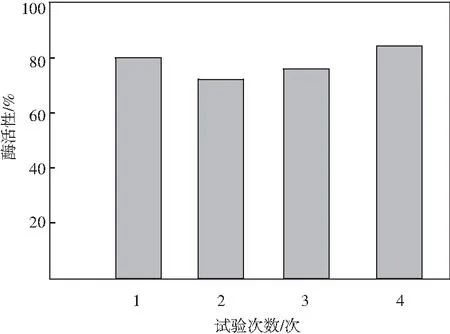
图3 果胶酶活力测定结果Fig.3 The determination results of pectinase activity
3.2 食品pH值对果胶酶使用效果影响分析
食品样本的pH值对食品添加剂的使用效果具有一定的影响。同时也会影响添加剂内果胶的稳定性。通过分析可知,pH值对酶活力的影响主要体现为其对酶的活性条件及空间结构具有破坏性。pH值过高会使酶失去活性,导致添加剂的使用效果下降。由图4可知,当pH值在3.8~4.2区间内,溶液的澄清度随着pH值的增加而上升。此区间后,溶液的澄清度逐渐下降。因此,添加剂使用的pH值最佳取值区间为3.8~4.2。

图4 食品pH值对果胶酶使用效果影响测定结果Fig.4 The determination results of food pH values on pectinase usage
3.3 果胶酶处理时间对其使用效果影响分析
随着反应时间的增加,添加剂与食品样本完全反应后,食品样本的澄清度不再发生变化。由图5可知,在15~60 min内,样本的澄清度随着时间的增加而变化。45 min后液体的澄清速度逐渐下降,变化综合考虑,最佳反应时间在15~45 min。

图5 果胶酶处理时间对其使用效果影响测定结果Fig.5 The determination results of pectinase treatment time on its use effect
3.4 果胶酶处理温度对其使用效果影响分析
在添加剂的使用过程中,温度与时间对其使用效果具有密切的关系。由于添加剂中酶蛋白的变性随时间变化而改变,因此,在温度变化初始阶段,酶蛋白的变性尚未显示出来。随着温度的逐渐提升,其反应活性逐渐下降。由图6可知,添加剂在温度的变化中,其曲线趋势呈现“凸”形。对图像进行分析可以看出,当温度在35~40 ℃时,添加剂活性最佳。当温度过高时,添加剂中的酶蛋白活性逐渐丧失,导致食品样本中的固体物含量逐渐增加。

图6 果胶酶处理温度对其使用效果影响测定结果Fig.6 The determination results of pectinase treatment temperature on its use effect
3.5 果胶酶添加量对其使用效果影响分析
在食品添加剂与食品样本作用过程中,当样本浓度大于食品添加剂浓度时,添加剂被食品样本饱和,其反应作用会随着添加剂酶浓度的增加而增加。由图7可知,添加剂的使用效果随着果胶酶浓度的增加而增加。当添加剂酶浓度为14~700 U/mL时,食品样本溶液的透光性逐渐提升。综合上述分析可以看出,食品添加剂酶浓度最佳区间为14~700 U/mL。

图7 果胶酶添加量对其使用效果影响测定结果Fig.7 The determination results of pectinase additive amount on its use effect
3.6 果胶甲酯酶类添加剂加工工艺正交试验结果分析
根据以上果胶甲酯酶类添加剂单因素应用试验结果进行正交试验,以此确定果胶甲酯酶类添加剂在食品加工中的最佳使用方案,见表3。

表3 果胶甲酯酶类添加剂用量水平表Table 3 The additive amount of pectin methylesterase additive
根据以上设定得到复合饮料配方正交试验结果,见表4。

表4 果胶甲酯酶类添加剂正交试验结果Table 4 The orthogonal test results of pectin methylesterase additive

续 表
由表4可知,影响食品添加剂使用效果影响顺序为A>B>D>C,即添加剂用量>作用时间>pH值>温度。同时确定其最佳配比为A3B3C2D2,即添加剂酶用量为75.20 U/mL,反应时间为45 min,反应温度为38 ℃,食品pH值为4.0。
使用上述方案得到样本的透光率为88.0%,证明此方案的使用效果最佳。将此方案应用于食品加工中可有效提升食品加工效果。
4 结论
此次研究以果胶甲酯酶类添加剂作为研究对象,研究其制取过程以及在食品加工过程中的应用效果。选择食品样本pH值、反应时间、反应温度和酶添加量作为单因素试验和正交试验的测定对象,由此得出果胶甲酯酶类添加剂最佳制备工艺及使用条件。由多轮试验结果可知,果胶甲酯酶类添加剂最佳使用工艺为添加剂酶用量为75.20 U/mL,反应时间为45 min,反应温度为38 ℃,食品pH值为4.0。将此研究结果作为添加剂的使用方式,可扩大果胶甲酯酶类添加剂在食品加工中的应用范围,提升食品添加剂领域的研究深度。

