棉花FT基因的特征和表达分析
刘春艳,刘杰 ,陈伟,朱守鸿,李燕,曹新川 ,何良荣 ,张永山*
(1塔里木大学植物科学学院,新疆 阿拉尔 843300)
(2中国农业科学院棉花研究所/棉花生物学国家重点实验室,河南 安阳 455000)
棉花是我国重要的经济作物,其产量和品质性状与开花密切相关。开花是植物生长发育必经的过程,标志着植物由营养生长向生殖生长的转变,这是一个环境信号和内源信号共同调节的过程。不同的棉种表现出不同的开花时间和温度敏感反应,在温度、光等环境因素中,植物对光周期的响应是决定最佳开花时间的重要因素[1]。FT(Flowering Locus T)基因是植物开花调控途径中的重要整合因子和关键基因[2],可将上游的信号整合传递给下游开花发育相关基因以调控开花。FT蛋白是在植物叶片中产生的成花信号,通过输导组织长距离运输到茎尖顶端从而促进开花[3-4]。FT基因与TFL1(Terminal Flower 1)基因均为磷脂酰乙醇胺结合蛋白(phosphatidyl ethanolamine-binding proteins,PEBP)家族的成员,因两个氨基酸位点的差异而具有相反的调节功能[5],组成型表达TFL1基因可延迟开花[6],组成型表达FT基因可提前开花[7]。
近几年已在多种植物中克隆到FT同源基因,并通过转基因技术证明FT基因的表达可促进植物提早开花[8-10]。郭丹丽等[11]在拟南芥中过表达GhFT1基因,拟南芥出现早花表型。东锐等[12]克隆了棉花FT基因,转化拟南芥表现为提早开花。樊红娟等[13]发现FT基因能促进棉花植株开花形成花蕾,GhFT基因的表达量随着棉花植株从营养生长向生殖生长的过渡越来越高。这些研究成果为进一步探索FT基因的作用机制奠定了基础,然而其在基因组中的分布、进化特性仍不清楚。PEBP基因家族分为3个亚家族,本试验利用生物信息学的方法,对FT-like亚家族中的FT基因的理化特性、基因结构、蛋白结构等进行详细分析。此外,棉花中FT基因的时空表达模式研究多是针对田间材料不同发育阶段而言,本试验以陆地棉TM-1为试验材料,除对田间GhFT基因在不同组织中的表达进行定量分析,室内还通过不同的光周期处理验证GhFT的表达与光周期之间的相关性,田间与室内试验结合以确定棉花FT基因的时空表达模式,旨在为FT基因相关研究提供理论依据,为探索FT基因在棉花发育调控中的作用奠定基础。
1 材料与方法
1.1 棉花FT同源基因鉴定及特征分析
从 Cottongen数据库(https://www.cottongen.org/)下载雷蒙德氏棉(Gossypium raimondiiU1bich)、海岛棉(Gossypium barbadenseL.)、陆地棉(Gossypium hirsutumL.)、亚洲棉(Gossypium arboreumL.)、草棉(Gossypium herbaceumL.)、长萼棉(Gossypium longicalyxHutchinson&Lee)、瑟伯氏棉(Gossypium thurberiTodaro)、澳洲棉(Gossypium australF.von Mueller)、拟似棉(Gossypium gossypioides(Ulbrich)Standley)、特伦纳氏棉(Gossypium turneriFryxell)、达尔文氏棉(Gossypium darwiniiWatt)、夏威夷棉(Gossypium tomentosumNuttall ex Seemann)、黄褐棉(Gossypium mustelinumMiers ex Watt)的基因蛋白序列信息文件。
从 CottonFGD 数据库(https://cottonfgd.org/)以PF01161为查询条件,下载Gorai.004G264600(GrFT)基因蛋白序列,将GrFT基因编码的蛋白序列与13个棉种分别进行双向比对(blast),预测与GrFT同源的候选基因,选择E值最小的基因提取其蛋白序列,利用 Pfam(http://pfam.xfam.org/search#tabview=tab1)、CDD(https://www.ncbi.nlm.nih.gov/Structure/bwrpsb/bwrpsb.cgi)和Batch SMART_v1.0基于保守结构域(domain)对候选基因进行鉴定,剔除不含保守结构域、长度异常的基因。使用CELLO v.2.5在线预测网站(http://cello.life.nctu.edu.tw/)对鉴定出的FT基因进行蛋白质亚细胞定位预测,FT基因编码的蛋白序列删除ID后提交到ExPASy(https://web.expasy.org/compute_pi/)对蛋白的相对分子量和等电点进行分析。
1.2 FT同源基因系统进化、蛋白基序、基因结构和保守结构域分析
将不同物种的FT基因的蛋白序列导入Geneious®10.2.2进行多序列比对,简化ID后利用MEGA 7.0软件计算最佳模型,采用最大似然法(maximum likelihood,ML)构建系统进化树。利用Simple MEME Wrapper工具(TBtools)对蛋白保守基序进行分析。整理保守结构域信息和蛋白序列长度信息,利用Simple BioSequence Viewer工具(TBtools)进行保守结构域绘制,利用Gene Structure View工具(TB-tools)绘制进化树、motif、基因结构和domain组合图。
1.3 FT基因启动子顺式作用元件分析
从CottonFGD数据库提取陆地棉(AD1)、海岛棉(AD2)、亚洲棉(A2)和雷蒙德氏棉(D5)中FT基因编码序列(coding sequence,CDS)上游2000 bp的序列,从Cottongen数据库下载其余9个棉种的全基因组基因结构注释文件和全基因组序列文件。利用TBtools中的Gtf/Gff3 Sequences Extract工具和Fasta Extract or Filter工具分别提取9个棉种的FT基因CDS上游2 kb的序列。整合所有FT基因CDS上游2000 bp的序列,提交到PlantCARE网站(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)进行顺式作用元件分析,利用TBtools进行可视化。
1.4 主栽棉种FT基因表达模式分析
以基因ID作为查询条件,从Cotton Omics Database数据库(http://cotton.zju.edu.cn/index.htm)下载陆地棉和海岛棉中FT基因的表达谱数据,利用Heat-Map工具(TBtools)绘制FT基因表达热图。
1.5 陆地棉GhFT基因的表达模式分析
1.5.1 试验材料与处理
以陆地棉遗传研究的标准系TM-1为试验材料,种植于3个不同环境。
环境1:田间(自然光照)种植于河南省安阳市白璧镇中国农业科学院棉花研究所东场试验基地,于盛花期挂牌标记当日花,记为开花后0天(day post anthesis,DPA),并取开花当天的不同组织(根、下胚轴、主茎茎尖、果枝茎尖、子叶、幼叶、苞叶、萼片、花瓣、花药、花丝、柱头、胚珠),摘取3 DPA、5 DPA、10 DPA的棉铃,室内剥取纤维,液氮速冻后于-80℃保存备用。
环境2:28℃温室条件下于营养钵中种植,进行长日照处理(long-day,LD),光照时间16 h(09:00-次日01:00),光照强度为200 μmol/(m2·s-1),在五叶期于1 d内间隔4 h取倒3叶和主根,盛花期取主茎叶(按照生育期的大小把叶龄划分为8个等级,如图1所示),液氮速冻后于-80℃保存备用。

图1 TM-1叶龄划分
环境3:进行短日照处理(short-Day,SD),光照时间8 h(09:00—17:00),其他条件同环境2,于五叶期1 d内间隔4 h取倒3叶和主根,液氮速冻后于-80℃保存备用。
1.5.2 RNA的提取和cDNA的合成
按照EASYspin Plus植物RNA快速提取试剂盒(艾德莱生物)的操作步骤提取基因组RNA(操作均在低温条件下进行),并用PrimeScriptTMRT reagent Kit with gDNA Eraser(TaKaRa)试剂盒进行反转录得到cDNA。
1.5.3 荧光定量PCR
在GhFT基因(登录号:HM631972)的编码序列中设计一对特异引物GhFT_248_F和GhFT_457_R,并用棉花中Actin14同源基因(GI号:AY305733)作为内参基因设计特异引物进行定量分析,引物序列信息见表1。

表1 引物信息
荧光定量PCR体系由5.0 μL 2×SYBR Premix Ex Taq染料,0.2 μL ROX Reference Dye Ⅱ,1.6 μL模板,0.4 μL Primer-F,0.4 μL Primer-R,2.4 μL灭菌水组成,总体系为10 μL。利用Applied Biosystems 7500 Realtime PCR System荧光定量PCR仪进行扩增,检测每份样品的GhFT基因和Actin内参基因的CT值,反应程序为95℃ 30 s、95 ℃ 5 s、60 ℃ 34 s,40个循环。每个样品3个生物学重复,每次试验设置3个技术重复。
1.5.4 数据处理
使用Microsoft Office Excel 2016整理数据,用SPSS Statistics 17.0进行差异显著性(P<0.05)检验,用Origin 9.1、Prism 8.0.2等软件进行作图。
2 结果与分析
2.1 13个棉种FT同源基因及其序列特征
通过序列比对和保守结构域筛选,13个棉种共鉴定出18个FT基因,其中二倍体棉种均有1个FT基因,四倍体棉种A、D亚组各有1个FT基因,按照物种-基因的命名方式对鉴定出的FT基因进行命名(表2),并对其序列特征进行分析。从表2可以发现,FT基因的长度介于795 bp和3580 bp之间,除GkirFT基因和GthuFT基因外,不同棉种中的FT基因序列长度差异不大。CDS长度除GthuFT基因(591 bp)外其余FT基因均为525 bp。来自不同棉种的FT基因的相对分子量没有明显差别,平均为19.56 kDa,编码的蛋白长度均为174个氨基酸。除GheFT基因(等电点为7.8)、GthuFT基因(等电点为9.45)和GkirFT基因(等电点为9.45),其余15个FT基因的等电点为6.73。对来自13个棉种的18个FT基因编码的蛋白进行亚细胞定位预测,结果表明,16个基因均定位于细胞质和细胞外,只有GkirFT基因在叶绿体有定位。

表2 棉花FT基因的序列特征
2.2 FT基因系统进化、蛋白基序、基因结构和保守结构域分析
采用最大似然法构建13个棉种FT基因的系统进化树(图2),整个进化树主要分为2个亚组,组Ⅰ仅有2个成员,即GthuFT基因和GkirFT基因;组Ⅱ包含来自11个棉种的16个成员。保守基序分析发现,18个FT基因均含有Motif 1(50个保守氨基酸)、Motif 2(50个保守氨基酸)、Motif 3(36个保守氨基酸)和Motif 4(26个保守氨基酸),说明这18个基因拥有相似的功能。基因结构分析发现,不同棉种中的FT基因含有相同数量的外显子和内含子(4个外显子,3个内含子),根据外显子与内含子结构可将所有FT基因分为2组,这与ML进化树的分组结果一致。保守结构域分析发现,同一组的FT基因具有相同的结构域,组Ⅰ的基因都含有4个PEBP结构域,组Ⅱ的基因均含有4个PLN00169结构域。

图2 FT基因的进化、基因结构及编码蛋白结构分析
2.3 FT基因启动子顺式作用元件
为了进一步研究FT基因的调控机制,提取FT基因CDS上游2 kb的核苷酸序列进行启动子区域顺势作用元件预测,结果如图3所示。总共预测到15种顺势作用元件,这些顺式作用元件决定了FT基因对逆境胁迫(低温、干旱、缺氧等)、激素(生长素、脱落酸、赤霉素等)、光等的响应机制。18个FT基因中GturFT基因含有的作用元件类型最丰富(11类),GrFT基因和GbFT.A基因含有的元件类型最少,均为5类。此外,15种顺势作用元件中有3种类型是独特的,参与胚乳表达(endosperm expression)的顺式调节元件仅GthuFT基因含有,参与昼夜节律(circadian control)控制的顺式调节元件仅GbFT.D基因含有,涉及防御和应激反应(defense and stress responsive)的顺式作用元件仅GhFT.D基因含有。所有的FT基因除GthuFT基因外均含有赤霉素响应元件,除GkirFT基因均含有光响应元件,推测FT基因的表达受光周期调控。
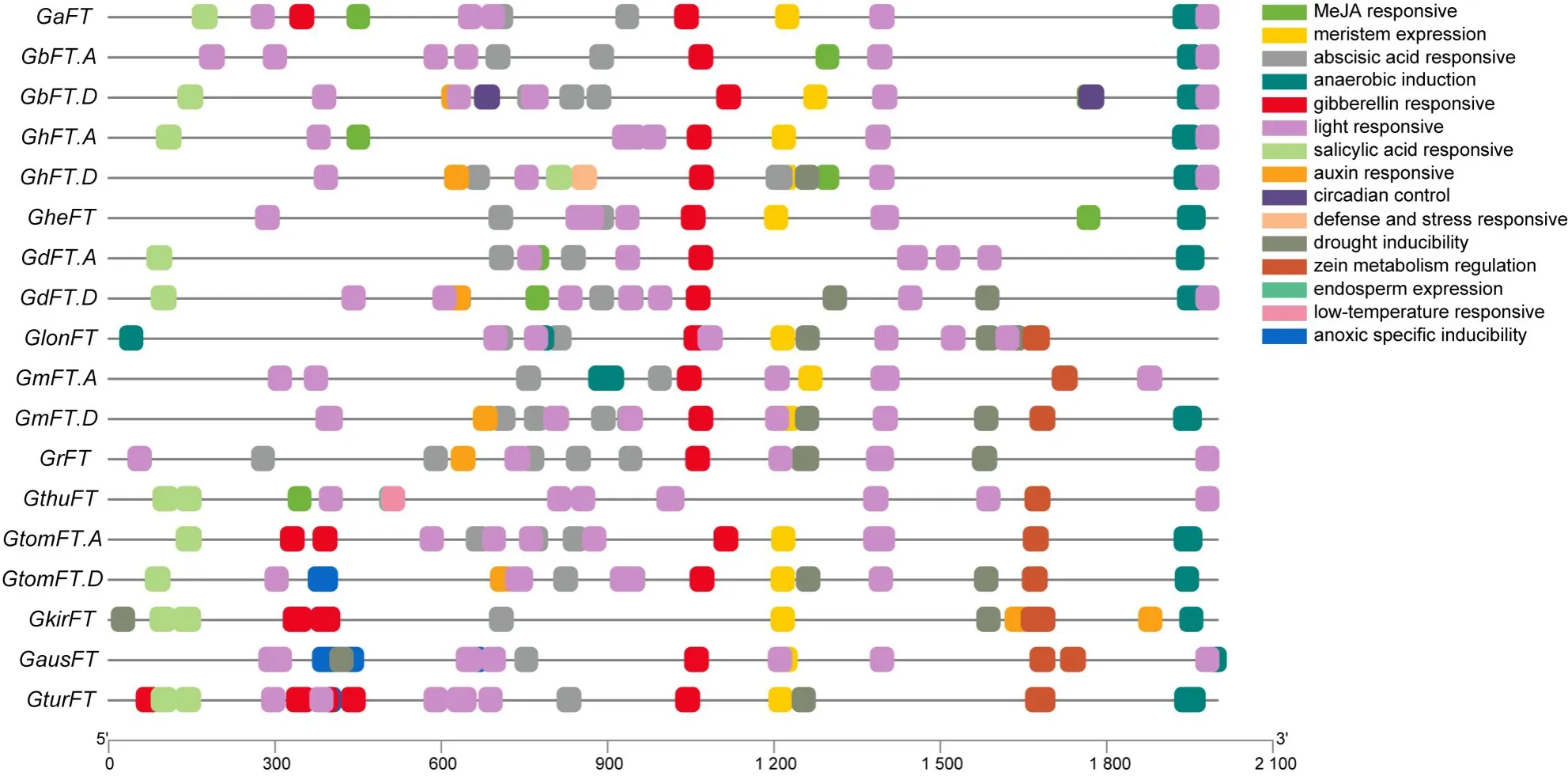
图3 FT基因启动子顺式作用元件分布
2.4 主栽棉种FT基因表达模式分析
以陆地棉和海岛棉中FT基因为代表,从公共数据库下载相应基因的表达谱数据,对FT基因的表达模式进行分析。从图4可以看出,GbFT.A基因、GbFT.D基因、GhFT.A基因、GhFT.D基因在Hai7124的10 DPA、20 DPA的纤维、胚珠、花药、花瓣、雌蕊、根和茎中几乎不表达,在副萼、叶、萼片中有表达,在花托中优势表达,A亚组的2个FT基因在25 DPA的纤维中有相对较高表达。对FT基因在TM-1不同组织中表达进行分析发现,4个基因在胚珠、花药、花瓣、根和茎中几乎不表达,在叶中有较高表达,A亚组的2个基因在20 DPA的纤维、花托中优势表达,在副萼、雌蕊中有较高表达,D亚组的2个基因在花托中有优势表达。

图4 FT基因表达热图
2.5 陆地棉GhFT基因的表达模式分析
2.5.1GhFT基因在不同组织中的mRNA转录水平比较
提取田间TM-1不同组织的RNA,反转录后进行GhFT基因荧光定量表达分析,结果如图5所示:GhFT基因在苞叶中的表达量最高;其次是萼片;在子叶,茎尖和柱头中的表达量相较于其他组织略高;在幼叶、花瓣、花丝、胚珠、5 DPA纤维、10 DPA纤维中只能检测到微弱的GhFT基因表达;在根、下胚轴、花药、3 DPA的纤维中几乎无表达。

图5 GhFT基因在不同组织的表达量
2.5.2GhFT基因在不同叶龄中的mRNA转录水平比较
GhFT基因在变态型叶(苞叶和萼片)中的表达量均高于幼叶,推测GhFT基因可能在较成熟的叶片中具有高表达,与模式植物拟南芥的表达模式相符。因此本试验对室内长日照条件下取得的1~8叶龄的叶片进行表达定量分析,结果如图6A所示:随着叶龄的增加,GhFT基因的表达量也在增加,至叶龄8时到达最大。GhFT基因在成熟叶片中的表达量高于叶片刚发育时期的表达量,这也为实验取样提供一个数据依据。在此基础上,本试验对成熟叶片不同部位进行了GhFT基因表达量分析(图6B),方差分析结果显示同一叶片不同部位中的GhFT基因表达量不存在显著差异,在取样时应当尽量选取成熟叶片来检测GhFT基因的表达量。

图6 叶片中GhFT基因的表达量
2.5.3GhFT基因在不同光周期处理下mRNA转录水平比较
TFL1基因在根中具有较高表达[14],FT基因与其拥有相反的调节功能,猜测FT基因在根中也会有相应表达,且FT基因在成熟叶片中具有高表达,顺式作用元件分析显示FT基因的表达可能受光周期调控,为了探索FT基因与光周期的相关性,对五叶期的叶和根中的GhFT表达进行定量分析以研究GhFT基因在不同光周期处理下mRNA转录水平。
室内长日照处理条件下,24 h内每间隔4 h取样进行荧光定量PCR,定量分析结果验证了GhFT的表达与光周期之间的相关性。结果如图7所示:GhFT基因在根中几乎不表达,在叶片中的最高表达量显著高于在根中的表达量。叶片中GhFT基因的表达量在光照条件下一直在下降,至暗培养开始(16 h)降至1 d内的最低点,然后开始积累,暗培养结束(24 h或0 h)时GhFT基因的表达量达到最大,说明在LD处理下,叶片中GhFT基因的表达量是在黑暗条件下进行积累的。

图7 长日照处理下GhFT基因在叶片和根中的表达量
从图8可以看出:在短日照处理下,GhFT基因在根中的最高表达量显著高于在叶中的最高积累量;1 d内GhFT基因在根和叶片中的表达量变化呈昼夜节律现象。根中GhFT基因表达量在光照条件下(0~8 h)急剧下降,暗培养4 h后急剧上升至暗培养8 h(16 h)达到1 d内的最高点,然后急剧下降,暗培养12 h后达到1 d内的最低点,继续暗培养又开始上升,说明在SD处理下根中GhFT基因表达是在暗培养条件下进行积累的。叶片中GhFT的mRNA水平与GUO D L等[15]的结果一致,在光照4 h后达到1 d内最高点,然后开始慢慢下降,直到暗培养12 h(20 h)后降至1 d内最低点,之后表达量逐渐上升,表明SD处理条件下叶片中GhFT基因的表达量是在光照培养开始前已经开始积累。

图8 短日照处理下GhFT基因在叶片和根中的表达量
3 结论与讨论
本研究利用生物信息学的方法从13个棉种中鉴定出了18个FT基因,这些基因具有相似的功能,其理化性质、保守基序没有明显差异,进化关系分析结果显示同一类群的FT基因的基因结构和蛋白结构相似。定量分析结果显示陆地棉TM-1不同组织中GhFT基因的表达量存在较大差异,GhFT基因在胚珠、根中表达量很低,在萼片中表达量较高,这与基于公共数据分析的FT基因的表达模式一致。东锐等[12]的研究表明FT基因在叶片和胚珠的表达量较高,这与本研究结果存在分歧,可能是光照时长差异造成的。针对FT基因的研究,通常情况下会选择RNA含量和丰度较高的幼嫩叶片。本研究结果表明叶片越成熟,GhFT基因的表达量越高,同一叶片不同部位中的表达量不存在显著差异,取样时选择成熟的叶片比选取初生的嫩叶进行定量分析结果更可靠,这对研究FT基因适宜取样时期的选择具有指导意义。本研究在分析叶片中GhFT基因的表达量随叶龄变化的情况时未曾考虑衰老叶片,针对实验完整性有待进一步补充验证。
拟南芥和菊花FT同源基因的表达与日照长短息息相关,FT基因在不同的日照长度下mRNA转录水平不同,只在适宜开花的光照条件下才会积累。长日照属性的拟南芥AtFT基因仅在长日照下积累,菊花CmFT基因是在短日照下有相对较高的积累,长日照处理下几乎不表达[16]。本研究结果表明GhFT基因的表达同AtFT基因和CmFT基因一样受光周期的影响,在LD处理下,GhFT基因在根中几乎不表达,在叶片中具有相对较高的表达;在SD处理下,GhFT基因在叶片和根中均有表达,在根中的表达积累明显高于LD处理下的,这可为研究GhFT基因实验环境的选择提供参考。棉花叶片和根中的GhFT基因表达量在不同的光照时间下表达量不同,并对光照时间长短存在响应机制[15],这与光周期诱导开花密切相关,具体调控机制有待进一步探索。

