苦荞VQ基因家族的全基因组鉴定及其在叶斑病原与激素处理下的表达谱分析
郑逢盛,王海华,邬清韬,申权,田建红,彭喜旭,3,唐新科,3
苦荞VQ基因家族的全基因组鉴定及其在叶斑病原与激素处理下的表达谱分析
郑逢盛1,王海华1,2,邬清韬1,申权1,2,田建红1,彭喜旭1,3,唐新科1,3
1湖南科技大学生命科学学院,湖南湘潭 411201;2经济作物遗传改良与综合利用湖南省重点实验室,湖南湘潭 411201;3重金属污染生态土壤修复与安全利用湖南省高校重点实验室,湖南湘潭 411201
【】VQ基因家族在植物生长、发育以及对生物或非生物胁迫反应中发挥重要功能。在全基因组尺度上,全面鉴定苦荞(L. Gaertn.)VQ(FtVQ)基因家族,分析其在苦荞叶斑病原——互格链格孢()和黑孢霉()侵染和防御相关激素——水杨酸(SA)、茉莉酸(JA)、乙烯(ET)处理下的表达模式,为深入解析苦荞VQ基因家族在植物抗病防御中的功能及机理奠定基础,同时为优良基因资源发掘及抗病品种改良提供线索。基于VQ保守结构域的隐马尔可夫文件(PF05678),采用HMMER 3.0对苦荞平苦一号基因组数据库进行比对搜索,鉴定VQ基因;通过DNAMAN、MapInspect、MEGA、MEME、OrthoFinder、PLACE等生物信息学工具分析基因结构、染色体分布、启动子顺式元件、蛋白质理化性质、蛋白质保守基序、蛋白质亚细胞定位和蛋白质系统进化关系;采用实时荧光定量PCR(qPCR)方法分析苦荞叶VQ基因在病原侵染或激素处理下的表达模式。从苦荞基因组中鉴定获得28个VQ基因,大小为566—1 454 bp,均无内含子,不均一地分布在8条染色体上。根据它们在染色体上的物理位置,命名为—。每一个FtVQ蛋白含有1个VQ基序——FxxxVQx(L/F/I/V/A/Y)TG(x代表任意氨基酸)。亚细胞定位预测表明,21个FtVQ蛋白定位在细胞核中,其余定位在叶绿体或细胞质中。根据蛋白质氨基酸序列与保守结构基序,FtVQ蛋白归类于5个亚家族,亚家族内基因结构和蛋白质基序相对保守。基因重复分析表明,苦荞基因组中有8对VQ旁系同源基因,均为大片段重复基因,提示大片段基因重复在FtVQ基因家族数量扩张中发挥主要作用;它们的非同义突变和同义突变的比值(Ka/Ks)均小于1,提示重复基因在进化中经历了纯化选择。启动子顺式元件预测表明,所有FtVQ基因启动子含有BIHD1OS、CGTCA、ERELEA4、W-box和类W-box等病原或SA、JA、ET反应元件,尤其在、、、、、的启动子区域密集程度更高。qPCR分析显示,在可检测的20个FtVQ基因中,有55%—70%的基因为病原或激素处理下的差异表达基因(DEGs),其中72.7%—85.7%的DEGs的表达显著上调。苦荞基因组拥有28个VQ基因成员,部分VQ基因可能参与了苦荞对叶斑病原的抗性反应。
苦荞;VQ基因家族;互格链格孢叶斑病;黑孢霉叶斑病;防御相关激素
0 引言
【研究意义】植物在长期进化过程中,为了实现对各种逆境的柔性适应,形成了复杂的分子、生化和细胞机制。在分子水平上,抗性相关基因在时空表达上重编程是植物适应逆境的关键事件,而转录因子在其中发挥重要作用。多数情况下,转录因子通过蛋白互作与转录辅助因子形成复合物,实现对靶基因的精准而有效的调节。研究表明,转录辅助因子可影响与其结合的转录因子DNA结合能力、转录激活或抑制活性、亚细胞定位、蛋白的稳定性等重要的生化特性[1]。VQ蛋白是广泛存在于单、双子叶植物的一类转录辅助蛋白,因其含有高度保守的VQ基序(FxxhVQxhTG)而得名,其中,x为任一氨基酸残基,h为疏水性氨基酸残基。VQ基序外的氨基酸序列呈现多样性,这与VQ蛋白家族的功能多样化相适应[2]。VQ蛋白可与WRKY转录因子第Ⅰ组的C-末端以及第Ⅱ组的WRKY结构域特异结合[3],通过与WRKY蛋白或MAP激酶等互作[4],调节植物生长发育以及对生物或非生物逆境响应等生物学过程。在全基因组尺度上鉴定植物VQ基因家族,对基因结构、染色体分布、保守结构域或模体、系统进化、启动子顺式元件等进行全面的生物信息学分析,研究它们在病害和防御相关激素处理下的表达谱,有利于深入阐明VQ基因在植物抗病防御中的调节功能与机理,同时可为植物抗病育种提供候选的基因材料。苦荞是一种药食同源的传统小杂粮作物,营养全面,富含人体必需氨基酸、抗性淀粉、B族维生素和多种具有生物活性的类黄酮物质(如芦丁、槲皮素)。苦荞起源于中国西南地区,有较强的生态适应性,耐贫瘠,抗高寒,在富铝的酸性土壤中也能很好地生长[5]。【前人研究进展】水杨酸(SA)和茉莉酸(JA)/乙烯(ET)信号通路是植物抗病防御反应中2条主要的信号通路[6]。许多VQ基因的表达响应SA、JA、乙烯(ET)和环境刺激,在SA和JA抗病信号通路中发挥重要的调节作用。在拟南芥[3]、水稻[7-8]和大豆[9]中,经SA、JA、ET或病原侵染,多数VQ基因转录水平发生显著变化。Liu等[10]发现在接种青枯病细菌()时,51%的烟草VQ基因表达显著上调,其中部分VQ基因不同程度地受到SA、JA和ET的诱导。直接的生化与遗传学证据表明,VQ基因参与了植物对病害的防御反应。Lai等[11]发现结构相近的SIB1/VQ23和SIB2/VQ16为WRKY33的共激活子(co-activators),在拟南芥对的抗性中发挥正调节作用。WANG等[12]发现拟南芥VQ22、VQ12和VQ29在JA介导的对死体营养型病原的抗性中起负调控作用。Ali等[13]发现,JAV1/VQ22与JAV1的结合蛋白JUL1(一种泛素连接酶)互作,导致VQ22在细胞核中被降解,引发表达上调,从而赋予拟南芥对生物胁迫的抗性。近年,苦荞基因组序列已公布[5],为VQ基因家族的全面系统鉴定与功能基因组研究提供了极大便利。【本研究切入点】目前,在全基因组范围内,拟南芥[3]、水稻[7-8]、杨树[14]、玉米[15]、大白菜[16]、葡萄[17]、棉花[18]、草莓[19]、毛竹[20]、蒺藜苜蓿[21]、烟草[10]等植物的VQ基因家族已被鉴定,但未见苦荞VQ基因家族全面鉴定与表达谱分析的报道。苦荞容易遭受真菌病害,严重影响产量和品质。随着种植规模的扩大和管理的粗放,病害发生愈发严重。最近,SHEN等[22]在湖南苦荞种植基地发现2种叶斑病,分别由互格链格孢()和黑孢霉()引起,发生率为40%—60%。【拟解决的关键问题】本研究采用生物信息学方法,在全基因组范围内对苦荞VQ基因家族进行鉴定,分析VQ基因数量、序列特征、染色体定位、蛋白结构特征、启动子顺式元件和系统进化关系,并采用实时荧光定量PCR技术分析苦荞VQ基因在上述2种叶斑病原和防御相关激素SA/JA/ET处理下的表达模式,为深入解析苦荞VQ基因家族在植物抗病防御中的功能及机理奠定基础,同时为优良基因资源发掘及抗病品种改良提供线索。
1 材料与方法
1.1 苦荞VQ基因家族成员的鉴定
从Pfam数据库(https://pfam.xfam.org/)下载获得VQ保守结构域的隐马尔可夫(HMM)文件(PF05678),基于VQ结构域文件的HMM文件,通过HMMER 3.0(http://hmmer.janelia.org/)对苦荞基因组数据(http://mbkbase.org/Pinku1/)进行比对搜索和鉴定,参数为默认设置,并通过NCBI保守结构域数据库(https://www.ncbi.nlm.nih.gov/Structure/cdd/cdd. shtml)和SMART数据库(https://smart.embl-heidelberg. de/)对候选基因进行确证,剔除无VQ保守结构域的蛋白和重复的序列。拟南芥VQ蛋白序列从TAIR(http://www.Arabidopsis.org/)下载获得,水稻VQ蛋白序列从Rice Genome Annotation Project Database(http://rice.plantbiology.msu.edu/)下载获得。采用DNAMAN9软件,对苦荞VQ基因的开放读码框长度、蛋白质长度、分子量、等电点()等理化性质进行预测。利用WOLF PSORT(http://www.genscript.com/ psort/wolf_psort.html)预测蛋白的亚细胞定位。
1.2 多重序列比对与进化树分析
采用DNAMAN9软件进行多重序列比对。基于邻接法,采用MEGA7.0软件构建苦荞VQ蛋白系统进化树以及苦荞、水稻与拟南芥VQ蛋白的系统进化树,Bootstrap校验重复1 000次。
1.3 保守基序搜索与基因结构分析
利用MEME网站(http://meme-suite.org/tools/ meme-chip)分析VQ蛋白的保守基序,参数设定为:基序数3,基序长度范围为10—50。将VQ基因序列及其编码序列递交至Gene Structure Display Server(http://gsds.cbi.pku.edu.cn/index.php),解析VQ基因结构,如内含子、外显子与上、下游非翻译序列。
1.4 染色体定位与基因重复分析
下载苦荞染色体序列(http://mbkbase.org/Pinku1/),建立本地数据库,以苦荞VQ基因序列执行本地BLAST操作,获取苦荞VQ基因在染色体上的物理位置,并使用MapInspect软件(http://www.plantbreeding. wur.nl/UK/software_mapinspect/)绘制染色体定位图。若2个或以上基因在进化树中处于同一进化分枝的最末端、且位于同一染色体小于100 kb的区域内,则视为串联重复基因;如处于不同染色体的大片段重复区域,则视为片段重复基因。大片段重复信息源自Plant Genome Duplication Database(http://chibba.agtec.uga.edu/duplication/)。
1.5 旁系同源与直系同源基因的鉴定
使用OrthoFinder工具鉴定苦荞VQ旁系同源基因和苦荞与拟南芥、水稻的直系同源基因。先在MEGA7.0中基于MUSCLE(CODONS)算法比对目标序列,然后利用KaKs_Calculator2.0生成非同义替换(Ka)值与同义替换(Ks)值。同源基因对之间的分歧时间(T)按T=Ks/(2×9.1)×10-9×10-6百万年(Mya)计算[23]。
1.6 启动子顺式元件分析
从NCBI下载苦荞VQ基因的启动子序列(起始密码子前1 500 bp),递交至PLACE(https://www.dna. affrc.go.jp/PLACE/?action=newplace)网站分析启动子顺式元件。
1.7 植物材料与处理
苦荞平苦一号由山西农业大学农学院孙朝霞博士惠赠,种植于人工气候室,培养条件为光照16 h/黑暗8 h,温度(22±4)℃,光强100 µmol·m-2·s-1,相对湿度为60%。分别用0.2 mmol·L-1SA、0.1 mmol·L-1茉莉酸甲酯(MeJA)、0.1 mmol·L-1乙烯利(ETH)对四叶期(约20 d)植株进行叶面喷施。苦荞叶斑病原LS-1、BLS-1为经济作物遗传改良与综合利用湖南省重点实验室保存。参照Shen等[22]方法培养和接种病原菌,于四叶期接种,在0、12、24和48 h取样,-80℃保存备用。
1.8 总RNA提取、cDNA合成和qPCR分析
采用Plant Total RNA Extraction Kit试剂盒(Biospin)提取叶片总RNA。采用PrimeScript™ 1st Strand cDNA Synthesis试剂盒(Takara)说明书合成cDNA。在CFX96 PCR系统(Bio-Rad)上进行qPCR。反应体系总体积20 μL:正/反引物(10 μmol·L-1)各0.4 μL、2×SuperReal PreMix Plus(Biospin)10 μL、cDNA模板(100 nmol·L-1)1 μL,用RNase-free的双蒸水补齐体积。反应程序为95℃ 1 min;95℃ 15 s,60℃ 1 min,35个循环。溶解曲线:95℃ 1 min;65℃ 1 min;95℃ 20 s(步进0.5℃·s-1);30℃ 1 min。以(FtPinG0006499300.01)为内参,设阴性对照和3次生物学重复,采用2-DDCT法计算基因相对表达量。与0 h比较,如果某一VQ基因在激素处理或病原接种12、24和48 h后,1个或以上时间点发生了4倍或以上的表达变化,则该基因定义为差异表达基因。采用SPSS21.0软件进行数据处理与统计分析。引物见电子附表1。
2 结果
2.1 苦荞VQ基因的鉴定
利用拟南芥VQ蛋白作为参考序列,对苦荞基因组数据库进行BLASTP搜索,经过HMM和SMART分析,最终鉴定获得28个苦荞VQ基因,并按其在染色体上的物理位置进行命名。基因大小为566—1 454 bp,CDS长度为249—1 083 bp(表1)。通过基因序列与全长CDS序列的比对,发现所有苦荞VQ基因均不含内含子(图1)。根据VQ保守基序的pfam(0678),在苦荞基因组注释[5]中搜索发现有27个VQ基因,除了(FtPinG0003287200)外,均与鉴定结果相对应。
2.2 苦荞VQ蛋白结构分析
苦荞VQ蛋白序列长度为82—360 aa,平均分子量为20.88 kD,除FtVQ19外,其余27个VQ蛋白的氨基酸数目均小于300;蛋白等电点()为4.48— 11.09,71.4%(20/28)的苦荞VQ蛋白的在7.0以上。亚细胞定位预测表明,21个苦荞VQ蛋白定位在细胞核中,6个(FtVQ6、FtVQ9、FtVQ15、FtVQ18、FtVQ26和FtVQ28)定位在叶绿体中,1个(FtVQ14)定位在细胞质中(表1)。基于VQ保守结构域,进行多重序列比对(图2)。所有苦荞VQ蛋白的VQ基序为FxxxVQx(L/F/I/V/A/Y)TG结构,其中,LTG类17个,FTG类4个,YTG类2个,VTG和ATG类各1个。
基于全蛋白序列,构建系统进化树,结果表明,苦荞VQ蛋白分成5个亚家族(图1),第Ⅰ组和第Ⅳ数量最多,均为8个,第Ⅲ组最少(2个)。FtVQ16在第Ⅲ组中单独成枝,处于第Ⅲ组与第Ⅰ组之间;FtVQ13在第Ⅱ组中单独成枝,处于第Ⅱ组与第Ⅰ组之间,表明这两个VQ蛋白属于相应组别之间的进化过渡类型。在同一进化末枝的VQ蛋白具有较高的序列保守性和较近的进化关系。
为进一步了解苦荞VQ蛋白的结构多样性,首先采用MEME软件对苦荞28个VQ蛋白的保守基序进行了分析,然后对每一个可能的基序再通过Pfam和SMART进行注释,以确保预测的准确性。图3显示,在苦荞VQ蛋白中发现3种基序,所有蛋白均含Motif 1,即VQ基序。除个别例外,同一亚家族或亚组的VQ蛋白所含的基序相似,如Ⅰ、Ⅱ(FtVQ14除外)、Ⅳ(FtVQ5除外)和Ⅴ只含Motif 1。Ⅲc和Ⅳa亚组含有3种基序。苦荞VQ蛋白在保守基序种类和数量上的差异,反映这些蛋白在结构上的多样性,预示它们具有不同的生物学功能。
2.3 苦荞VQ基因在染色体上的分布与基因重复
苦荞VQ基因不均匀地分布在8条染色体上,位于同一亚家族或进化分枝的VQ基因在染色体上也呈随机分布(图4)。第6染色体数量最多(7个),多数在其长臂的末端聚集;其次是第1染色体,有5个基因;第7染色体最少,仅有1个基因()。
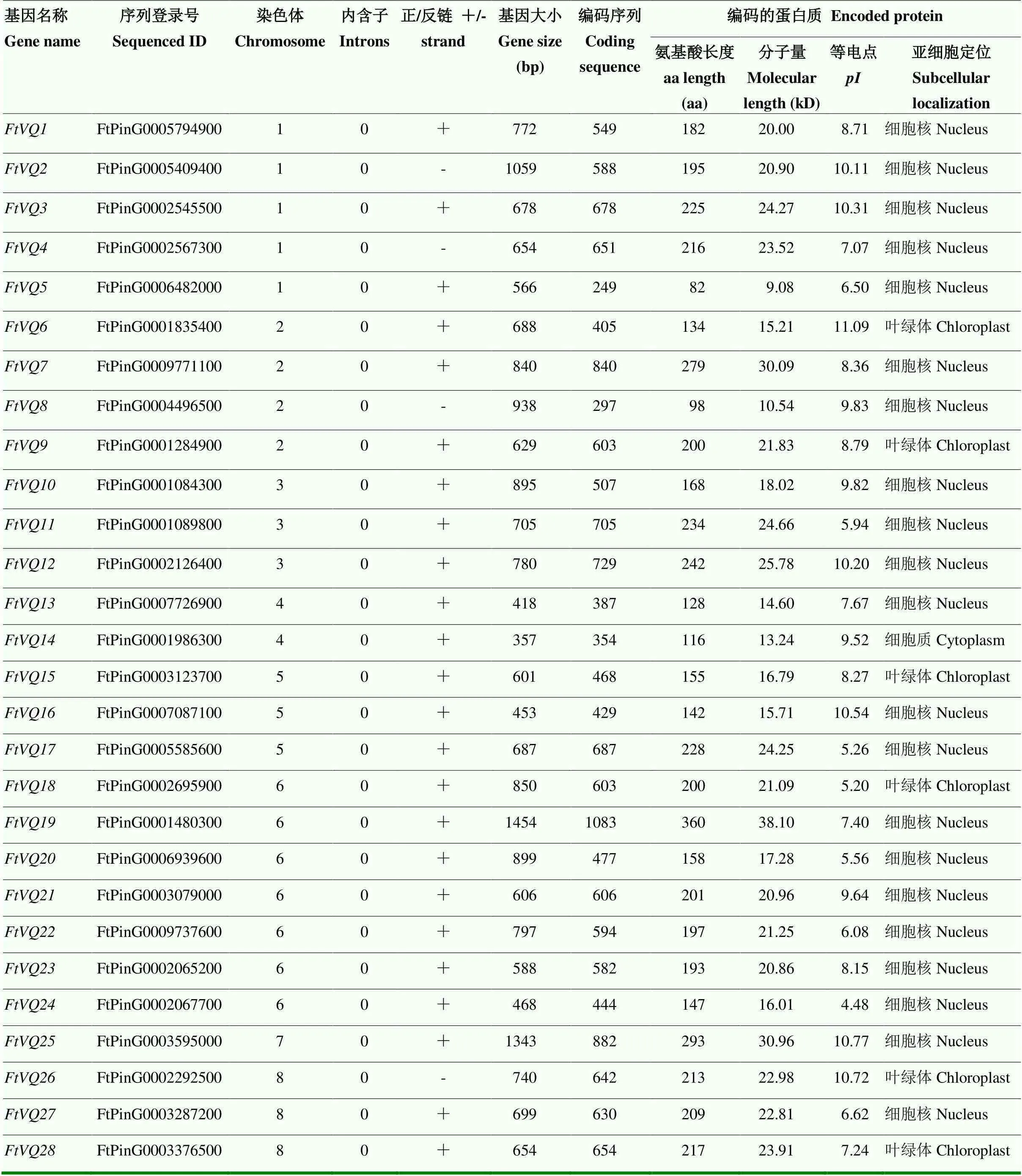
表1 苦荞VQ基因及其序列特征

右图黑色矩形表示编码序列(CDS);灰色矩形表示上、下游序列

FxxxVQxxTG基序高度保守。根据该保守基序的“TG”前面的第一个氨基酸将苦荞VQ蛋白细分为LTG、FTG、ITG、VTG、ATG和YTG 6种类型

图左为苦荞VQ蛋白的进化树。苦荞蛋白划分为5组,各组又划分不同亚组。图右为基于MEME分析得出的苦荞VQ蛋白的3种主要的保守基序,每一保守基序分别用不同颜色的矩形框表示,未按比例绘制

重复的旁系同源VQ基因对用虚线连接The duplicated paralogous pairs of VQ genes are connected with gray-dotted lines
基因重复分析表明,苦荞基因组有8对VQ旁系同源基因(表2)它们源于大片段重复(segmental duplication),位于不同染色体上的大片段重复区域的保守位置,提示大片段重复在苦荞VQ基因数量扩张中发挥重要作用。
根据基因非同义突变和同义突变的比值(Ka/Ks),可以推测基因在进化过程经受何种选择压力[24]。一般情况下,如果Ka/Ks>1,则认为有正选择效应;Ka/Ks=1,则认为存在中性选择;Ka/Ks<1,则认为有纯化选择作用或负选择。8对苦荞VQ旁系同源基因的Ka/Ks为0.0260—0.7986(表2),提示这些基因对经历了纯化选择作用或负选择,估算它们发生重复的年代为45.77—278.83百万年(Mya)。
2.4 苦荞、拟南芥和水稻VQ蛋白的系统进化树
为了分析苦荞、拟南芥和水稻VQ蛋白之间的进化关系,将28个苦荞VQ、34个拟南芥VQ和40个水稻VQ的蛋白序列,采用Mega7.0基于邻接法构建了系统进化树。图5显示,这些VQ蛋白可分为6个亚家族(Ⅰ—Ⅵ),其中第Ⅱ组成员最多(25个),第VI组成员最少(5个),每组都含有单子叶植物和双子叶植物VQ蛋白,提示VQ蛋白的结构特征在单、双子叶植物分开之前就已进化完成;然而第Ⅵ组不含苦荞VQ蛋白,提示苦荞VQ蛋白在结构上的多样性不如拟南芥和水稻。在同一亚家族内,种内的VQ蛋白比种间更容易聚类在一起。苦荞和拟南芥的VQ蛋白比水稻更容易聚类在一起。在进化树末端,两两相聚的有6对苦荞与拟南芥VQ蛋白:FtVQ25和AtVQ9、FtVQ26和AtVQ4、FtVQ5和AtVQ11、FtVQ19和AtVQ30、FtVQ7和AtVQ7、FtVQ22和AtVQ28,然而没有一对苦荞与水稻VQ蛋白,这与单、双子叶植物的进化关系一致,同时暗示VQ蛋白在单、双子叶植物分开后产生了进化上的分歧。
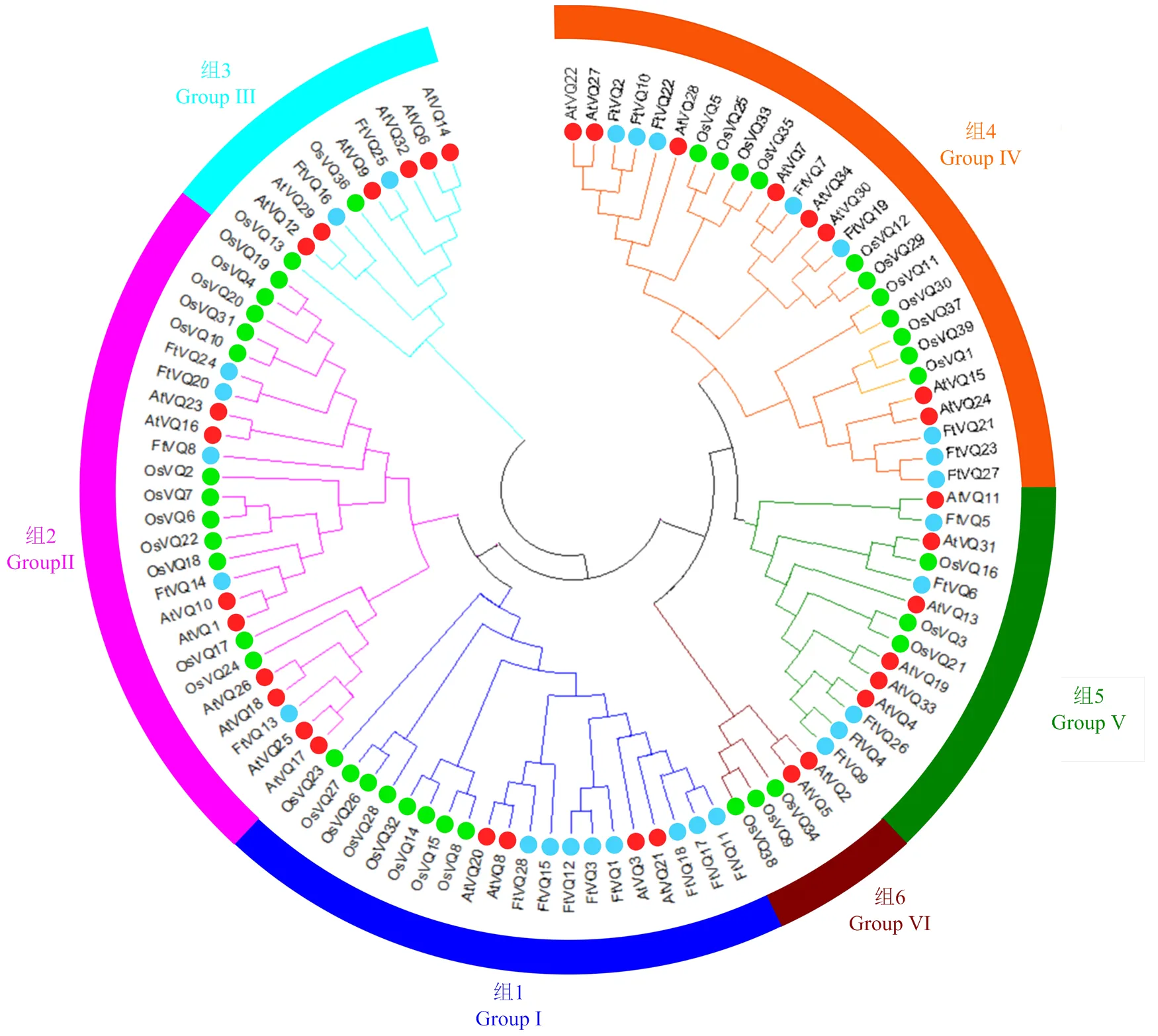
红、绿和蓝颜色分别表示拟南芥、水稻和苦荞的VQ蛋白

表2 苦荞旁系同源VQ基因
2.5 苦荞VQ基因启动子顺式元件分析
选取苦荞VQ基因起始密码子上游1 500 bp作为启动子序列,通过PLACE和PlantCARE,在线预测基因启动子区域中的顺式作用元件,主要考察病原和防御相关激素反应元件,包括病原响应元件BIHD1OS(TGTCA)、WBBOXPCWRKY1(TTTGACY),SA和病原响应元件WBOXATNPR1(TTGAC),JA、ET和H2O2响应元件CGCGBOXAT((A/C/G)CGCG(G/T/C)),JA反应元件CGTCA,以及ET反应元件ERELEA4(AWTTCAAA)。结果表明,W-box类似元件—— WBOXATNPR1在28个苦荞VQ基因的启动子区域均有不同程度的分布;其次是BIHD1OS、CGTCA和ERELEA4,在28个苦荞VQ基因启动子中的分布数量分别为20、18和17;W-box——WBBOXPCWRKY1在12个苦荞VQ基因启动子中均有分布(图6)。其中、、、、、等基因拥有较多且局部相对密集的病原或激素响应元件。病原与防御激素反应元件在苦荞VQ基因启动子区域中富集,提示苦荞VQ基因的表达可能响应病原侵染和这些激素信号的刺激。
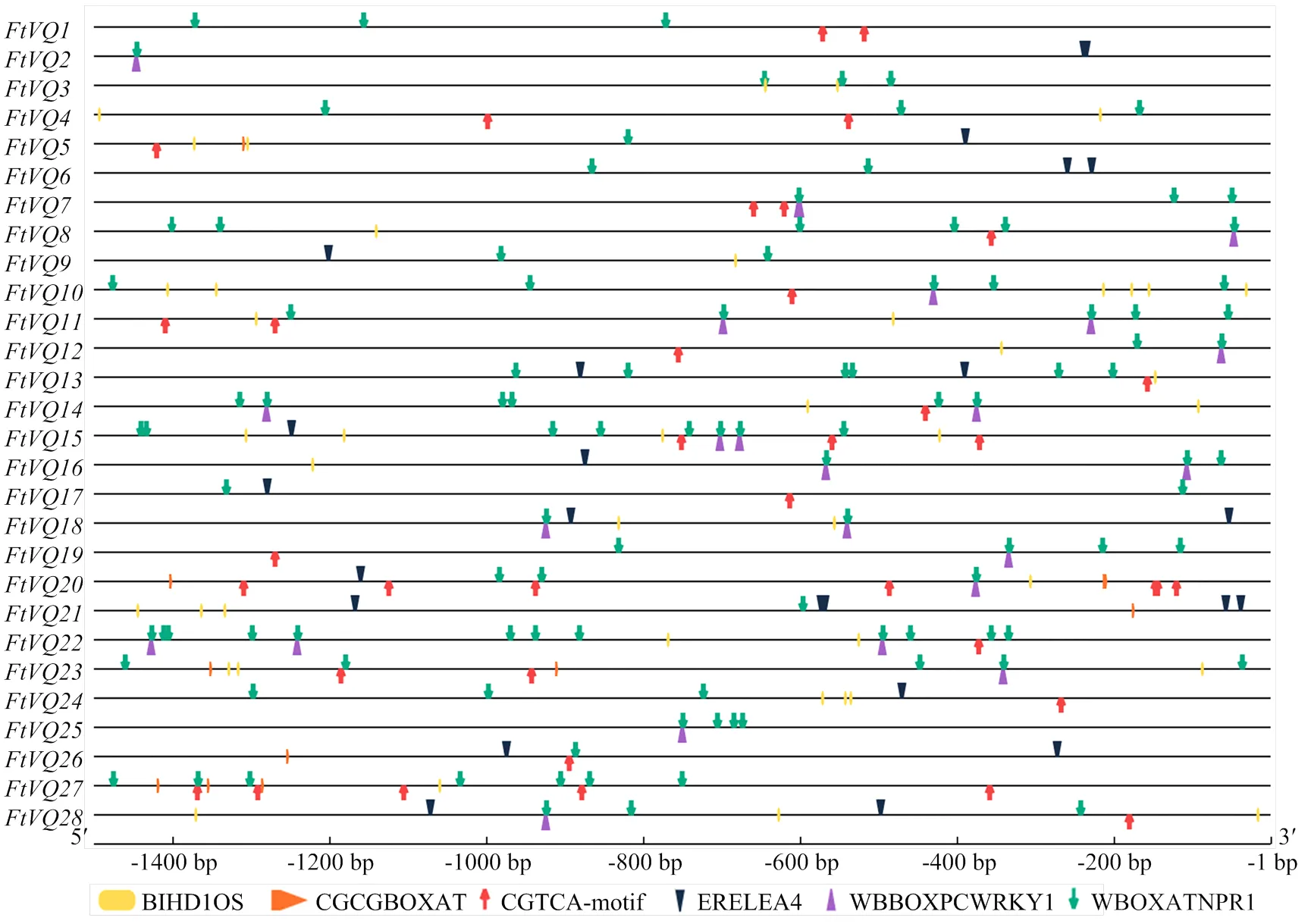
图6 苦荞VQ基因启动子顺式元件分析
2.6 苦荞VQ基因在叶斑病原侵染和激素处理下的表达分析
采用qPCR技术分析苦荞VQ基因家族成员在、侵染和SA、MeJA、ETH处理下的表达情况(图7)。结果表明,在28个苦荞VQ基因中,20个基因可以检测到不同程度的表达,而其他8个基因(、、、、、、和)的表达未能被检测到。
在侵染下,55%(11/20)的VQ基因为差异表达基因,其中8个基因表现为上调,以、、和上调程度最为显著。3个基因(、和)的表达受到抑制,以最为显著。在接种后,11个苦荞VQ基因的表达上调,以诱导程度最高;其次是、、和。2个基因(和)的表达下调。有趣的是,在和侵染下,有7个基因(、、、、、和)表达上调趋势相同,推测它们在对这两种叶斑病原的防御反应中均可能起作用。
SA、JA和ET是植物抗病防御相关的3种重要的激素信号分子,它们广泛介导植物对各种生物胁迫的响应[6]。75%(15/20)的苦荞VQ基因响应SA处理,其中,10个基因表达上调。是上调最显著的基因其次是和。在MeJA处理下,65%(13/20)的苦荞VQ基因的表达被诱导,以、和的诱导最为显著,其次是、、和。13个苦荞VQ基因响应ETH处理,其中12个基因的表达为上调,其中、、和的表达上调幅度较大。有趣的是,在被ETH诱导的VQ基因中,有8个(、、、、、、和)与MeJA是相同的。上述发现进一步提示,部分苦荞VQ基因可能介导了苦荞对叶斑病原的抗性反应。
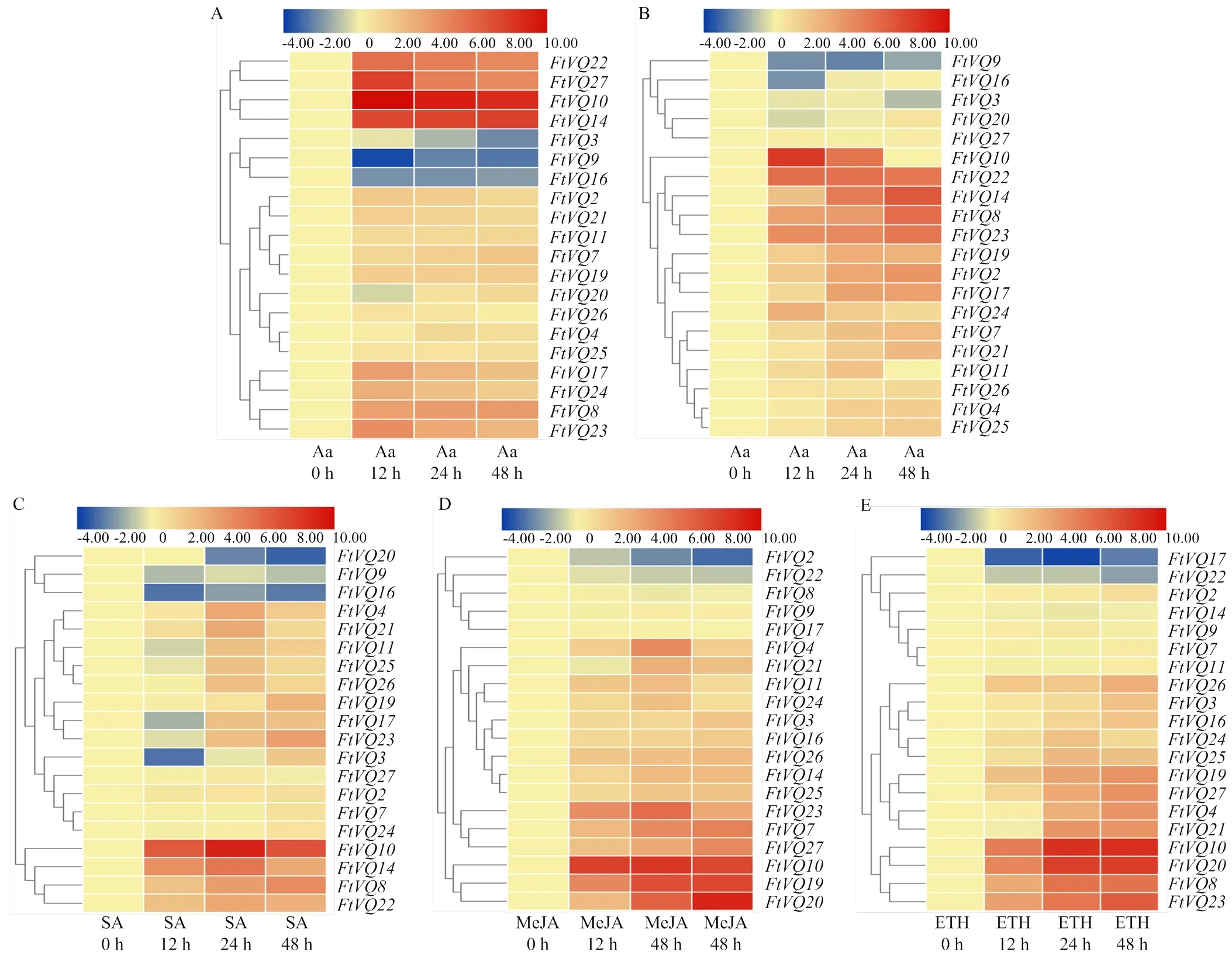
A:互格链格孢(Aa);B:黑孢霉(No);C:水杨酸(SA);D:茉莉酸甲酯(MeJA);E:乙烯利(ETH)。图上部的颜色尺表示不同表达数值的log2值,蓝色表示低表达水平,红色表示高表达水平
3 讨论
3.1 苦荞VQ基因数量与基因重复
本研究利用生物信息学工具对苦荞VQ基因家族进行了全面系统鉴定,共鉴定获得了28个苦荞VQ基因。Zhang等[5]未将FtPinG0003287200()注释为VQ基因,疑为漏注,因为FtVQ27的确含有典型的VQ基序(图3)苦荞基因组(489 Mb)比拟南芥(125 Mb)和水稻(389 Mb)大,然而其VQ基因家族成员却比拟南芥(34个)[3]和水稻(40个)[8]少,因此,植物中VQ基因数量与基因组大小无简单的线性关系。葡萄基因组475 Mb,其VQ基因仅18个[17];大豆基因组比玉米基因组小,然而其VQ基因数量(74个)[9]却比玉米(61个)[15]多。可能是远古时代的植物基因组重复事件造成的。例如,大豆在接近14和42 mya前经历了2次大规模的基因组重复事件。事实上75%的大豆VQ基因有一个或多个在结构上十分类似的旁系同源物[8]。尽管苦荞基因组为64.42—70.77 mya同样经历了全基因组重复事件,然而在其后频繁的染色体区域的重排过程中,重复的基因拷贝多数丢失或移至新的位点[5]。基因重复分析的结果证明了这一点,在苦荞VQ基因家族中,有8对旁系同源基因,其中无一串联重复(表2)。包括串联和大片段重复在内的基因重复事件是基因家族成员数量扩张的重要原因[25],由于重复基因在染色体上所处微环境的进化压力不同,在进化过程中产生分歧,形成新的基因;或者失去功能,导致假基因的产生;或者在染色体重排中丢失。在陆地棉的At和Dt亚基因组中,分别有60.5%和63.0%的VQ基因是重复基因[18]。因此,可以推测,大片段基因重复在苦荞VQ基因进化和数量扩张中扮演了重要角色。在杨树[14]、蒺藜苜蓿[21]和甜瓜[26]VQ基因家族的进化分析中也有类似结论。Ka/Ks是分析基因重复事件中选择压力的基础[24]。所有的8对苦荞VQ旁系同源基因的Ka/Ks值小于1(表2),提示它们在进化中承受了纯化选择或负选择。
3.2 苦荞VQ蛋白家族的系统进化
VQ蛋白的结构保守性在单、双子叶植物产生分歧之前就已经建立。一些真菌中也发现了VQ基因[27]。苦荞、拟南芥和水稻VQ蛋白家族的系统进化分析表明,VQ蛋白分为6个亚家族,单、双子叶植物的VQ基因在各个亚家族中均有不同数量的分布(图5),一方面说明VQ基因在进化上的保守性,另一方面也反映了不同物种的VQ基因沿着多样化进化路线发展,造成了除VQ结构域以外的结构多样化,这与VQ基因在功能上的多样性相适应。在苦荞和拟南芥基因组中发现了5对直系同源基因,在苦荞和水稻基因组中发现了3对直系同源基因(电子附表2),提示这些存在于不同物种中的直系同源基因来自于共同的祖先基因;它们之间的Ka/Ks均小于1(表2),表明它们经历了纯化选择或负选择。苦荞与拟南芥的VQ蛋白,以及种内(特别是水稻)的VQ蛋白倾向于聚类在一起,表明祖先VQ基因在单、双子叶植物中发生了进化分歧。有趣的是,苦荞VQ蛋白在结构上的多样性似乎不如拟南芥和水稻。这可以从以下3个方面加以说明。首先,在3个物种的VQ蛋白进化树中,第Ⅳ组包含拟南芥和水稻VQ蛋白,而不含苦荞VQ蛋白(图5)。其次,无内含子是植物中大多数VQ基因的共同特征[2],在已鉴定的植物VQ基因家族中或多或少存在含内含子的VQ基因。然而苦荞VQ基因均不含内含子,提示在苦荞VQ基因的进化过程中,发生了内含子的丢失现象。Song等[15]根据玉米中6个含有内含子的VQ基因在与拟南芥和水稻VQ基因的进化树中分散分布,提出在玉米、拟南芥和水稻中VQ基因内含子是最近且相对独立地获得的观点。苦荞VQ基因无内含子的结果不支持这种假设。
3.3 部分苦荞VQ基因在病原及激素处理下的表达上调
一些植物的VQ基因在病原侵染下被诱导表达。Li等[8]证实,部分水稻VQ基因的表达受白叶枯病菌(pv.)、条斑病菌(.pv.)和稻瘟病菌()诱导。在25个草莓VQ基因中,有14个基因的转录水平在炭疽病菌(spp.)自然侵染的组织中明显上调[19]。生化和遗传分析表明,VQ蛋白是植物防御过程中的重要调节者[2]。Uji等[28]证明,OsVQ13在水稻对白叶枯病的抗性中发挥正调节子的功能。本研究中,分别有8和11个苦荞VQ基因在和的侵染下转录水平显著提升,其中有7个基因是相同的,提示这些VQ基因可能参与了苦荞对叶斑病的抗病反应。、和的表达上调程度最为明显,这些基因在苦荞对叶斑病的抗性反应中的作用值得关注。
植物VQ基因参与抗病防御往往与SA、JA与ET激素信号密切关联。在杨树中,部分VQ基因响应SA处理[14]。在大豆中,大部分的VQ基因至少在一个处理时间点受SA 2倍以上的诱导,一些VQ基因响应JA和ET[9]。类似的结果在拟南芥[3]和草莓[19]中也有发现。本研究中,分别有55%、60%和55%的苦荞VQ基因在SA、MeJA和ETH处理下表达上调(图7)。SA和JA信号通路间通常拮抗,JA和ET信号通路往往协同[6]。本研究表明,多个VQ基因的表达单独受SA、JA或ET的影响,也有成员受2种甚至3种激素的共同影响,从侧面也印证了这些激素之间的协同或拮抗关系。例如,受SA和ETH诱导,受SA和MeJA诱导,受MeJA和ETH诱导,提示这些基因可能通过相应的激素信号或组合参与对叶斑病的抗性反应。值得注意的是,和同时在2种病原和3种激素的处理下显著上调,至于它们是否通过SA、JA/ET信号的协同作用参与对叶斑病原的防御反应有待进一步的研究。
在苦荞旁系同源的VQ基因对中,表达不尽相同。例如,在SA处理下,的表达上调,而其旁系同源基因的表达却下调。在和侵染下,的表达被显著诱导,而其旁系同源基因的表达则无明显变化(图7)。这可能是因为它们所处的启动子环境不同有关。在杨树[14]和大白菜[16]VQ基因中,一些旁系同源基因有相似的表达特征,也有一些基因的表达存在明显差异。
3.4 响应叶斑病原的苦荞VQ基因启动子中富集W-box
基因对多种环境刺激的响应与其启动子区域的顺式元件类型与排列密切相关。本研究中,苦荞VQ基因启动子顺式元件预测从侧面印证了基因表达分析的结果,尽管这些元件的数量与基因的表达强度之间不存在很好的对应关系。在响应激素或病原处理的苦荞基因中含有相当数量的激素或病原反应元件,如受显著诱导的、含有15个这样的反应元件(图6)。值得指出的是,在响应和的14个苦荞VQ基因的启动子中,存在相当数量的W-box及类似元件(WBBOXPCWRKY1和WBOXATNPR1),平均每个启动子达4.9个(图6)。资料表明,在受SA和病原诱导的拟南芥VQ基因的启动子序列中,W-box元件平均接近3.8,高于统计学预期[3]。已知,W-box及类似元件是WRKY转录因子特异性的结合位点[29]。VQ蛋白可与第Ⅰ组WRKY或第Ⅱ组WRKY的C端WRKY结构域互作[3]。该类元件在响应病原的苦荞VQ基因的启动区域富集,一方面印证了这些基因在病原侵染下的表达特征(图7);另一方面也暗示某些未知的WRKY蛋白可能通过结合这些VQ基因启动子中的W-box及类似元件,从而调节VQ基因的表达。有关苦荞VQ基因在叶斑病抗性反应中的详尽功能尚待研究。
4 结论
从最近公布的苦荞基因组中鉴定了28个VQ基因,归类于3个亚家族(Ⅰ—Ⅲ)。它们均不含内含子,编码蛋白也不含VH变异类型。大片段基因重复是苦荞VQ基因数量扩张的重要原因,旁系同源VQ基因的进化经历了纯化选择。55%—75%苦荞VQ基因响应SA、JA、ET或叶斑病原,其中大多数的表达显著上调,表明它们可能在苦荞对叶斑病原的防御反应中发挥重要的调节功能。
[1] Chi Y, Yang Y, Zhou Y, Zhou J, Fan B, Yu J Q, Chen Z. Protein-protein interactions in the regulation of WRKY transcription factors. Molecular Plant, 2013, 6(2): 287-300.
[2] Jing Y, Lin R. The VQ motif-containing protein family of plant- specific transcriptional regulators. Plant Physiology, 2015, 169(1): 371-378.
[3] Cheng Y, Zhou Y, Yang Y, Chi Y J, Zhou J, Chen J Y, Wang F, Fan B, Shi K, Zhou Y H, Yu J Q, Chen Z. Structural and functional analysis of VQ motif-containing proteins inas interacting proteins of WRKY transcription factors. Plant Physiology, 2012, 159(2): 810-825.
[4] Weyhe M, Eschen-Lippold L, Pecher P, Scheel D, Lee J. Ménage à trois: the complex relationships between mitogen- activated protein kinases, WRKY transcription factors, and VQ-motif- containing proteins. Plant Signaling & Behavior, 2014, 9(8): 29519.
[5] Zhang L, Li X, Ma B, Gao Q, Du H, Han Y, Li Y, Cao Y, Qi M, Zhu Y, Lu H, Ma M, Liu L, Zhou J, Nan C, Qin Y, Wang J, Cui L, Liu H, Liang C, Qiao Z. The tartary buckwheat genome provides insights into rutin biosynthesis and abiotic stress tolerance. Molecular Plant, 2017, 10(9): 1224-1237.
[6] Yang J, Duan G, Li C, Liu L, Han G, Zhang Y, Wang C. The crosstalks between jasmonic acid and other plant hormone signaling highlight the involvement of jasmonic acid as a core component in plant response to biotic and abiotic stresses. Frontiers in Plant Science, 2019, 10: 1349.
[7] Kim DY, Kwon S I, Choi C, Lee H, Ahn I, Park S R, Bae S C, Lee S C, Hwang D J. Expression analysis of rice VQ genes in response to biotic and abiotic stresses. Gene, 2013, 529(2): 208-214.
[8] Li N, Li X, Xiao J, Wang S. Comprehensive analysis of VQ motif-containing gene expression in rice defense responses to three pathogens. Plant Cell Report, 2014 33(9): 1493-1505.
[9] Zhou Y, Yang Y, Zhou X, Chi Y, Fan B, Chen Z. Structural and functional characterization of the VQ protein family and VQ protein variants from soybean. Scientific Report, 2016, 6: 34663.
[10] Liu C, Liu H, Zhou C, Timko M P. Genome-wide identification of the VQ protein gene family of tobacco (L.) and analysis of its expression in response to phytohormones and abiotic and biotic stresses. Genes, 2020, 11(3): 284.
[11] Lai Z, Li Y, Wang F, Cheng Y, Fan B, Yu J Q, Chen Z. Arabidopsis sigma factor binding proteins are activators of the WRKY33 transcription factor in plant defense. The Plant Cell, 2011, 23(10): 3824-3841.
[12] Wang H, Hu Y, Pan J, Yu D.VQ motif-containing proteins VQ12 and VQ29 negatively modulate basal defense against. Scientific Report, 2015, 5: 14185.
[13] Ali M R M, Uemura T, Ramadan A, Adachi K, Nemoto K, Nozawa A, Hoshino R, Abe H, Sawasaki T, Arimura G I. The ring-type E3 ubiquitin ligase JUL1 targets the VQ-motif protein JAV1 to coordinate jasmonate signaling. Plant Physiology, 2019, 179(4): 1273-1284.
[14] Chu W Y, Liu B, Wang Y J, Pan F, Chen Z, Yan H W, Xiang Y. Genome-wide analysis of poplar VQ gene family and expression profiling under PEG, NaCl, and SA treatments. Tree Genetics & Genomes, 2016, 12: 124.
[15] Song W, Zhao H, Zhang X, Lei L, Lai J. Genome-wide identification of VQ motif-containing proteins and their expression profiles under abiotic stresses in maize. Frontiers in Plant Science, 2016, 6: 1177.
[16] Zhang G, Wang F, Li J, Ding Q, Zhang Y, Li H, Zhang J, Gao J. Genome-wide identification and analysis of the VQ motif-containing protein family in Chinese cabbage (L. ssp.). International journal of molecular sciences, 2015, 16(12): 28683-28704.
[17] Wang M, Vannozzi A, Wang G, Zhong Y, Corso M, Cavallini E, Cheng Z M. A comprehensive survey of the grapevine VQ gene family and its transcriptional correlation with WRKY proteins. Frontiers in Plant Science, 2015, 6: 417.
[18] Chen P, Wei F, Cheng S, Ma L, Wang H, Zhang M, Mao G, Lu J, Hao P, Ahmad A, Gu L, Ma Q, Wu A, Wei H, Yu S. A comprehensive analysis of cotton VQ gene superfamily reveals their potential and extensive roles in regulating cotton abiotic stress. BMC Genomics, 2020, 21(1): 795.
[19] Garrido-Gala J, Higuera J J, Muñoz-Blanco J, Amil- Ruiz F, Caballero J L. The VQ motif-containing proteins in the diploid and octoploid strawberry. Scientific Report, 2019, 9(1): 4942.
[20] Wang Y, Liu H, Zhu D, Gao Y, Yan H, Xiang Y. Genome-wide analysis of VQ motif-containing proteins in Moso bamboo (). Planta, 2017, 246(1): 165-181.
[21] Ling L, Qu Y, Zhu J, Wang D, Guo C. Genome-wide identification and expression analysis of the VQ gene family inand. PeerJ, 2020, 8: 8471.
[22] Shen Q, Peng X X, He F, Li S Q, Xiao Z Y, Wang H H, Tang X K, Zhou M L. First report ofcausing leaf spot on tartary buckwheat in China. Plant Disease, 2020. doi: 10.1094/PDIS-08-20-1773-PDN.
[23] Lynch M, Conery J S. The evolutionary fate and consequences of duplicate genes. Science, 2000, 290(5494): 1151-1155.
[24] Li W H, Gojobori T, Nei M. Pseudogenes as a paradigm of neutral evolution. Nature, 1981, 292: 237-239.
[25] Storz J F. Genome evolution: gene duplication and the resolution of adaptive conflict. Heredity, 2009, 102(2): 99-100.
[26] ZHANG G, WEI B. Characterization of VQ motif-containing protein family and their expression patterns under phytohormones and abiotic stresses in melon (L.). Plant Growth Regulation, 2019, 89(3): 273-285.
[27] Jiang S Y, Sevugan M, Ramachandran S. Valine-glutamine (VQ) motif coding genes are ancient and non-plant-specific with comprehensive expression regulation by various biotic and abiotic stress. BMC Genomics, 2018, 19: 342.
[28] Uji Y, Kashihara K, Kiyama H, Mochizuki S, Akimitsu K, Gomi K. Jasmonic acid-induced VQ-motif-containing protein OsVQ13 influences the OsWRKY45 signaling pathway and grain size by associating with OsMPK6 in rice. International Journal of Molecular Science, 2019, 20: 2917.
[29] Eulgem T, Rushton P J, Robatzek S, Somssich I E. The WRKY superfamily of plant transcription factors. Trends in Plant Science, 2000, 5(5): 199-206.
Genome-Wide Identification of VQ Gene Family inand its Expression Profiles in Response to Leaf Spot Pathogens
ZHENG Fengsheng1, WANG Haihua1,2, WU Qingtao1, SHEN Quan1,2, TIAN Jianhong1, PENG Xixu1,3, TANG Xinke1,3
1School of Life Science, Hunan University of Science and Technology, Xiangtan 411201, Hunan;2Key Laboratory of Genetic Improvement and Multiple Utilization of Economic Crops in Hunan Province, Xiangtan 411201, Hunan;3Key Laboratory of Ecological Remediation and Safe Utilization of Heavy Metal-polluted Soils, College of Hunan Province, Xiangtan 411201, Hunan
【】VQ gene family plays important roles in plant growth, development and responses to biotic or abiotic stress. The aim of this study is to comprehensively identifyL. Gaertn. VQ (FtVQ) gene family on genome-wide scale and analyze its expression profiles under challenge of leaf spot pathogensand,and treatment of defense-related hormones, such as salicylic acid (SA), jasmonic acid (JA) and ethylene (ET), thus providing a solid foundation not only for further elucidation possible roles of members of the VQ genes in defense response to leaf spot pathogens and underlying mechanisms in tartary buckwheat, but also for mining gene resources of breeding for crop disease resistance. 【】Based on the Hidden Markov Model profile of the conserved VQ domain (PF05678), HMMER 3.0 software was used to identify FtVQ genes fromcv. Pinku1 genome database. Bioinformatic tools such as DNAMAN, MapInspect, MEGA, MEME, OrthoFinder and PLACE were used to analyze gene structure, chromosomal location of genes,-elements of gene promoters, physicochemical properties of proteins, conserved motifs of proteins, subcellular localization of proteins, and phylogenetic relationships. Quantitative real-time PCR (qPCR) was employed to analyze the expression profiles of leaf FtVQ genes of tartary buckwheat plants under infection of the pathogens and treatment of the hormones. 【】A total of 28 VQgenes were identified in the genomes of tartary buckwheat, with the gene size ranging from 566 to 1454 bp. The FtVQ genes contain no introns, and distribute unevenly on chromosomes 1-8. According to their physical locations on the chromosomes, the FtVQ genes were named fromto. Each of the FtVQ proteins has a highly conserved VQ motif FxxxVQx (L/F/I/V/A/Y) TG, where x represents any amino acid. Analysis of subcellular localization showed that 21 FtVQ proteins were predicted to the nucleus, and the others to the chloroplasts or cytoplasm. Based upon their amino acid sequence and presence of various conserved motifs, the FtVQ proteins were classified into five subfamilies (Ⅰ-Ⅴ). Each subfamily shared relatively conserved gene structures and protein motifs. The analysis of gene duplication revealed thatgenome had 8 pairs of paralogous pairs, all of which were segmental duplicated genes, suggesting that segmental duplication played major roles in FtVQ gene expansion. The ratio of nonsynonymous to synonymous substitutions (Ka/Ks) of paralogous pairs was less than 1, suggesting that they underwent purifying pressure during the evolution process. Prediction of-elements showed that pathogen-, SA-, JA-, or ET-responsive elements, such as BIHD1OS, CGTCA, ERELEA4, W-box and W-box-like sequences, were present within the promoters of all the FtVQ genes. Especially,,,,,andcontained more elements in their promoter regions. 55% to 70% of the detectablegenes were differentially expressed genes (DEGs), and 72.7% to 85.7% of the DEGs were significantly induced on the level of transcription under the infection of leaf spot fungiand, or the treatment of SA, methyl jasmonate and ethephon. 【】The tartary buckwheat genome contains 28 members of VQ gene family. Some FtVQ genes may be involved tartary buckwheat defense response to leaf spot pathogens.
tartary buckwheat ((L.) Gaertn.); VQ gene family;leaf spot;leaf spot; defense-related hormones

10.3864/j.issn.0578-1752.2021.19.002
2021-02-25;
2021-06-07
国家重点研发计划(2017YFE0117600)、湖南省教育厅重点科研项目(19A176)
郑逢盛,E-mail:13647321087@163.com。通信作者王海华,Tel:0731-58291524;E-mail:hhwang@hnust.edu.cn。通信作者唐新科,Tel:0731-58290476;E-mail:xinketang@126.com
(责任编辑 李莉)

