猪I型补体受体与C3b活性片段相互结合的体外检测
孙雨晨,贾瑞璞,范阔海,孙娜,孙耀贵,孙盼盼,李宏全,尹伟
猪I型补体受体与C3b活性片段相互结合的体外检测
孙雨晨,贾瑞璞,范阔海,孙娜,孙耀贵,孙盼盼,李宏全,尹伟
山西农业大学动物医学学院,山西太谷 030801
【】检测猪红细胞类补体受体I型(Complement receptor 1-like,CR1-like)与C3b活性片段能否发生结合,以期为阐明猪红细胞发挥免疫粘附功能的分子机理提供科学数据。利用前期已构建的CR1-like、CR1-like功能域片段的重组质粒建立酵母双杂交检测体系,运用酵母共转化的方法将诱饵质粒(重组pGBKT7-CR1-like)与捕获质粒(重组pGADT7-C3b)共同转入Y2HGold酵母细胞中,分别利用一缺平板SD/-Leu、SD/-Trp和二缺平板SD/-Leu/-Trp(DDO)严格筛选共转化成功的酵母细胞,再根据报告因子是否表达来鉴别转化子在SD/-Leu/-Trp/X-α-Gal(DDO/X)、SD/-Leu/-Trp/X-α-Gal/Aba(DDO/X/A)二缺培养板上的生长情况,并结合菌落的颜色变化现象综合判定CR1-like活性片段与补体C3b在酵母细胞中是否发生相互结合;然后运用免疫沉淀技术分离酵母细胞中CR1-like与C3b结合复合物,并对该复合物的特异性进行Western blot鉴定。试验成功将pGBKT7-CR1-like与pGADT7-C3b基因共转入Y2HGold酵母细胞。共转化的酵母克隆在SD/-Leu、SD/-Trp、DDO平板上能够正常生长,在DDO/X、DDO/X/A平板上正常生长且菌落呈现蓝色,由此表明,试验中酵母双杂交系统建立成功,并通过试验获得了阳性酵母克隆。共同转化了pGBKT7-CR1-like和pGADT7-C3b质粒的酵母菌落PCR反向鉴定结果显示,在共转化的酵母菌中含有目的基因CR1-like和CR1-like,共转化组的质粒酶切后出现C3b基因片段,与设计大小一致,说明重组质粒成功共转化入酵母细胞中。免疫沉淀试验中应用pGBKT7载体的标签抗体c-Myc沉淀酵母细胞中的融合蛋白,以c-Myc为一抗进行Western blot检测发现,单独转化了pGBKT7-CR1-like(3-6)和pGBKT7-CR1-like(8-11)的融合蛋白在50 kD处出现特异性条带;共转化pGBKT7-CR1-like(3-6)+ pGADT7-C3b和共转化pGBKT7-CR1-like(8-11)+ pGADT7-C3b的酵母融合蛋白在83 kD处出现特异性条带;以HA单克隆抗体为一抗进行Western blot检测时,在pGBKT7-CR1-like(3-6)和pGBKT7-CR1-like(8-11)融合蛋白中没有出现特异性条带,只有3、4泳道中共转化的酵母融合蛋白在83 kD处出现特异性条带,表明在Y2HGold酵母细胞中存在CR1-like与C3b识别结合的复合物。使用CR1-like单克隆抗体沉淀酵母细胞中的融合蛋白,以CR1-like单克隆抗体为一抗进行Western blot检测发现,单独转化了pGBKT7-CR1-like(3-6)和pGBKT7-CR1-like(8-11)的融合蛋白在50 kD处出现特异性条带;共转化pGBKT7-CR1-like(3-6)+ pGADT7-C3b和共转化pGBKT7-CR1-like(8-11)+ pGADT7-C3b的酵母融合蛋白在83 kD处出现特异性条带;以C3单克隆抗体为一抗进行Western blot检测发现,在pGBKT7-CR1-like(3-6)和pGBKT7-CR1-like(8-11)融合蛋白中没有出现特异性条带,泳道3、4所示只有共转化的酵母融合蛋白在83 kD处出现特异性条带,表明在Y2HGold酵母细胞中存在具有生物活性的CR1-like与C3b识别结合的复合物。通过多个单克隆抗体杂交结果,可看出诱饵质粒的表达产物CR1-like、CR1-like片段与捕获质粒的表达产物C3b片段可在酵母细胞内发生结合。猪红细胞CR1-like发挥免疫粘附功能的识别配体为C3b,为猪红细胞CR1-like功能域分子结构的进一步解析提供了重要数据依据。
CR1-like;C3b;酵母双杂交;免疫粘附
0 引言
【研究意义】中国是猪肉消费和生产大国[1],养猪业是我国农业经济的重要支柱。近年来,猪病尤其是非洲猪瘟[2-3]、猪繁殖与呼吸系统综合征[4]、猪流感[5]等免疫抑制性疫病的发生严重影响着养猪业的健康发展。先天免疫系统是猪抵抗疫病的重要防御力量,而猪红细胞免疫是机体先天免疫防御系统的重要组成部分。因此,深入研究猪红细胞免疫功能分子机理及其与疫病发生、发展、转归之间的关系对于猪病防控具有科学意义和实践价值。【前人研究进展】人类医学对红细胞免疫粘附的分子基础和机制进行了深入研究,研究结果证实红细胞膜上的Ⅰ型补体受体(erythrocyte complement receptor 1,ECR1)是红细胞发挥免疫粘附功能最重要的物质基础。在CR1的介导下,红细胞免疫功能与阿尔兹海默氏症[6-7]、疟原虫感染[8-10]、慢性自身免疫性疾病[11-14]、老年性黄斑变性[15]等免疫抑制性疾病的发生发展具有密切关系。例如,CRANE等[16]研究发现Aβ在血液中形成Aβ-ICs,可以提高Aβ与补体系统中活性片段的相互作用,主要是与C1q相互结合,红细胞的粘附以及巨噬细胞的吞噬同样也会增加,进而提高机体对Aβ-IC的清除能力,与这些体外的结果相一致的是,在非人灵长类动物体内静脉注射Aβ抗体形成Aβ-ICs后,血液中Aβ的清除也明显增强。BRUBAKER等[17]进一步研究发现,猕猴的红细胞可以免疫粘附体内的β淀粉样蛋白,促进血液中β淀粉样蛋白的清除,这种灵长类动物红细胞捕获IC的清除机制在IC沉积介导的疾病中是至关重要的。起初人们认为这种红细胞免疫粘附受体是灵长类动物所特有的,随着研究人员不断的探索,发现在禽类、鱼类、啮齿类以及哺乳动物的红细胞也具有免疫粘附功能,且与动物疫病的发生具有相关性。鸡感染马立克病病毒后,与鸡红细胞相关的多种免疫基因均发生了显著的免疫应答,推测鸡红细胞发挥一定的免疫调控作用[18]。郑世民等[19]研究发现雏鸭在感染了禽流感病毒后,鸭的红细胞C3b受体花环率(red blood cell C3b receptor rate,RBC-C3bRR)对比未感染组显著降低,而红细胞免疫复合物花环率(red blood cell immune complex rate,RBC-ICR)则明显升高,导致雏鸭外周血免疫功能下降。NOMBELA等[20]对感染了病毒性败血症出血病毒的虹鳟鱼红细胞进行检测,发现虹鳟鱼红细胞产生了有效的抗病毒免疫反应。卫含伟等[21]用改良的保存液处理红细胞后可通过激活HIF-1α信号通路促进糖尿病小鼠的伤口愈合。本课题组前期研究发现,猪红细胞免疫粘附受体也是一类糖蛋白,分子量95—110 kD具有分子量多态性[22-23],称作红细胞类补体受体I型(Erythrocyte complement receptor 1-like,ECR1-like)。ecr1-like通过与猪红细胞膜蛋白4.1的相互结合而分布于猪红细胞膜表面[24]。在ECR1-like的介导下,猪红细胞能够免疫粘附致敏免疫复合物,推测ECR1-like免疫粘附功能的发挥与血清C3b有关。体外研究进一步发现猪肺泡巨噬细胞能够与粘附有致敏复合物的猪红细胞相互作用并将致敏复合物捕获[25]。【本研究切入点】动物红细胞作为机体先天免疫防御的重要组成在抵抗动物疫病中发挥着重要作用。但是,动物红细胞发挥免疫功能的分子机理尚有一些科学问题未能解决,尤其是介导动物红细胞发挥免疫粘附功能的分子基础尚不明了。【拟解决的关键问题】笔者所在的课题组综合运用生物信息学、基因工程等技术手段成功筛出ECR1-like的第3—6功能域片段、第8—11功能域片段及猪血清C3b活性片段目标序列,并构建了捕获载体及诱饵载体[26]。在此基础上本试验继续围绕“猪ECR1-like是否与猪血清C3b片段发生相互结合”这一科学问题开展研究,拟运用酵母双杂交技术和免疫沉淀技术对缺省培养基筛选的阳性克隆进行鉴定,定性分析ECR1-like与C3b在酵母细胞内的识别结合关系。
1 材料与方法
本试验于2019—2020年在山西农业大学动物医学学院临床兽医学实验室完成。
1.1 质粒与宿主菌
用于酵母细胞共转化试验:酵母细胞株Y2HGold、Y187(TaKaRa,中国),DH5α感受态细胞(天根,中国)。
用于酵母杂交试验:酵母双杂交诱饵质粒pGBKT7-CR1-like(3-6)、pGBKT7-CR1-like(8-11)(山西农业大学动物医学学院临床兽医学实验室构建)[26]。
1.2 主要试剂
用于酵母细胞共转化试验:E.Z.N.A.TMPlasmid Mini Kit I、E.Z.N.A.TMGel Extraction胶回收试剂盒(Omega,中国),限制性内切酶R I、I、I、H I、T4 DNA Ligase连接酶、卡那霉素、氨苄青霉素和50×TAE(Solarbio,中国),10 000×Super Gel Red核酸凝胶染料(Everbrite,美国),5 000 bp DNA Marker(中科瑞泰,中国)。
用于酵母杂交试验:Matchmaker®Gold Yeast Two-Hybrid System酵母双杂交试剂盒(TaKaRa,中国)。
用于酵母总蛋白提取和Western blot试验:Yeast maker Yeast Transformation System 2、Yeast Protein Extraction Reagent酵母总蛋白提取试剂盒、Yeast Media Set 2 Plus试剂盒(TaKaRa,中国),BeaverBeads™ Protein A/G Immunoprecipitation(海狸生物,中国)。
1.3 主要仪器
用于酵母细胞共转化试验:洁净工作台(博讯,中国),恒温金属浴(博日,中国),PCR仪(Bio-Rad,美国),核酸蛋白浓度分析测定仪(NanoDrop,美国),凝胶成像仪(Invitrogen,美国),高速冷冻离心机(Sigma,美国),超低温冰箱(中科美菱,中国)。
用于酵母总蛋白提取和Western blot试验:恒温振荡培养器(智城,中国),可调式移液器(Eppendorf,德国),数显恒温水浴锅(金城国胜,中国)。
用于酵母杂交试验:电子分析天平(Sartooeius,德国),立式压力蒸汽灭菌器(江阴滨江,中国),生化培养箱(跃进,中国)。
1.4 CR1-like结合C3b活性片段的酵母双杂交鉴定
1.4.1 质粒共转化 使用Clontech公司的Yeastmaker Yeast Transformation System 2试剂盒将pGBKT7- CR1-like和pGADT7-C3b共同转化入Y2HGold酵母感受态细胞中,主要步骤包括:取Yeast maker Carrier DNA置于95℃水浴变性3 min,然后迅速冰浴,重复3次。取1.5 mL EP管,加入Yeast maker Carrier DNA(10 mg·mL-1)5 µL、重组质粒pGBKT7-CR1-like和pGADT7-C3b各0.1 µg、Y2HGold酵母感受态细胞50 µL,轻轻混匀三者。然后加入500 µL PEG/LiAc溶液,轻轻混匀。30℃、200 r/min振荡培养30 min。加入20 µL DMSO试剂均匀混合,置于42℃金属浴中热休克15 min,每5 min摇动混匀。12 000 r/min离心15 s,去上清。加入1 mL YPD Plus液体培养基重悬细胞,30℃、200 r/min振荡培养90 min,12 000 r/min离心15 s,去上清。用1 mL 0.9% NaCl溶液重悬酵母细胞。提前配制100 mL包含Kana(50 mg·mL-1)的SD/-Trp选择性培养基,各取200 µL菌液涂布于5个SD/-Trp选择性平板,30℃正置30 min,再倒置培养4 d,至白色且大小均匀的克隆菌落出现。挑取单菌落于5 mL YPDA中,30℃、250 r/min培养24 h。分别收集100 µL菌液以浓度为0.9%的NaCl进行1﹕10 000稀释,涂布于SD/-Leu、SD/-Trp、SD/-Leu/-Trp(DDO)、SD/-Leu/-Trp/X-α-Gal(DDO/X)和SD/-Leu/-Trp/X-α- Gal/Aba(DDO/X/A)平板上30℃培养4 d,观察菌落的生长情况和颜色变化。
重组质粒共转化酵母细胞后,对共转化组进行菌落PCR,验证质粒是否成功转入酵母细胞:在平板上挑取单菌落于含有10 μL超纯水的EP管中,95℃变性5 min,5 000 r/min离心1 min。取上清作为PCR模板,按照前期的PCR反应体系进行[26],1%琼脂糖凝胶电泳检测目的条带,验证CR1-like基因是否转入酵母细胞中。再根据TIANprep Yeast Plasmid DNA Kit酵母质粒提取试剂盒说明书提取共转化组的酵母质粒,按照前期的双酶切反应体系[26],验证共转酵母中是否转入C3b基因。
1.4.2 酵母杂交 按照前期的方法将对照质粒各自转化入对应的菌株[26](表1)。

表1 酵母杂交
将转化后的Y2HGold酵母细胞液涂布于SD/-Trp(50 μg·mL-1Kana)固体培养基,Y187酵母细胞液涂布于SD/-Leu(100 mg·mL-1Amp)固体培养基,30℃培养4 d。
分别挑取包含pGBKT7-53的Y2HGold酵母细胞和包含pGADT7-T的Y187酵母细胞于同一管装有500 µL 2×YPDA培养基的1.5 mL EP管中,涡旋混匀酵母细胞,30℃,200 r/min振荡培养24 h。取100 µL菌液用0.9%的NaCl进行1﹕10 000稀释后,各取100 µL菌液涂布于SD/-Leu、SD/-Trp、DDO、DDO/ X/A、SD/-Ade/-His/-Leu/-Trp/X-α-Gal/Aba(QDO/X/A)平板上30℃培养4 d,观察菌落的生长情况及菌落的生长颜色。
阴性组处理同上。
1.5 酵母总蛋白的抽提及Western blot鉴定
1.5.1 酵母总蛋白的提取 按照Yeast Protein Extraction Reagent试剂盒的说明书提取酵母总蛋白。主要步骤包括:从转化了pGBKT7-CR1-like(3-6)、pGBKT7-CR1-like(8-11)的酵母培养平板上分别挑取一个直径为2 mm大小的菌落于5 mL SD/-Trp液体培养基中,共转化了pGBKT7-CR1-like(3-6)+pGADT7-C3b、pGBKT7-CR1- like(8-11)+pGADT7-C3b的酵母细胞于DDO培养基,30℃,250 r/min振荡培养24 h。
吸取酵母细胞培养液1 mL至1.5 mL的EP管中,8 000 r/min,4℃离心2 min,去上清;各加入1 mL 4℃预冷的超纯水重悬菌体,8 000 r/min,4℃离心2 min,去上清;加入25 µL的Yeast Protein Extraction Reagent试剂,反复吹打,重悬沉淀;在30℃水浴中温育30 min,每10 min振荡一次;12 000 r/min,4℃离心5 min,去上清;向沉淀中加入25 µL的PBS和25 µL的2×Protein SDS PAGE Loading Buffer溶液,使沉淀重悬。
1.5.2 免疫沉淀复合物 取4个1.5 mL的EP管,标记为1、2、3、4,各加入30 µL磁珠悬液,每管中再加入200 µL结合缓冲液进行洗涤,将EP管置于磁性分离器上静置1 min进行磁性分离,弃去上清。将EP管从磁性分离器上取下后,加入200 µL的结合缓冲液重新洗涤一次。向EP管中加入200 µL结合缓冲液重悬磁珠,分别吸取5 µL c-Myc单克隆抗体加入EP管中,置于水平摇床室温20℃混合1 h后,置于磁性分离器上进行磁性分离,弃去上清。加入200 µL结合缓冲液再次洗涤。向1—4号EP管中依次加入200 µL的pGBKT7-CR1-like(3-6)、pGBKT7-CR1-like(8-11)、pGBKT7-CR1-like(3-6)+ pGADT7-C3b、pGBKT7-CR1- like(8-11)+pGADT7-C3b蛋白溶液200 µL,吹打混匀,置于水平摇床室温混合1 h后进行磁性分离,弃去上清,加入200 µL洗涤缓冲液再次洗涤。最后将磁珠悬液转移到新的EP管中,避免管壁上的抗原残留。将新的EP管置于磁性分离器进行磁性分离,弃去上清,每管各加入50 µL的1×SDS-PAGE Loading Buffer,置于95℃金属浴加热5 min,磁性分离收集上清液。
另取4个1.5 mL的EP管,将其标记为a、b、c、d,磁珠预处理后按照上述操作。每管中分别加入100 µL的CR1-like单克隆抗体进行磁珠的抗体吸附处理,处理完成依次加入pGBKT7-CR1-like(3-6)、pGBKT7- CR1-like(8-11)、pGBKT7-CR1-like(3-6)+ pGADT7-C3b、pGBKT7-CR1-like(8-11)+ pGADT7-C3b蛋白溶液200 µL进行磁珠的抗原吸附处理,最后洗脱抗原,操作方法同上。
1.5.3 酵母总蛋白的Western blot检测 按照表2、表3配制5%的浓缩胶、10%的分离胶。将胶板固定在电泳槽中,加入4℃预冷的电泳缓冲液,加样孔中依次缓缓加入蛋白Marker 5 µL、1.5.1中提取的各蛋白样品10 µL进行电泳,电压设置为80V,至样品刚跑过浓缩胶约1 h后,再调整为120V继续电泳45 min,停止电泳。
切割出所需凝胶,裁剪好与凝胶大小一致的滤纸和PVDF膜。先将PVDF膜浸泡于甲醇中进行激活,10 s后取出放入转膜缓冲液。将电转的夹子黑色为底浸泡在转膜缓冲液中,分别铺上3层滤纸,凝胶,PVDF膜和另外的3层滤纸,四周对齐。将夹子夹紧并放入转膜槽中,加入转膜缓冲液,对正电极,设置电压为60V转膜2 h。将PVDF膜取出放入脱脂奶粉封闭液中,置于水平摇床80 r/min室温封闭2 h。载有蛋白1—4号样品的两张PVDF膜分别使用c-Myc单克隆抗体(1﹕1 000稀释)和HA单克隆抗体(1﹕800稀释)4℃过夜孵育。载有蛋白a、b、c、d的两张PVDF膜分别使用CR1-like单克隆抗体(1﹕300稀释)和C3单克隆抗体(1﹕800稀释)4℃过夜孵育。弃去一抗孵育液,用TBST洗3次每次10 min;孵育二抗,一抗为c-Myc抗体和C3抗体的膜使用二抗为羊抗兔IgG,一抗为HA抗体和CR1-like抗体的膜使用二抗为兔抗鼠IgG,TBST按1﹕10 000稀释,37℃,80 r/min孵育1 h。用TBST洗3次每次10 min。按照高灵敏度化学发光检测试剂盒说明书配制发光液,在PVDF膜上敷上发光液,缓慢晃动使发光液涂抹均匀,使用滤纸吸去多余发光液,用保鲜膜覆盖,在暗室使用胶片曝光,曝光后胶片自然晾干,扫描胶片,保存图像进行分析。

表2 配制5%浓缩胶

表3 配制10%分离胶
2 结果
2.1 质粒共转化激活酵母细胞报告因子的鉴定
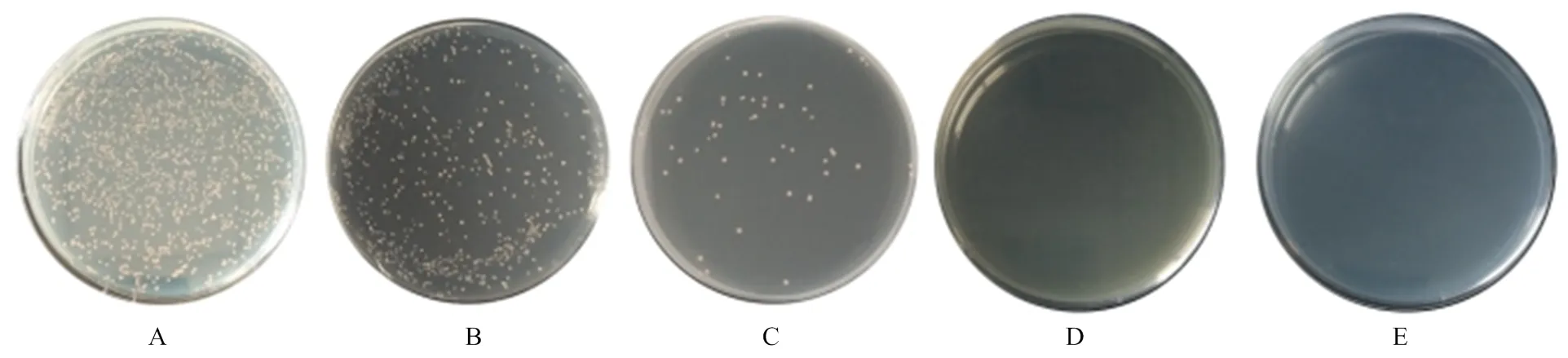
将pGBKT7-CR1-like(3-6)和pGADT7-C3b共同转入Y2HGold后,在SD/-Leu(图1-A)、SD/-Trp(图1-B)、DDO(图1-C)平板均长出白色菌落,在DDO/X(图1-D)和DDO/X/A(图1-E)平板上菌落正常生长且变为蓝色。将pGBKT7-CR1-like(8-11)和pGADT7- C3b共转化后,出现同样的结果,在SD/-Leu(图2-A)、SD/-Trp(图2-B)、DDO平板长出白色菌落(图2-C),在DDO/X(图2-D)和DDO/X/A(图2-E)平板上菌落正常生长且变为蓝色。说明猪CR1-like与C3b的识别结合激活了报告因子MEL1和AUR1-C。

A—E:共转化了pGBKT7-CR1-like(3-6)和pGADT7-C3b的酵母细胞在SD/-Leu、SD/-Trp、DDO、DDO/X、DDO/X/A培养板的生长情况

A—E:共转化了pGBKT7-CR1-like(8-11)和pGADT7-C3b的酵母细胞在SD/-Leu、SD/-Trp、DDO、DDO/X、DDO/X/A培养板的生长情况
2.2 酵母双杂交阳性对照和阴性对照培养
Y2HGold(pGBKT7-53)与Y187(pGADT7-T)进行杂交后,包含两种质粒的酵母细胞阳性对照均可以在SD/-Trp、SD/-Leu、DDO、DDO/X/A、QDO/X/A上生长。且在DDO/X/A(图3-D)、QDO/X/A(图3-E)上菌落为蓝色。Y2HGold(pGBKT7-Lam)与Y187(pGADT7-T)的酵母细胞二者杂交不能激活报告基因,酵母细胞只能在SD/-Trp(图4-A)、SD/-Leu(图4-B)、DDO上(图4-C)正常生长,在DDO/X/A(图4-D)、QDO/X/A上(图4-E)不能生长,证明本试验中酵母双杂交系统良好。
2.3 重组质粒共转化酵母的基因鉴定
共同转化pGBKT7-CR1-like和pGADT7-C3b质粒的酵母菌落PCR反向鉴定结果显示,在共转化的酵母菌(图5-A)中含有目的基因CR1-like和CR1-like,共转化组的质粒酶切后出现C3b基因片段(图5-B),与设计大小一致,说明重组质粒成功共转化入酵母细胞中。
2.4 CR1-like识别结合C3b的检测
使用pGBKT7载体的标签抗体c-Myc沉淀酵母细胞中的融合蛋白,以c-Myc为一抗进行Western blot检测发现,单独转化了pGBKT7-CR1-like(3-6)和pGBKT7- CR1-like(8-11)的融合蛋白在50 kD处出现特异性条带(图6-A)。共转化pGBKT7-CR1-like(3-6)+ pGADT7-C3b和共转化pGBKT7-CR1-like(8-11)+ pGADT7-C3b的酵母融合蛋白在83 kD处出现特异性条带(图6-B)。以HA单克隆抗体为一抗进行Western blot检测时,在pGBKT7-CR1-like(3-6)和pGBKT7-CR1-like(8-11)融合蛋白中没有出现特异性条带,只有3、4泳道中共转化的酵母融合蛋白在83 kD处出现特异性条带(图6-C)。表明在Y2HGold酵母细胞中存在CR1-like与C3b识别结合的复合物。

A—E:共转化了pGBKT7-53和pGADT7-T的酵母细胞在SD/-Leu、SD/-Trp、DDO、DDO/X/A、QDO/X/A培养板的生长情况
A—E:共转化了pGBKT7-Lam和pGADT7-T的酵母细胞在SD/-Leu、SD/-Trp、DDO、DDO/X/A、QDO/X/A培养板的生长情况

A:pGBKT7-CR1-like质粒的电泳图:M1:DL2 000 DNA Maker;1:共转pGBKT7-CR1-like(3-6);2:共转pGBKT7-CR1-like(8-11)。B:pGADT7-C3b质粒的电泳图:M2:DL5 000 DNA Marker;1、2:共转pGADT7-C3b
CR1-like单克隆抗体沉淀酵母细胞中的融合蛋白,以CR1-like单克隆抗体为一抗进行Western blot检测发现,单独转化了pGBKT7-CR1-like(3-6)和pGBKT7- CR1-like(8-11)的融合蛋白在50 kD处出现特异性条带(图7-A)。共转化pGBKT7-CR1-like(3-6)+ pGADT7- C3b和共转化pGBKT7-CR1-like(8-11)+ pGADT7-C3b的酵母融合蛋白在83 kD处出现特异性条带(图7-B)。以C3单克隆抗体为一抗进行Western blot检测时,在pGBKT7-CR1-like(3-6)和pGBKT7-CR1-like(8-11)融合蛋白中没有出现特异性条带,如泳道3、4所示只有共转化的酵母融合蛋白在83 kD处出现特异性条带(图7-B)。表明在Y2HGold酵母细胞中存在具有生物活性的CR1-like与C3b识别结合的复合物。

M:蛋白Marker;A、B:c-Myc抗体的Western blot检测;C:HA抗体的Western blot检测

M:蛋白Marker;A、B:CR1-like抗体的Western blot检测;C:C3抗体的Western blot检测
3 讨论
免疫粘附血清致敏的免疫复合物(immune complex,IC)是红细胞最主要的免疫功能,经血清致敏的IC可被红细胞I型补体受体(erythrocyte complement receptor 1,ECR1)通过与沉积在复合物上的C3b等补体片段结合,捕获复合物,将其运送到肝脾后被吞噬细胞吞噬,促进体内循环IC的清除。这种红细胞免疫粘附清除机制对阿尔兹海默氏病[27]、支原体肺炎[28]、附红细胞体病[29]、系统性红斑狼疮[12]和C3肾小球病[30]等多种疾病的发生发展过程都具有影响。猪红细胞具有免疫功能,是机体先天免疫的重要组成部分。猪红细胞膜上存在类I型补体受体(complement receptor 1-like,CR1-like),是猪红细胞发挥免疫粘附功能的重要分子基础[31]。2014年,CHENG等[32]克隆出长白猪红细胞CR1-like基因全长cDNA序列,大小为4 391 bp,包含3 996 bp的开放阅读框,37 bp的5’-非编码区和358 bp的3’-非编码区,并通过生物信息学分析得出该基因位于猪的九号染色体上(GenBank,登录号:KF 286 608),揭示了猪CR1-like蛋白是一个包含19个SCRs结构域的补体受体调控类膜糖蛋白,进一步研究显示,猪红细胞上CR1-like基因具有基因多态性[33]。2015年薛翼鹏[34]成功制备了小鼠抗猪CR1-like单克隆抗体,为后续研究猪红细胞补体受体提供了试验抗体。现已证实在体外共孵育条件下,猪红细胞与猪肺泡巨噬细胞具有相互作用,猪肺泡巨噬细胞竞争性结合猪红细胞表面所粘附的荧光大肠杆菌后,其形态未见病理变化但表面CR1-like数量显著降低[35]。综上所述,猪红细胞表面存在CR1-like,但是CR1-like介导猪红细胞发挥免疫粘附功能的分子机理尚不清楚,仅推测猪红细胞CR1-like发挥免疫功能与血清C3b有关。
本试验为了验证CR1-like与补体C3b之间的识别结合,将pGBKT7-CR1-like(3-6)+ pGADT7-C3b和pGBKT7-CR1-like(8-11)+ pGADT7-C3b共同转入酵母细胞Y2HGold中,检测酵母报告因子的表达。结果发现共转化的酵母细胞落在DDO/X和DDO/X/A平板能够正常生长且变为蓝色,说明pGBKT7-CR1-like和pGADT7-C3b表达的蛋白在酵母细胞中发生了识别结合从而激活了酵母转录因子GAL4,促使报告因子MEL1和AUR1-C发生转录,酵母细胞表达α-半乳糖苷酶和AUR1-C,使酵母在含有Aba和X-a-Gal的DDO/X/A培养板中能够抗Aba正常生长且表现为蓝色。初步证明猪pGBKT7-CR1-like(3-6)和pGBKT7- CR1-like(8-11)融合蛋白可以识别结合pGADT7-C3b融合蛋白。
本试验使用pGBKT7载体的标签抗体c-Myc免疫沉淀共转化酵母蛋白中的复合物,再使用c-Myc抗体进行Western blot,以确定CR1-like识别结合C3b复合物是否存在。结果发现单独转化的pGBKT7-CR1- like(3-6)和pGBKT7-CR1-like(8-11)融合蛋白以及共同转化的pGBKT7-CR1-like(3-6)+pGADT7-C3b和pGBKT7- CR1-like(8-11)+ pGADT7-C3b融合蛋白内均能检测到特异条带,并且条带大小与pGBKT7-CR1-like相近(pGBKT7-CR1-like(3-6)理论大小为40 kD,pGBKT7- CR1-like(8-11)理论大小为48 kD),说明c-Myc成功沉淀出复合物。当使用pGADT7载体的标签抗体HA为一抗进行Western blot发现,只在共转酵母的蛋白中出现特异条带并且与pGADT7-C3b融合蛋白的理论大小78 kD相近。对比单独转化pGBKT7-CR1-like的阴性对照可知,在pGBKT7载体的标签抗体c-Myc免疫沉淀的复合物中,存在pGADT7-C3b蛋白。说明在共转化的酵母细胞中存在CR1-like识别结合C3b的复合物。同理使用CR1-like单克隆抗体免疫沉淀复合物后,CR1-like抗体作Western blot检测发现单转和共转酵母中均有CR1-like的特异条带,条带大小与c-Myc抗体检测到的一致,说明CR1-like抗体成功沉淀出复合物,pGBKT7-CR1-like融合蛋白在酵母细胞中成功表达。当使用C3抗体进行Western blot检测后,与HA抗体检测到的结果一致,再次证明共转化酵母细胞中存在具有生物活性的CR1-like识别结合C3b复合物。值得注意的是,在共转化酵母蛋白的Western blot检测中,融合蛋白的条带分子量与pGADT7-C3b的理论值相近,并非是pGBKT7- CR1-like蛋白与pGADT7-C3b蛋白分子量的数值相加,有可能是pGBKT7-CR1-like与pGADT7-C3b之间的结合力相对较弱或结合具有可逆性,导致二者的识别结合复合物发生了分离。酵母细胞作为真菌,无法完美复制动物体内的环境,融合的GAL4结构域也有可能阻断蛋白间相互作用的部位,仅靠酵母双杂交单一技术手段来鉴别蛋白质之间的相互作用具有一定局限性,后期可以运用其他体内体外的相互作用技术方法如GST pull-down试验、生物分子荧光互补技术等深入研究。
4 结论
本试验体外条件下猪红细胞CR1-like活性片段能够与C3b活性片段发生结合,CR1-like结合C3b的区域位于第3—6功能域片段及第8—11功能域片段。
[1] 周琳, 杨祯妮, 张敏, 程广燕. 肉类全产业链损耗及可食用系参数研究. 中国农业科学, 2019, 52(21): 3934-3942. doi:10.3864/j. issn.0578-1752.2019.21.020.
ZHOU L, YANG Z N, ZHANG M, CHENG G Y. Whole-industry chain loss and edible rate of chinese meats. Scientia Agricultura Sinica, 2019, 52(51): 3934-3942. doi: 10.3864/j.issn.0578-1752.2019.21.020. (in Chinese)
[2] 罗玉子, 孙元, 王涛, 仇华吉. 非洲猪瘟: 我国养猪业的重大威胁. 中国农业科学, 2018, 51(21): 4177-4187. doi:10.3864/j.issn.0578- 1752.2018.21.016.
LUO Y Z, SUN Y, WANG T, QIU H J. African swine fever: A major threat to the Chinese swine industry. Scientia Agricultura Sinica, 2018, 51(21): 4177-4187. doi:10.3864/j.issn.0578-1752.2018.21.016. (in Chinese)
[3] 王琴. 猪瘟与非洲猪瘟对养猪业的重大冲击. 中国农业科学, 2018, 51(21): 4143-4145. doi: 10.3864/j.issn.0578-1752.2018.21. 012.
WANG Q. The impact of classical swine fever and African swine fever on pig industry. Scientia Agricultura Sinica, 2018, 51(21): 4143-4145. doi: 10.3864/j.issn.0578-1752.2018.21.012. (in Chinese)
[4] 张建武, 庄金山, 袁世山. 中国部分地区高致病性猪繁殖与呼吸综合征病毒的分子流行病学研究. 中国农业科学, 2008, 41(6): 1822-1831. doi: 10.3864/j.issn.0578-1752.2008.06.033.
ZHANG J W, ZHUANG J S, YUAN S S. Molecular epidemiology study on high pathogenic porcine reproductive and respiratory syndrome virus in some regions of China. Scientia Agricultura Sinica, 2008, 41(6): 1822-1831. doi: 10.3864/j.issn.0578-1752.2008.06.033. (in Chinese)
[5] 贾云慧, 许程志, 隋金钰, 吴运谱, 许榜丰, 陈艳, 杨焕良, 乔传玲, 陈化兰. 欧亚类禽型H1N1猪流感病毒HA蛋白的表达及免疫原性评估. 中国农业科学, 2019, 52(5): 930-938. doi:10.3864/j.issn. 0578-1752.2019.05.014.
JIA Y H, XU C Z, SUI J Y, WU Y P, XU B F, CHEN Y, YANG H L, QIAO C L, CHEN H L. Immunogenicity evaluation of eukaryotic expressing plasmids encoding HA protein of eurasian avian-like H1N1 swine influenza virus. Scientia Agricultura Sinica, 2019, 52(5): 930-938. doi:10.3864/j.issn.0578-1752.2019.05.014. (in Chinese)
[6] TAYLOR R P, LINDORFER M A, ATKINSON J P. Clearance of amyloid-beta with bispecific antibody constructs bound to erythrocytes. Alzheimer's & Dementia (New York, N Y), 2020, 6(1): e12067. doi: 10.1002/trc2.12067.
[7] ZHU X C, DAI W Z, MA T. Impacts of CR1 genetic variants on cerebrospinal fluid and neuroimaging biomarkers in Alzheimer's disease. BMC Medical Genetics, 2020, 21(1): 181. doi: 10.1186/ s12881-020-01114-x.
[8] PRAJAPATI S K, BORLON C, ROVIRA-VALLBONA E, GRUSZCZYK J, MENANT S, THAM W H, KATTENBERG J H, VILLASIS E, DE MEULENAERE K, GAMBOA D, VINETZ J, FUJITA R, XUAN X N, URBANO FERREIRA M, NIÑO C H, PATARROYO M A, SPANAKOS G, KESTENS L, ABBEELE J V D, ROSANAS-URGELL A. Complement Receptor 1 availability on red blood cell surface modulatesinvasion of human reticulocytes. Scientific Reports, 2019, 9(1): 8943.
[9] MCQUAID F, ROWE J A. Rosetting revisited: A critical look at the evidence for host erythrocyte receptors inrosetting. Parasitology, 2020, 147(1): 1-11.
[10] OCHOLA-OYIER L I, WAMAE K, OMEDO I, OGOLA C, MATHARU A, MUSABYIMANA J P, NJOGU F K, MARSH K. Few plasmodium falciparum merozoite ligand and erythrocyte receptor pairs show evidence of balancing selection. Infection Genetics & Evolution Journal of Molecular Epidemiology & Evolutionary Genetics in Infectious Diseases, 2019, 69: 235-245. doi: 10.1016/ j.meegid.2019.02.004.
[11] BARCELLINI W, ZANINONI A, GIANNOTTA J A, FATTIZZO B. New insights in autoimmune hemolytic anemia: From pathogenesis to therapy. Journal of Clinical Medicine, 2020, 9(12): 3859. doi: 10.3390/jcm9123859.
[12] KULIK L, LASKOWSKI J, RENNER B, WOOLAVER R, ZHANG L A, LYUBCHENKO T, YOU Z Y, THURMAN J M, HOLERS V M. Targeting the immune complex-bound complement C3d ligand as a novel therapy for lupus. Journal of Immunology, 2019, 203(12): 3136-3147. doi: 10.4049/jimmunol.1900620.
[13] CROW A R, KAPUR R, KOERNIG S, CAMPBELL I K, JEN C C, MOTT P J, MARJORAM D, KHAN R, KIM M, BRASSEIT J, CRUZ-LEAL Y, AMASH A, KAHLON S, YOUGBARE I, NI H, ZUERCHER A W, KASERMANN F, SEMPLE J W, LAZARUS A H. Treating murine inflammatory diseases with an anti-erythrocyte antibody. Science Translational Medicine, 2019, 11(506): eaau8217. doi: 10.1126/scitranslmed.aau8217.
[14] OLIVEIRA L C, KRETZSCHMAR G C, DOS SANTOS A C M, CAMARGO C M, NISIHARA R M, FARIAS T D J, FRANKE A, WITTIG M, SCHMIDT E, BUSCH H, PETZL-ERLER M L, BOLDT A B W. Complement receptor 1 (CR1, CD35) polymorphisms and soluble CR1: A proposed anti-inflammatory role to quench the fire of “fogo selvagem”. Frontiers in Immunology, 2019, 10: 2585. doi: 10.3389/fimmu.2019.02585.
[15] SIMMONS K T, MAZZILLI J L, MUELLER-ORTIZ S L, DOMOZHIROV A Y, GARCIA C A, ZSIGMOND E M, WETSEL R A. Complement receptor 1 (CR1/CD35)-expressing retinal pigment epithelial cells as a potential therapy for age-related macular degeneration. Molecular Immunology, 2020, 118: 91-98. doi: 10.1016/j.molimm. 2019.11.007.
[16] CRANE A, BRUBAKER W D, JOHANSSON J U, TRIGUNAITE A, CEBALLOS J, BRADT B, GLAVIS-BLOOM C, WALLACE T L, TENNER A J, ROGERS J. Peripheral complement interactions with amyloid β peptide in Alzheimer's disease: 2. Relationship to amyloid β immunotherapy. Alzheimer's & Dementia, 2018, 14(2): 243-252. doi: 10.1016/j.jalz.2017.04.015.
[17] JOHANSSON J U, BRUBAKER W D, JAVITZ H, BERGEN A W, NISHITA D, TRIGUNAITE A, CRANE A, CEBALLOS J, MASTROENI D, TENNER A J, SABBAGH M, ROGERS J. Peripheral complement interactions with amyloid β peptide in Alzheimer's disease: Polymorphisms, structure, and function of complement receptor 1. Alzheimer's & Dementia, 2018, 14(11): 1438-1449. doi: 10.1016/ j.jalz.2018.04.003.
[18] 牛胜, 李欣, 张宁, 宁官保, 张鼎, Ali Raza Jahejo, 马海利, 郝卫芳, 高文伟, 赵宇军, 高诗敏, 李桂兰, 李建慧, 闫芳, 高荣琨, 毕玉海, 韩凌霞, 田文霞. 马立克病病毒感染鸡红细胞6种免疫相关因子转录水平的鉴定. 动物医学进展, 2018, 39(12): 49-53. doi: 10.3969/j.issn.1007-5038.2018.12.010
NIU S, LI X, ZHANG N, NING G B, ZHANG D, JAHEJO A, MA H L, HAO W F, GAO W W, ZHAO Y J, GAO S M, LI G L, LI J H, YAN F, GAO R K, BI Y H, HAN L X, TIAN W X. Identification of transcription levels of six immune-related factors in chicken erythrocytes infected with marek’s disease virus. Progress in Veterinary Medicine, 2018, 39(12): 49-53. doi: 10.3969/j.issn.1007- 5038.2018.12.010. (in Chinese)
[19] 郑世民, 葛依阳, 马宏伟, 高雪丽, 刘超男, 吕晓萍. 鹅源H5N1禽流感病毒感染对雏鸭红细胞免疫功能的影响. 东北农业大学学报, 2019, 50(1): 45-51.
ZHENG S M, GE Y Y, MA H W, GAO X L, LIU C N, LV X P. Effect of goose source H5N1 avian influenza virus infection to erythrocyte immune function of duckling. Journal of Northeast Agricultural University, 2019, 50(1): 45-51. doi: 10.19720/j.cnki.issn.1005-9369. 2019.01.006. (in Chinese)
[20] NOMBELA I, LOPEZ-LORIGADOS M, SALVADOR-MIRA M E, PUENTE-MARIN S, CHICO V, CIORDIA S, MENA M C, MERCADO L, COLL J, PEREZ L, ORTEGA-VILLAIZAN M D M. Integrated transcriptomic and proteomic analysis of red blood cells from rainbow trout challenged with VHSV point towards novel immunomodulant targets. Vaccines (Basel), 2019, 7(3): 63-91. doi: 10.3390/vaccines7030063.
[21] 卫含伟, 朱娜娜, 王欢, 刘小倩, 段立双, 周循, 郭建荣. 改良保存液处理红细胞对糖尿病小鼠创面愈合的影响. 基础医学与临床, 2020, 40(8): 1031-1036. doi: 10.16352/j.issn.1001-6325.2020. 08.003.
WEI H W, ZHU N N, WANG H, LIU X Q, DUAN L S, ZHOU X, GUO J R. Influences on wound healing in diabetic mice by blood transfusion treated with improved blood preservation solution. Basic & Clinical Medicine, 2020, 40(8): 1031-1036. doi: 10.16352/j.issn. 1001-6325.2020.08.003. (in Chinese)
[22] SUN Y G, YIN W, FAN X F, FAN K H, JIANG J B, LI H Q. The cytological observation of immune adherence of porcine erythrocyte. Cell Communication & Adhesion, 2012, 19(5/6): 79-84. doi:10.3109/ 15419061.2012.743999.
[23] 张静静, 王春, 贾瑞璞, 尹伟, 范阔海, 孙娜, 孙耀贵, 李宏全. 猪红细胞免疫黏附功能与CR1-like表达水平的研究. 中国兽医科学, 2018, 48(5): 593-604. doi: 10.16656/j.issn.1673-4696.2018. 0114.
ZHANG J J, WANG C, JIA R P, YIN W, FAN K H, SUN N, SUN Y G, LI H Q. Study on immune adhesion function and CRl-like expression level of porcine erythrocytes. Chinese Veterinary Science, 2018, 48(5): 593-604. doi: 10.16656/j.issn.1673-4696.2018. 0114. (in Chinese)
[24] 张琪琪, 凌小雅, 孙雨晨, 尹伟, 范阔海, 孙娜, 孙耀贵, 李宏全. 猪红细胞类补体受体I型膜结合蛋白的筛选. 中国兽医科学, 2020, 50(1): 42-48. doi: 10.16656/j.issn.1673-4696.2019.0213.
ZHANG Q Q, LING X Y, SUN Y C, YIN W, FAN K H, SUN N, SUN Y G, LI H Q. Screening of membrane-binding proteins of complement receptor 1-like on porcine erythrocytes. Chinese Veterinary Science, 2020, 50(1): 42-48. doi: 10.16656/j.issn.1673-4696.2019.0213. (in Chinese)
[25] YIN W, WANG C, FAN K H, SUN N, SUN Y G, LI H Q.observation: the GFP-.adhering to porcine erythrocytes can be removed by porcine alveolar macrophages. Peer J, 2019, 7: e6439. doi: 10.7717/peerj.6439.
[26] 贾瑞璞, 凌小雅, 孙雨晨, 尹伟, 范阔海, 孙娜, 孙耀贵, 李宏全. 猪CR1-like蛋白酵母双杂交诱饵质粒的构建及鉴定. 中国兽医杂志, 2020, 56(1): 5-9.
JIA R P, LING X Y, SUN Y C, YIN W, FAN K H, SUN N, SUN Y G, LI H Q.Construction and identification of yeast two-hybrid bait plasmid for porcine erythrocyte CR1-like protein. Chinese Journal of Veterinary Medicine, 2020, 56(1): 5-9.(in Chinese)
[27] LUCHENA C, ZUAZO-IBARRA J, ALBERDI E, MATUTE C, CAPETILLO-ZARATE E. Contribution of neurons and glial cells to complement-mediated synapse removal during development, aging and in Alzheimer's disease. Mediators of Inflammation, 2018, 2018: 2530414. doi: 10.1155/2018/2530414.
[28] 石莉. 血清免疫球蛋白、红细胞免疫及外周血T淋巴细胞亚群检验对治疗小儿肺炎支原体感染的临床观察. 世界最新医学信息文摘(连续型电子期刊), 2019, 19(73): 195, 197. doi: 10.19613/j.cnki. 1671-3141.2019.73.127.
SHI L. Clinical observation of serum immunoglobulin, erythrocyte immunity and peripheral blood T lymphocyte subgroup test in the treatment of children with Mycoplasma pneumoniae infection. World Latest Medicine Information, 2019, 19(73): 195, 197. doi: 10.19613/ j.cnki.1671-3141.2019.73.127. (in Chinese)
[29] 张壮龙, 田红卫, 李克鑫, 张然, 王诚, 李倩, 李克钦, 牛绪东, 张元瑞, 刘建柱. 猪附红细胞体感染. 猪业科学, 2020, 37(11): 99-102.
ZHANG Z L, TIAN H W, LI K X, ZHANG R, WANG C, LI Q, LI K Q, NIU X D, ZHANG Y R, LIU J Z. Swinesuis infection. Swine Industry Science, 2020, 37(11): 99-102.(in Chinese)
[30] BUSUTTI M, DIOMEDI-CAMASSEI F, DONADELLI R, MELE C, EMMA F, VIVARELLI M. Efficacy of eculizumab in coexisting complement C3 glomerulopathy and atypical hemolytic uremic syndrome. Kidney International Reports, 2021, 6(2): 534-537. doi: 10.1016/j.ekir.2020.10.037.
[31] YIN W, CUI J Y, JIANG J B, ZHAO J X, FAN K H, SUN N, WANG Z W, SUN Y G, MA H L, LI H Q. The immune adherence receptor CR1-like existed on porcine erythrocytes membrane. Scientific Reports, 2015, 5: 13290. doi: 10.1038/srep13290.
[32] CHENG J, JIANG J B, ZHAO J X, WANG Z R, SUN Y G, MA H L, FAN K H, YIN W, SUN N, WANG Z W, ZHAO X, LI H Q. Cloning and bioinformatics analysis of a full-length cDNA of porcine CR1-like gene. Acta Biochimica et Biophysica Sinica, 2014, 46(11): 997-1000. doi: 10.1093/abbs/gmu084.
[33] 公惟欣, 尹伟, 王春, 范阔海, 孙娜, 孙耀贵, 李宏全. 长白猪CR1-like基因单核苷酸多态性和拷贝数变异的研究. 黑龙江畜牧兽医(上半月), 2018(6): 113-118, 254. doi: 10.13881/j.cnki.hljxmsy. 2018. 02.0141
GONG W X, YIN W, WANG C, FAN K H, SUN N, SUN Y G, LI H Q. Study on single nucleotide polymorphism and copy number variation of CR1-like gene in landrace. Heilongjiang Animal Science and Veterinary Medicine, 2018(6): 113-118, 254. doi: 10.13881/j.cnki. hljxmsy.2018. 02.0141. (in Chinese)
[34] 薛翼鹏. 猪CR1-like单克隆抗体的制备及CR1-like在猪红细胞膜表面分布状态的研究[D]. 太谷: 山西农业大学, 2015.
XUE Y P. The monoclonal antibody of porcine CR1-like and its distribution on erythrocyte membrane[D]. Taigu: Shanxi Agricultural University, 2015. (in Chinese)
[35] 王春. 猪肺泡巨噬细胞移除红细胞免疫粘附致敏GFP-的研究[D]. 太谷: 山西农业大学, 2019.
WANG C. Study on porcine alveolar macrophages removing opsonizedGFP-from erythrocytes[D]. Taigu: Shanxi Agricultural University, 2019. (in Chinese)
Detection of Interaction Between Porcine Type I Complement Receptor and C3b Active Fragment
SUN YuChen, JIA RuiPu, FAN KuoHai, SUN Na, SUN YaoGui, SUN PanPan, LI HongQuan, YIN Wei
College of Veterinary Medicine, Shanxi Agricultural University, Taigu 030801, Shanxi
【】In order to provide scientific data for elucidating the molecular mechanism of porcine erythrocyte immune adhesion function, it was investigated whether CR1-like (Complement receptor 1-like, CR1-like) of porcine erythrocyte could bind to the C3b or not.【】In this study, the recombinant plasmids ofCR1-likeandCR1-likefunctional domain fragments were constructed first, which were used to establish a yeast two-hybrid detection system. The bait plasmid (recombinant pGBKT7-CR1-like) and capture plasmid (recombinant pGADT7-C3b) were co-transformed into Y2HGold yeast cells. The single deficient SD/-Leu, SD/-Trp and double-deficient SD/-Leu/-Trp (DDO) media were used to strictly screen the co-transformed yeast cells. Then, according to the expression of report factor, the growth of transformants were identified on the double-deficient medium SD/-Leu/-Trp/X-α-Gal (DDO/X) or SD/-Leu/-Trp/X-α-Gal/Aba (DDO/X/A) combined with the color change phenomenon of the colony to comprehensively determine whether CR1-like active fragments and complement C3b bind to each other in yeast cells or not. The CR1-like-C3b binding complex in yeast cells was then separated by immunoprecipitation, and the specificity of the complex was identified by Western blot. 【】The co-transformed yeast clones showed normal growth on SD/-Leu, SD/-Trp, DDO and DDO/X, DDO/X/A media with blue color colonies, and this indicated that positive yeast colonies were successfully obtained.The results of PCR reverse identification showed that the co-transformed yeast contained the target genesand. The C3b gene fragment appeared after the plasmid was digested, indicating that the recombinant plasmid pGBKT7-CR1-like and pGADT7-C3b were successfully co-transformed into yeast cells. In the immunoprecipitation test, the tag antibody c-Myc of the pGBKT7 vector was used to precipitate the fusion protein in yeast cells.Western blot detection with c-Myc as the primary antibody revealed that the fusion protein transformed pGBKT7-CR1-like(3-6)and pGBKT7-CR1-like(8-11)separately showed a specific band at 50kDa; the yeast fusion protein co-transformed with pGBKT7-CR1-like(3-6)+ pGADT7-C3b and pGBKT7-CR1-like(8-11)+ pGADT7-C3b showed a specific band at 83kDa;when the HA monoclonal antibody was used as the primary antibody for Western blot detection, no specific bands appeared in the pGBKT7-CR1-like(3-6)and pGBKT7-CR1-like(8-11)fusion proteins, and only the yeast fusion protein co-transformed in lane 3 and 4 showed a specific band at 83kD. It showed that there was a complex of CR1-like and C3b in Y2HGold yeast cells. Using CR1-like monoclonal antibody to precipitate the fusion protein in yeast cells, Western blot detection with CR1-like as the primary antibody revealed that the fusion protein transformed with pGBKT7-CR1-like(3-6)and pGBKT7-CR1-like(8-11)separately showed a specific band at 50kD;the yeast fusion protein co-transformed with pGBKT7-CR1-like(3-6)+ pGADT7-C3b and pGBKT7-CR1-like(8-11)+ pGADT7-C3b showed a specific band at 83kD;when the C3 monoclonal antibody was used as the primary antibody for Western blot detection, no specific bands appeared in the pGBKT7-CR1-like(3-6)and pGBKT7-CR1-like(8-11)fusion proteins,lanes 3 and 4 showed that only the co-transformed yeast fusion protein had a specific band at 83kD. This indicated that there was a biologically active CR1-like and C3b binding complex in Y2HGold yeast cells.The bait plasmid expression productsCR1-like,CR1-likefragments and capture plasmid expression products C3b fragment could be combined in yeast cells.【】In summary, the recognition ligand for porcine erythrocyte CR1-like to exert immune adhesion function was C3b, which provided an important data basis for the further analysis of the molecular structure of CR1-like functional domain.
CR1-like; C3b; yeast two-hybrid; immune adherence

10.3864/j.issn.0578-1752.2021.19.018
2021-03-09;
2021-05-12
国家自然科学基金项目(31640082)、国家自然科学基金青年科学基金项目(31702221)、山西省研究生优秀创新项目(2019SY216)
孙雨晨,Tel:15935454178;E-mail:15935454178@163.com。通信作者李宏全,Tel:0354-6288409;E-mail:livets@163.com。通信作者尹伟,Tel:15835058784;E-mail:dkyyinwei@126.com
(责任编辑 林鉴非)

