花后低温对小麦胚形态发育的影响
余徐润,顾清钦,冉莉萍,姚慧慧,臧 勇,熊 飞
(1.江苏省作物遗传生理国家重点实验室培育点/粮食作物现代产业技术协同创新中心/扬州大学教育部农业与农产品安全国际合作联合实验室,扬州大学,江苏扬州 225009; 2.扬州大学广陵学院,江苏扬州 225128)
胚是小麦籽粒最重要的器官之一,由胚芽、包裹在胚芽外的胚芽鞘、胚根、包在胚根外的胚根鞘、胚轴和子叶组成,在谷物萌发过程中对器官再生起重要作用[1]。小麦胚约占种子总重量的2.5%~3.8%,是制粉工业的重要副产品,含有丰富的碳水化合物、蛋白质和脂肪,另外还含有维生素、矿物质、黄酮类物质和凝集素等多种保健因子,是浓缩营养素的独特来源[2-3]。胚的大小和胚乳贮藏物质的含量是影响小麦幼苗活力的重要因素[4]。小麦胚在授粉后6~7 d 进入分化阶段,最初由原胚分化出胚芽,然后出现胚芽鞘,同时胚根开始分化。分化阶段大约在开花授粉后15 d结束。成熟胚包括有盾片、胚芽鞘、茎生长点、胚根、胚根鞘等部分[5]。
小麦的生长和发育容易受到各种生物和非生物胁迫的影响,例如干旱、盐分、低温等。Attila等[6]观察了干旱胁迫对干旱敏感性和耐旱性小麦在授粉后第5~9 d籽粒形态、淀粉含量和籽粒产量的影响,结果表明,干旱胁迫下小麦胚面积减少,糊粉细胞的发育和胚珠周围细胞层的降解速度明显加快。魏松德等[7]发现,低温处理后,小麦胚在萌发后期生长速度降低,且在低温处理过程中,小麦胚的RNA和DNA含量均显著增加。Attila等[8]和Liu等[9]研究发现,可溶性糖和脯氨酸有助于维持细胞内的渗透压,并防止因冷应激而引起的原生质过度脱水。Zhang等[10]研究表明,冬小麦品种具有较强的渗透调节能力、光合作用能力和抗氧化酶活性恢复能力,以及较低的脂质过氧化水平。开花后颖果发育前期是小麦颖果灌浆的关键时期,在此时期遭遇低温冷害,颖果发育会受到明显影响。白光志等[11]研究发现,花期低温处理抑制晚稻光合作用,4 d及以上的低温处理显著降低结实率,减慢籽粒灌浆过程,造成减产。因此,探明花后低温对小麦胚形态发育的影响,能有效解析晚春霜冻害改变小麦品质的机理,但目前有关花后低温对小麦胚形态发育的影响鲜有报道。本研究以耐寒性有差异的春性小麦和半冬性小麦品种为材料,利用树脂半薄切片和显微结构观察,同时结合Image-Pro Plus软件,系统分析了花后低温处理下小麦胚外观形态和内部显微结构的变化,以期揭示花期低温对小麦胚形态结构发育的影响,进一步丰富小麦生长发育对倒春寒的响应机制。
1 材料与方法
1.1 试验材料
供试材料为春性小麦品种扬麦15和半冬性小麦品种烟农19,由江苏省里下河地区农科所提供。2019-2020年度种植于扬州大学江苏省作物栽培重点实验室试验棚内。使用盆栽方式种植,每盆播种20粒种子,在三叶期疏苗,每盆保留8棵。在小麦开花季节,采用植株挂牌记号笔标花的方法,准确记录穗中部小穗基部小花的开花日期。
1.2 低温处理
在小麦开花后6 d,进行人工低温处理。试验在人工气候箱内进行,气候箱内湿度75%,低温处理组温度为白天10 ℃(08:00-18:00),光照20 000 lx,夜间4 ℃(18:00-08:00);对照常温处理组温度为白天20 ℃(08:00-18:00),光照 20 000 lx,夜间10 ℃(18:00-08:00)。低温处理连续进行3 d,直到开花后8 d低温处理结束。低温结束后将小麦盆栽搬回试验大棚进程常规水肥管理。
1.3 组织化学染色
取花后16 d、24 d和32 d的小麦颖果,用洁净的剃须刀片将颖果中部纵切,置于体视显微镜下观察并拍照,将纵切后的小麦颖果放入配置好的0.5%氯化三苯基四氮唑(TTC)染液中,黑暗条件下37 ℃染色30 min,置于体式显微镜下观察并拍照。
1.4 显微结构观察
取开花后16 d、24 d和32 d的小麦颖果,将颖果中部横切,再纵向切取颖果片段,厚约 2 mm,迅速置于25 mg·-1的戊二醛中,4 ℃固定4 h,样品经磷酸缓冲液(pH=7.2)清洗、乙醇梯度脱水、环氧丙烷置换、Spurr树脂浸透与包埋后,在70 ℃恒温干燥箱中聚合12 h,制成树脂胶囊样品。用超薄树脂切片机切1 μm厚的薄片,然后用0.5%甲基紫染色10 min,在光学显微镜下观察并拍照。每个样品重复3次。
1.5 胚面积计算
使用图像分析软件Adobe Photoshop和Image-Pro Plus对拍摄的显微图像进行处理,将标尺设定后利用软件中的面积分析工具测量麦胚的面积。
1.6 数据统计与分析
用Excel 2016统计试验结果,用SPSS 19.0中LSD法进行显著性检验,用Adobe Photoshop图像处理软件处理图片。
2 结果与分析
2.1 低温对小麦胚中脱氢酶活性的影响
TTC染色是TTC与活细胞线粒体内多种脱氢酶反应,生成红色的三苯甲臜,可用来表示细胞的活力。从图1可以看出,随着花后天数的增加,胚尺寸逐渐变大。对于扬麦15而言,花后16 d,胚基本不被着色,常温处理组与低温处理组无明显差异;花后24 d,常温处理组小麦胚着色程度明显高于低温处理组;花后32 d,胚着色程度加深,且常温处理组盾片染色程度比低温处理组深。对于烟农19而言,花后16 d和32 d,常温处理和低温处理组胚着色程度均无明显差异;花后24 d,常温处理组胚着色程度高于低温处理组。与扬麦15相比,花后16 d和24 d,烟农19胚的着色程度较高,说明烟农19胚的发育进程快,同一发育时期胚内脱氢酶活性强。以上结果表明,低温处理会导致小麦胚脱氢酶活性降低,在花后24 d表现最为明显。

NTT:常温处理;LTT:低温处理。下同。每个方框中左图为未染色颖果纵切面,右图为TTC染色颖果纵切面。
2.2 低温对小麦胚分化的影响
从图2可以看出,随着发育天数的增加,常温处理组小麦胚面积逐渐增大,结构逐渐分化,而低温处理组小麦胚发育较缓慢,结构分化程度也慢于常温处理组。花后16 d,扬麦15的常温处理组与低温处理组胚均未出现明显分化;而烟农19的常温处理组出现明显的盾片和胚根原基分化,而低温处理组盾片分化不明显,说明扬麦15胚的发育进程比烟农19慢。花后24 d,扬麦15的常温处理组胚分化出现明显的盾片和胚根原基结构,胚尺寸整体大于低温处理组;而烟农19的常温处理组已出现明显的胚芽分化,分化进程明显快于低温处理组。花后32 d,胚根原基进一步分化,可观察到胚根鞘、胚根及根冠,胚芽结构明显,可明显观察到胚芽鞘、第一叶原始体和茎生长点。总体而言,与扬麦15相比,烟农19胚发育进程和结构分化较快,而低温处理延缓了这一进程。

图2 常温和低温处理下小麦胚的显微结构
利用Image-Pro Plus软件对小麦胚进行面积计算,结果发现,在花后16 d、24 d和32 d,小麦胚面积逐渐增加,烟农19胚面积均显著大于扬麦15(表1)。花后16 d,扬麦15的常温处理组与低温处理组均无显著差异,烟农19的常温处理组胚面积显著大于低温处理组。花后24 d和32 d,两品种常温处理组麦胚面积均显著大于低温组。
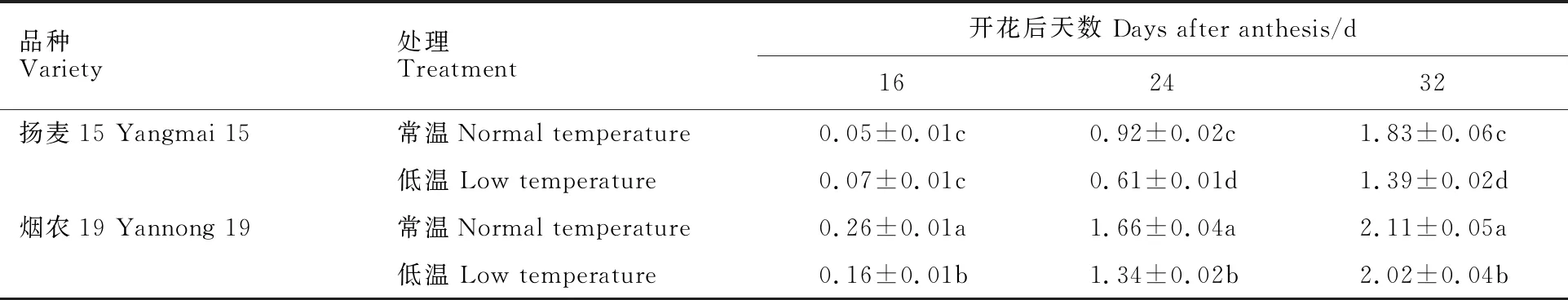
表1 低温处理对小麦胚面积的影响
以上结果表明,低温影响小麦胚面积的增长和结构的分化。低温对不同小麦品种的影响程度不同,春性小麦受影响程度大于冬性小麦。
2.3 低温处理后胚相关组织显微结构的变化
2.3.1 盾片上皮细胞与薄壁细胞的变化
根据细胞形态的不同,盾片上皮细胞可分为颈部上皮细胞和底部上皮细胞两个区域。从图3可以看出,花后24 d,两小麦品种常温处理组盾片底部上皮细胞层数明显多于颈部上皮细胞,而低温处理组细胞层数变化不明显,但底部上皮细胞略长于颈部上皮细胞;两个小麦品种常温处理组和低温处理组薄壁细胞形状均不规则,常温处理组底部薄壁细胞贮藏物质均多于颈部薄壁细胞。扬麦15低温处理组薄壁细胞贮藏物质少于同部位常温处理组,而烟农19低温处理组薄壁细胞贮藏物质多于同部位常温处理组。花后32 d,两小麦品种低温处理组盾片上皮细胞尺寸明显变大,层数增多,细胞排列紧密;薄壁细胞体积增大,贮藏物质增多。低温处理组盾片上皮细胞层数、形态、薄壁细胞贮藏物质的积累变化与花后24 d规律类似。

A:颈部上皮细胞;B:颈部薄壁细胞;C:底部上皮细胞;D:底部薄壁细胞。
总体而言,扬麦15盾片上皮细胞层数少于烟农19,薄壁细胞面积也小于烟农19。以上结果表明,低温处理影响盾片细胞发育,抑制上皮细胞的伸长和盾片底部上皮细胞层数的增多,同时使得薄壁细胞贮藏物质增多。
2.3.2 胚芽、胚轴和胚根的变化
从图4可以看出,花后24 d,两个小麦品种胚芽细胞常温处理组和低温处理组均未出现明显分化,细胞核明显,排列紧密,多为扁长形;常温处理组胚轴薄壁细胞内积累的贮藏物质明显多于低温处理组,其中烟农19常温处理组染色程度较浅;常温处理组胚根细胞系列排列呈栅栏状,而低温处理组胚根细胞形状不规则。花后32 d,两个小麦品种常温处理组的胚芽细胞分化出明显茎生长点,细胞体积较大,形状不规则,细胞核变大,而低温处理组胚芽细胞体积和细胞核体积均明显小于常温处理组;两个小麦品种常温处理组胚轴薄壁细胞内积累的贮藏物质颗粒明显多于低温处理组,这和24 d的规律类似;两个小麦品种常温处理组和低温处理组胚根细胞形态无明显差别。以上结果表明,低温对小麦胚芽、胚轴和胚根分化有影响,其中对胚轴薄壁细胞内贮藏物质的积累影响较大,低温处理降低了贮藏物质的积累量。
2.3.3 输导细胞的变化
从图5可以看出,花后16 d,扬麦15常温处理组和低温处理组输导细胞均开始出现轻微解体,大部分为空细胞;烟农19常温处理组输导细胞积累了少量淀粉体,而低温处理组输导细胞未积累淀粉体,这说明烟农19在常温处理下胚乳表层的输导细胞发育较快,淀粉积累较早。花后24 d,两个小麦品种常温处理组和低温处理组输导细胞均明显解体,出现折叠层,烟农19的输导细胞附近胚乳细胞淀粉体相对较多,而扬麦15几乎没有淀粉体积累,且常温处理组输导细胞解体比低温处理组明显,细胞折叠层数较多。花后32 d,输导细胞基本全部解体,部分或全部折叠,折叠层数远多于24 d。烟农19输导细胞的解体及折叠过程均早于扬麦15。以上结果表明,在花后24 d,低温处理对输导细胞的影响较为明显,减慢了输导细胞的解体进程。
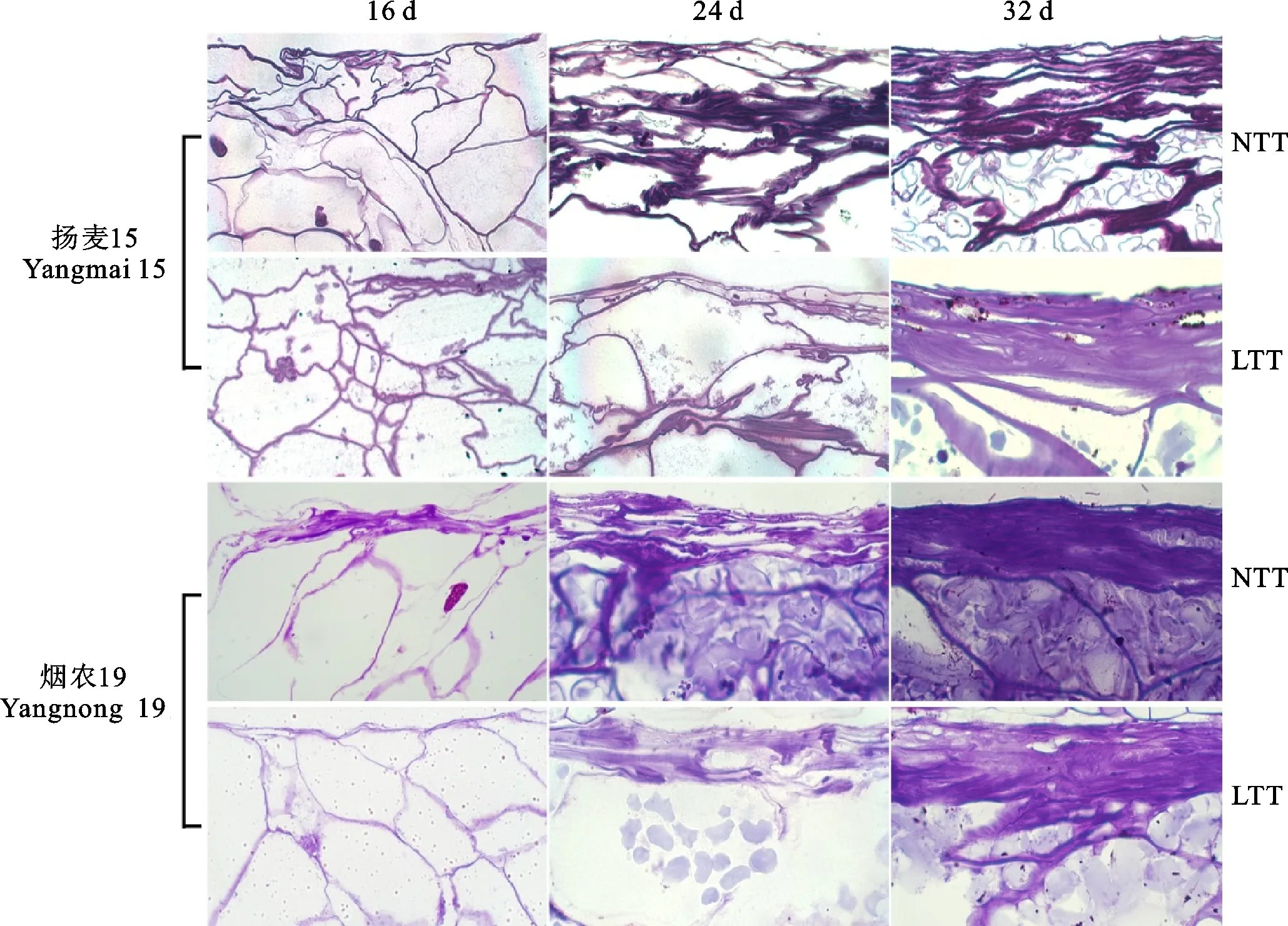
图5 低温处理对小麦颖果输导细胞显微结构的影响
3 讨 论
本研究发现,花后低温导致小麦胚结构分化延迟,体积增长减慢。不同小麦品种胚发育进程对低温的响应程度不同,春性小麦所受影响大于半冬性小麦。
Pomeroy等[12]将冬小麦初生叶片的细胞分离,并暴露于低温胁迫下,发现低温状态下细胞悬浮液中分离细胞的活力急剧下降。这与本试验结果类似,本试验中小麦胚细胞在低温处理下细胞脱氢酶活性下降,这说明低温导致小麦胚细胞新陈代谢水平降低。徐 澜等[13]以10种冬小麦品种为材料,发现在低温胁迫下,耐寒小麦品种的籽粒产量明显高于其他品种。高志强等[14]研究发现,在小麦生长发育过程中,要求较长低温春化时间的品种,抗寒性不一定强;但抗寒性强的品种,要求的春化时间一般较长,且低温春化特性与抗寒性是品种的两种特性,低温春化有利于小麦抗寒性的形成。高立伟[15]研究发现,半冬性品种一般耐寒性较强,弱春性品种一般耐寒性较差,这与本研究的结论相一致。本研究中两个小麦品种受花后低温影响的程度不同,春性小麦胚面积的下降幅度高于半冬性小麦。低温能够延迟小麦胚的发育时期,影响胚面积的增长和结构的分化。杨 阳等[16]研究发现,在萌发过程中,小麦盾片上皮细胞由不规则形和多边形向圆形转变,细胞数目呈先减少后增加的趋势,面积呈先增加后呈减小的趋势;薄壁细胞内淀粉体不断变形、塌陷并逐渐降解,蛋白体发生解体,而脂质体先降解后又重新合成。这些结果表明,小麦盾片具有吸收转运养分、贮藏养分及保护胚等功能。本研究中低温处理影响盾片细胞发育,抑制上皮细胞的伸长和盾片底部上皮细胞层数的增多,表明低温影响盾片的发育,抑制盾片转运养分,从而影响胚的发育,减慢胚的发育速度。
Tanida等[17]发现,在低温条件下,水稻种子内部过氧化氢酶活性降低,胚的生长速率也明显降低。刘逸童等[18]研究表明,在低温条件下,不耐低温储藏的水稻种子胚部细胞排列较紧密,细胞间隙较小,细胞膜较完整。这说明低温条件可以更好地维持胚的活力,使胚细胞分裂和分化的能力减弱。本研究也发现,低温处理影响小麦盾片细胞发育,抑制上皮细胞的伸长,使得薄壁细胞贮藏物质增多。这也说明胚的各部分结构发育易受低温的影响。
输导细胞与胚发育密切相关,位于胚乳表层,向胚运输养分[19]。本研究中,常温处理组输导细胞解体较多,且胚发育较快,这可能是由于输导细胞解体后,养分被胚吸收,且常温处理组输导细胞解体进程较快,数目较多,胚吸收的养分也比低温处理组多。而低温处理减慢了输导细胞的解体进程,使营养物质不能及时、足够地运输到胚,导致胚的发育缓慢。
——以韶关市为例

